
Применение первого начала термодинамики к изопроцессам.
Изотермическимназываетсяпроцесс, при котором
термодинамическая система переходит
из одного состояния в другое при
постоянной температуре и неизменной
массе (![]() и
и![]() )
(рис. 3).
)
(рис. 3).
П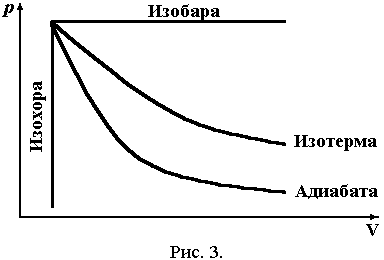 ри
изотерическом процессе соотношение
между давлением и объемом выражается
законом Бойля-Мариотта:
ри
изотерическом процессе соотношение
между давлением и объемом выражается
законом Бойля-Мариотта:
![]() .
.
Изменение внутренней энергии при постоянной температуре отсутствует, поэтому первое начало термодинамики для изотермического процесса имеет вид:
![]() .
.
Рассчитаем работу, совершаемую идеальным газом при постоянной температуре:
 .
.
Из уравнения
Менделеева-Клапейрона
![]() ,
поэтому
,
поэтому
 или
или
![]() .
.
Теплоемкость при изохорном процессе → ∞.
Изохорическим(или изохорным)процессомназывается процесс, при котором
термодинамическая система переходит
из одного состояния в другое при
неизменных объеме и массе системы (![]() и
и![]() ).
).
При изохорном процессе соотношение между давлением и температурой выражается законом Шарля:
![]() .
.
Изменение объема при изохорном процессе равно нулю, поэтому первое начало термодинамики для этого процесса имеет вид:
![]() .
.
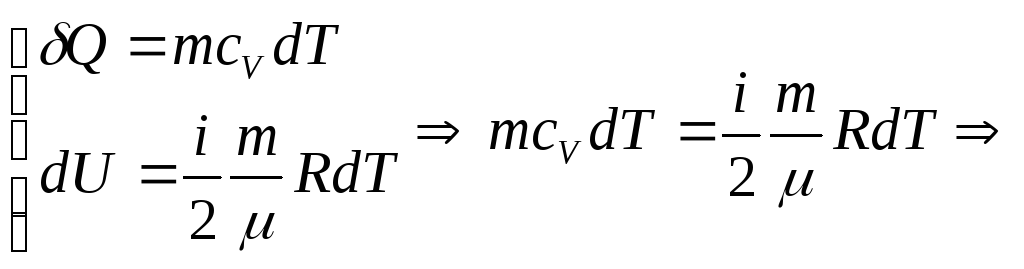
![]() (5)
(5)
(5) - удельная теплоемкость при постоянном объеме.
Молярная теплоемкость при постоянном объемеравна:
![]() . (6)
. (6)
Изобарическим(или изобарным) называетсяпроцесс,
при котором термодинамическая система
переходит из одного состояния в другое
при неизменных давлении и массе системы
(![]() и
и![]() ).
).
При изобарном процессе соотношение между объемом и температурой выражается законом Гей-Люссака:
![]() .
.
Первое начало термодинамики для изобарного процесса имеет вид:
![]() .
.
Вычислим теплоемкость при постоянном давлении.

![]() (7)
(7)
(7) - удельная теплоемкость при постоянном давлении.
Молярная теплоемкость при постоянном давленииравна:
![]() . (8)
. (8)
Из сравнения формул (6) и (8):
![]() (9)
(9)
Уравнение (9) - уравнение Роберта Майера.
Адиабатическим(или адиабатным) называется такойпроцесс, при котором термодинамическая система переходит из одного состояния в другое без теплообмена с внешними по отношению к этой системе телами. Практически адиабатный процесс всегда происходит при достаточно быстром расширении или сжатии газа. Условие адиабатичности будет выполнено, если процесс протекает так быстро, что теплообмен между газом и внешней средой не успевает произойти.
Из рис. 3 видно, что адиабата идет круче, чем изотерма. Объясняется это тем, что при адиабатном сжатии увеличение давления газа обусловлено не только уменьшением его объема, как при изотермическом сжатии, но и повышением температуры.
При адиабатном расширении газа его температура понижается, и поэтому давление газа падает быстрее, чем при изотермическом расширении.
Уравнение адиабатического процесса – уравнение Пуассона PVγ =const. Отношение Cp /Сv=γ называется коэффициентом Пуассона.
Непосредственное измерение удельных и молярных теплоемкостей затруднительно, так как теплоемкость газа составит ничтожную долю теплоемкости сосуда, в котором находится газ, и поэтому измерение будет чрезвычайно неточно.
Проще измерить отношение величин Сp/Сv :
![]() Это отношение
зависит только от числа степеней свободы
молекул, из которых состоит газ.
Это отношение
зависит только от числа степеней свободы
молекул, из которых состоит газ.
