
- •Аннотация
- •1. Введение
- •1.1 Общие правила выполнения лабораторных работ.
- •1.2. Лабораторное оборудование.
- •1.3 Вычисления.
- •1.4 Количество и концентрация вещества.
- •Общие указания по выполнению лабораторных работ.
- •Работа 1. Ознакомление с некоторыми операциями лабораторной практики и измерительными приборами.
- •Работа 2. Классы неорганических соединений.
- •Работа 3. Определение молярной массы диоксида углерода.
- •Работа 4. Электронная структура атомов и одноатомных ионов.
- •Работа 5. Кинетика химических реакций.
- •Работа 6. Химическое и адсорбционное равновесие.
- •Работа 7. Концентрация растворов.
- •Работа 8. Свойство водных растворов электролитов.
- •Работа 9.Гидролиз солей.
- •Работа 10. Окислительно-восстановительные реакции.
- •Работа 11. Основы электрохимии.
- •Работа 12. Электролиз.
- •Работа 13. Общие химические свойства металлов.
- •Работа 14. Свойства d-элементов 4-го периода.
- •Работа 15. Свойства элементов, применяемых в полупроводниковой технике.
- •Работа 16. Определение жесткости и умягчение воды.
- •Работ 17 Органические соединения.
- •Работа. 18. Свойства элементов подгруппыViв иViiв
- •Работа 19. Свойства элементов подгруппыViiib.
- •Работа 20. Свойства элементов подгруппыIva.
- •Работа 21, Свойства элементовVAиVia.
Работа 8. Свойство водных растворов электролитов.
Цель работы: ознакомится с электропроводностью растворов, ионными равновесиями в растворах электролитов.
Согласно теории электролитической диссоциации электролиты при растворении в воде распадаются (диссоциируют) на положительно и отрицательно заряженные ионы. Этот процесс можно выразить уравнением:
![]()
Как видно из уравнения, этот процесс равновесный, а следовательно, константа равновесия может быть выражена через равновесные концентрации:
![]()
Константа равновесия характеризует диссоциацию вещества в растворах и носит название константа диссоциации.
Величина
![]() зависит от природы электролита и
растворителя, а также от температуры,
но не зависит от концентрации раствора.
зависит от природы электролита и
растворителя, а также от температуры,
но не зависит от концентрации раствора.
Константа
диссоциации (![]() )
является величиной, характеризующий
способность электролита к диссоциации.
Например:
)
является величиной, характеризующий
способность электролита к диссоциации.
Например:
![]()
Константа диссоциации уксусной и угольной кислоты соответственно равны:

Сравнивая значения этих констант, можно сказать, что у угольной кислоты способность к диссоциации на ионы меньше, чем у уксусной.
Степень
диссоциации
![]() и константа диссоциации
и константа диссоциации![]() слабого
электролита связанны между собой
зависимостью (закона Оствальда):
слабого
электролита связанны между собой
зависимостью (закона Оствальда):
![]()
где
![]() - разведение раствора, л/моль.
- разведение раствора, л/моль.
Все электролиты можно разделить на две группы: сильные и слабые электролиты. Сильные растворы в водных электролитах диссоциируют полностью. Слабые электролиты в водных растворах диссоциируют частично, и в растворе устанавливается динамическое равновесие между недиссоциированными молекулами и ионами.
В растворах электролитов осуществляется межионное взаимодействие, обусловленное силами притяжения и отталкивания. Наиболее заметны межионные взаимодействия в растворах сильных электролитов. Для количественной характеристики межионных взаимодействий используется ионная сила раствора I (полусумма произведений концентраций всех ионов, присутствующих в растворе, на квадрат их заряда):
![]()
Зная ионную силу раствора I, можно найти коэффициент f, позволяющий определить некоторую величину А (активность), формально заменяющую концентрацию С при математических описаниях свойств растворов электролитов:
![]()
![]() -
коэффициент активности иона, который
является функцией ионной силы раствора
I
и заряда иона
-
коэффициент активности иона, который
является функцией ионной силы раствора
I
и заряда иона
![]() .
.
Количественной
характеристикой способности электролита
проводить электрический ток является
электрическая проводимость. Различают
удельную
![]() и молярную
и молярную![]() электрическую проводимость.
электрическую проводимость.
Сильные
электролиты диссоциируют в растворе
полностью, но на границе малорастворимого
сильного электролита с раствором ионы
из осадка переходят в раствор и вновь
возвращаются на поверхность твердого
вещества, т.е. устанавливается
равновесие между осадком и его ионами.
Например:
![]() .
.
Растворение вещества происходит до тех пор, пока не установится равновесие между осадком и его ионами в растворе. В момент наступления равновесия раствор становится насыщенным. Количественно это равновесие можно охарактеризовать константой равновесия:

Так
как концентрация твердой соли - величина
постоянная, то, умножая величину константы
равновесия на эту концентрацию, мы
получаем новую константу:
![]() .
.
Таким
образом, в насыщенном растворе
малорастворимого электролита произведение
концентраций ионов является величиной
постоянной при данной температуре.
Эта величина называется произведением
растворимости
![]() :
:![]() .
.
Зная
величину произведения растворимостей,
можно вычислить концентрацию
труднорастворимого электролита в
насыщенном растворе. Например:
![]()
![]()
откуда
![]() ионов
ионов![]() .
Здесь величину ПР, можно рассчитать,
выпадет или нет данное вещество в осадок.
Например, если 0,001 моль
.
Здесь величину ПР, можно рассчитать,
выпадет или нет данное вещество в осадок.
Например, если 0,001 моль![]() поместить в 1л воды, то все это количество
соли растворится, так как величина
поместить в 1л воды, то все это количество
соли растворится, так как величина![]() меньше
меньше![]() .
Следовательно, этот раствор будет
не насыщенным.
.
Следовательно, этот раствор будет
не насыщенным.
Водородный показатель среды рН.
Вода диссоциирует по уравнению
![]()
Путем
измерения электропроводности было
найдено, что концентрация ионов водорода
в тщательно очищенной воде при
![]() равна 10-7
моль/л.. Это характеризует воду как очень
слабый электролит.
равна 10-7
моль/л.. Это характеризует воду как очень
слабый электролит.
Константа диссоциации воды при 295 К равна 1.8*10-16, а при той же температуре равна примерно 55,56 моль/л.
![]()
отсюда
![]()
Величина
![]() называется ионным произведением воды.
В нейтральных растворах
называется ионным произведением воды.
В нейтральных растворах![]() моль/л
(рН=7), в кислых
моль/л
(рН=7), в кислых![]() моль/л (рН<7) в щелочах
моль/л (рН<7) в щелочах![]() моль/л (рН>7).
моль/л (рН>7).
Вместо концентрации ионов водорода часто пользуются водородным показателем (рН), равному взятому с обратным знаком десятичному логарифму активности ионов водорода в этом растворе.
![]()
Наряду с показателем рН пользуются показателем рОН:
![]()
Исходя
из значений ионного произведения воды
![]() при 295 К
при 295 К
![]()
Для приблизительного определения рН пользуются индикаторами, т.е. веществами, меняющими свою окраску в зависимости от щелочности или кислотности среды. Часто с этой целью применяют лакмус, фенолфталеин, метиловый оранжевый. Изменение окраски различных индикаторов происходит при вполне определенных для каждого из этих значений рН. Например, окраска метилового оранжевого от красной до желтой меняется в интервале рН от 3,1 до 4,4. Промежуток между двумя значениями рН, в котором изменяется окраска индикатора, называется интервалом индикатора.
Интервалы некоторых индикаторов.
|
Индикатор |
Область перехода рН |
Окраска в растворе | |
|
Более кислом |
Более щелочном | ||
|
Малахитовый зеленый |
0,1-2,0 |
Желтая |
Голубовато-зеленый |
|
Метиловый оранжевый |
3,1-4,4 |
Красная |
Желтая |
|
О - нитрофенол |
5,0-7,0 |
Бесцветная |
Желтая |
|
Лакмус |
5,0-8,0 |
Красный |
Синий |
|
Фенолфталеин |
8,2-10,0 |
Бесцветная |
Малиновая |
|
Малахитовый зеленый |
11,2-13,2 |
Голубовато-зеленый |
Бесцветная |
Экспериментальная часть.
ОПЫТ 1. Электропроводность растворов.
Соберите прибор, состоящий из химических стаканов емкостью 250мл; эбонитовый крышки, снабженной двумя универсальными клеймами для закрепления электродов и присоединения проводов; амперметра, вольтметра и лабораторного автотрансформатора (ЛАТР). Электропитание подается из сети через лабораторный трансформатор:
а) сильные и слабые электролиты.
В
четыре стакана емкостью 250 мл налейте
по 150 мл 1М растворов: серной кислоты
![]() ,
уксусной кислоты
,
уксусной кислоты![]() ,
гидроксида калия
,
гидроксида калия![]() и
аммония (раствор
и
аммония (раствор![]() в
воде).
в
воде).
Испытайте последовательно электропроводность этих растворов. Для этого в каждый из стаканов с раствором погрузите электроды, включит ток и запишите показания амперметра. Выключите ток и ополосните электроды дистиллированной водой. Сделайте вывод, какие из испытанные веществ относятся к сильным и какие к слабым электролитам?
б) изменение электропроводности при нейтрализации слабого основания слабой кислотой.
Испытайте электропроводность 25% раствора аммиака (см. опыт а). Слейте раствор аммиака в стакан и прибавляйте к нему понемногу (осторожно) концентрированную уксусную кислоту. Дайте раствору охладиться и снова испытайте его электропроводность. Чем объяснить большую электропроводность раствора?
ОПЫТ 2. Смещение ионного равновесия.
а) к 2М раствору уксусной кислоты прибавьте 2 капли индикатора метилоранжа. Отметьте окраску индикатора (интервал рН перехода окраски индикатор -3,1+4,4). Внесите в ту же пробирку несколько кристаллов ацетата аммония или ацетата натрия. В чем причина изменения окраски индикатора? Рассчитайте, как изменяется рН раствора при добавлении ацетата аммония.
б) к SM раствору гидроксида аммония прибавьте 2 капли индикатора - фенолфталеина. Какую окраску приобрел индикатор? (интервал рН перехода окраски фенолфталеина (8,3+10,0)). В ту же пробирку добавьте несколько кристаллов хлорида аммония. В чем причина изменения окраски индикатора? Рассчитайте, как изменяется рН раствора при добавлении хлорида - аммония.
ОПЫТ 3. Образование осадков и произведение растворимости.
В две пробирки налейте по 3-4 капли 0.005М раствора нитрата свинца. В одну из них прибавьте, такой же объем 0.05М раствора хлорида калия, в другую - такой же объем 0.05М раствора иодида калия. В какой из пробирок выпал осадок? Объясните полученный результат, используя значение произведений растворимости. Составьте уравнения реакций.
Контрольные вопросы и задачи.
Какие вещества называются электролитами?
Почему электролиты называются проводниками электрического тока 2 рода? Какие вещества являются проводниками 1 рода?
Что называется степенью диссоциации? Чему равна степень диссоциации.
Каким образом способность электролитов к диссоциации зависит г вида химической связи?
Напишите уравнение диссоциации
 ,
, ,
, ,
, ,
, ,
,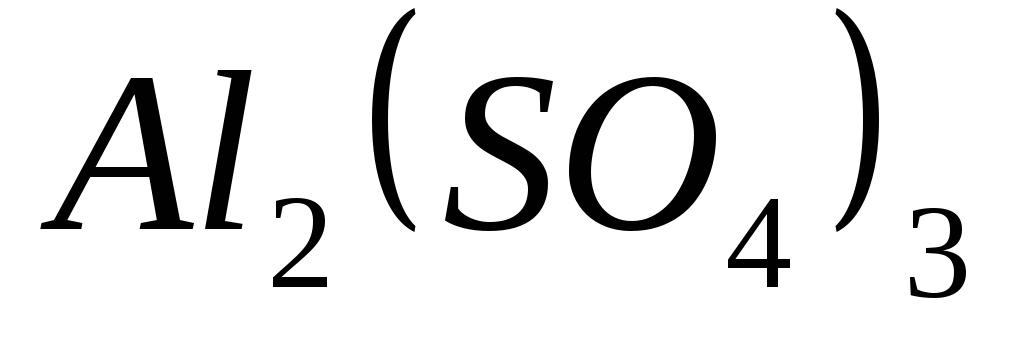 .
.Вычислите степень диссоциации гидроксида аммония в его деци-, санти- и миллимолярных растворах. Постройте график зависимости степени диссоциации
 от концентрации раствора.
от концентрации раствора.Имеются, сантимолярные растворы соляной и уксусной кислоты объясните, в каком из них разница между значениями
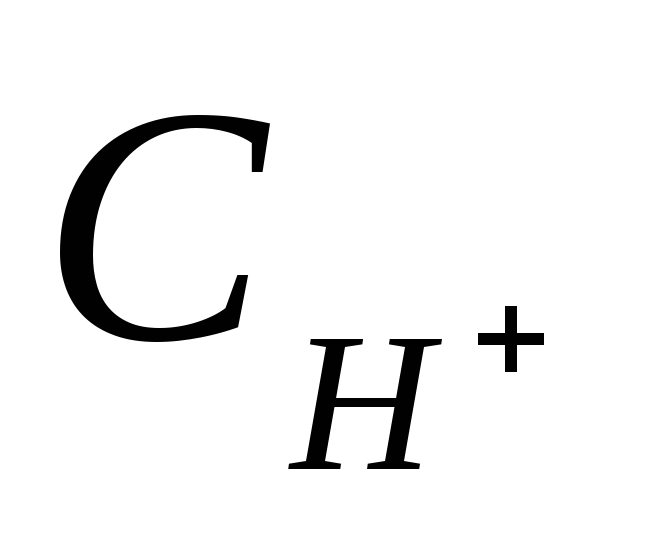 и
и более заметна.
более заметна.Что такое произведение растворимости? Чем объяснить, что реакции:

идут практически только в прямом направлении?
Как влияет на растворимость
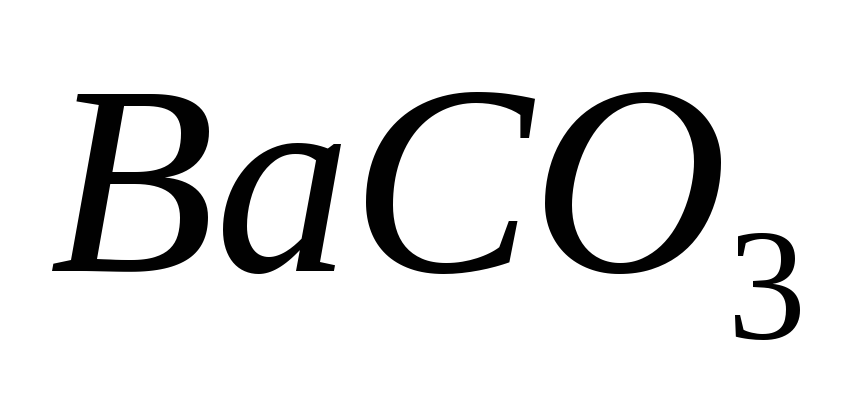 добавление в раствор карбоната натрия?
добавление в раствор карбоната натрия?Зная, что произведение растворимости
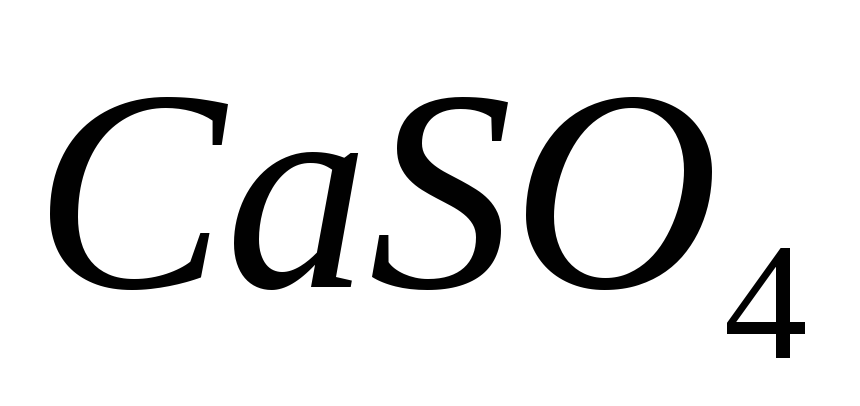 равно 2,3*10-4,
вычислить выпадет ли осадок соли при
сливании 100 мл 0,001М
равно 2,3*10-4,
вычислить выпадет ли осадок соли при
сливании 100 мл 0,001М
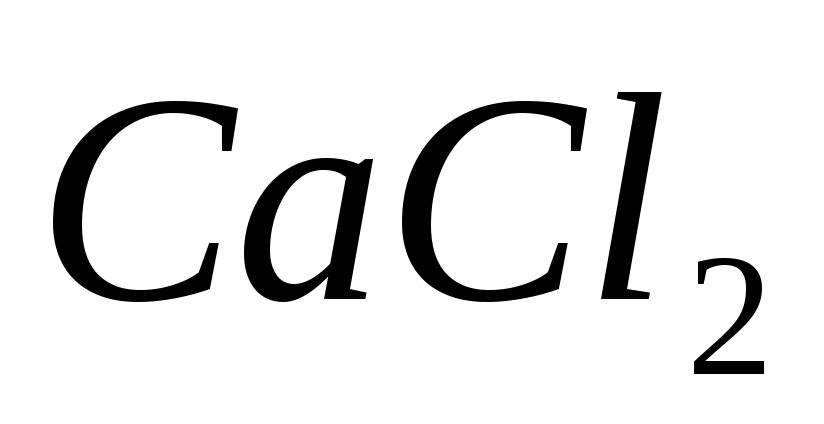 с 100 мл 0.001М
с 100 мл 0.001М .
.
ИОННЫЕ РЕАКЦИИ ОБМЕНА В РАСТВОРАХ ЭЛЕКТРОЛИТОВ.
