
Закон распределения. ЭксТракция.
Если мы имеем две несмешивающиеся жидкости и добавляем туда третий компонент, который растворяется в обеих жидкостях, то отношение концентраций этого компонента есть величина постоянная при данной температуре.
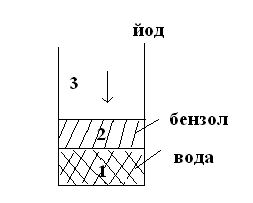
![]() = К, где К – коэффициент распределения
йода между водой и бензолом.
= К, где К – коэффициент распределения
йода между водой и бензолом.
В общем виде K=![]() –закон распределения (1)
–закон распределения (1)
При постоянной температуре коэффициент распределения К есть величина постоянная, т.е. К не зависит:
1) от соотношения объемов жидкостей;
2) от количества добавленного йода.
В такой форме закон распределения справедлив только в том случае, если распределяемое вещество имеет одинаковую молярную массу в обоих растворителях.
Отклонение от закона распределения наблюдается в том случае, если распределяемое вещество ассоциирует или диссоциирует в одной из фаз.
К=![]() ,
(2)
,
(2)
если n=1, то молекулярное состояние не меняется;
если n>1, то идет диссоциация;
если n<1, то идет ассоциация.
Чтобы найти, т.е. определить состояние растворенного вещества в одной из фаз, нужно линеизировать уравнение (2). Логарифмируем уравнение (2) и получаем:
lnK=n∙ln![]() -ln
-ln![]() или
или
ln![]() =n∙ln
=n∙ln![]() -lnK(*)
-lnK(*)
На основе уравнения (*) можно построить график:
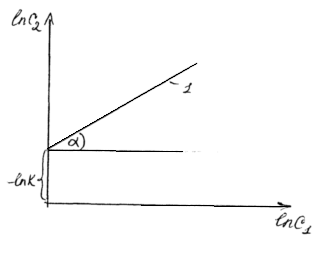
tg![]() =n
=n
Прямая 1 характеризует зависимость ln![]() отln
отln![]() .
Член уравнения –lnKопределяет расстояние прямой 1 от оси
Х. Тангенс угла наклона прямой дает
значениеn.
.
Член уравнения –lnKопределяет расстояние прямой 1 от оси
Х. Тангенс угла наклона прямой дает
значениеn.
Экстракция – это извлечение одного вещества из многокомпонентной системы посредством третьего компонента, который называетсяэкстрагентом.
Требования к экстрагенту:
1) Экстрагент не должен смешиваться с растворителем, из которого происходит экстрация.
2) Экстрагент должен избирательно растворять выделяемое вещество.
3) Наилучшая степень извлечения достигается при добавлении экстрагента небольшими порциями.
4) Количество вещества, извлеченного в результате экстракции, определяется следующими соотношениями:
К=![]() , где
, где
С![]() –
концентрация вещества, оставшегося в
системе после первой экстракции;
–
концентрация вещества, оставшегося в
системе после первой экстракции;
С![]() –
количество вещества, удаляемого из
системы в результате экстракции.
–
количество вещества, удаляемого из
системы в результате экстракции.
С![]() =
=![]() ;C
;C![]() =
=![]() , где
, где
g![]() –
масса экстрагируемого вещества до
экстракции;
–
масса экстрагируемого вещества до
экстракции;
g![]() –
масса вещества, оставшегося после
экстракции;
–
масса вещества, оставшегося после
экстракции;
V![]() –
объем растворителя, в котором добавляется
экстрагент;
–
объем растворителя, в котором добавляется
экстрагент;
V![]() –
объем экстрагента;
–
объем экстрагента;
К – коэффициент распределения (из справочника).
Подставим эти выражения в уравнение коэффициента распределения и получим:
К=![]()
![]()
g![]() =g
=g![]()
![]() –для однократной экстракции
–для однократной экстракции
g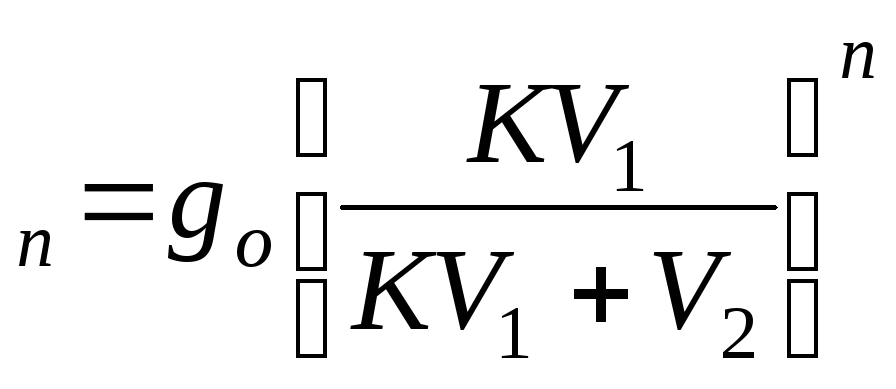 –для многократной экстракции
–для многократной экстракции
где n– количество
добавляемых порций экстрагента;g![]() –
масса оставшегося после экстракции
вещества.
–
масса оставшегося после экстракции
вещества.
g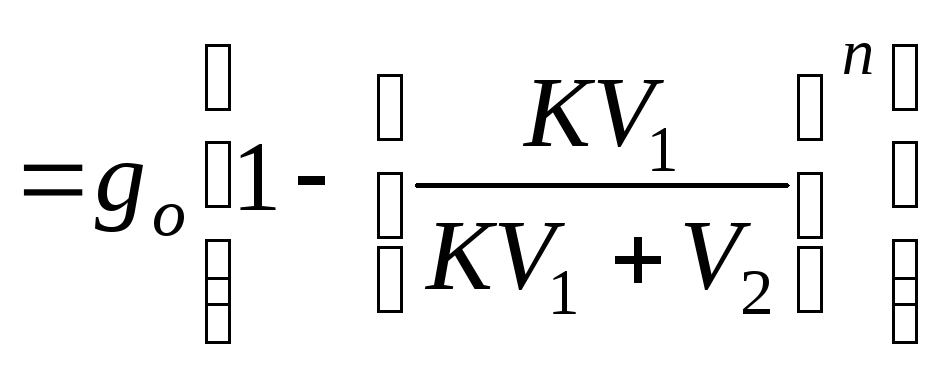
![]() –
количество экстрагируемого вещества.
–
количество экстрагируемого вещества.
ПРИМЕР.
|
Дано: |
Решение: |
|
V g
V К=
g |
1) Однократная экстракция всем объемом растворителя – экстрагента: g 2) Проведем экстракцию 5 раз порциями экстрагента по 10 мл:
Второй метод более выгоден, т.к. йода в воде останется меньше. |
Неидеальные растворы. Активность.
Большинство реальных жидких растворов не обладают свойствами идеальных. У неидеальных растворов концентрация перестает адекватно отражать состояние системы. Поэтому для характеристики свойств реальных растворов используют активность.
Активность, или термодинамическая активность, является условной эффективной концентрацией, которая позволяет уравнения, характеризующие термодинамические свойства идеальных растворов, использовать для реальных растворов.
Активность выражается:
![]() ;
;![]() , где
, где
а – активность; с – молярная концентрация; γ – безразмерный коэффициент активности.
Активность можно выразить через различные концентрации:
![]()
m– моляльная концентрация;
N– мольная доля.
Для разбавленных растворов коэффициенты
активности
![]() примерно равны.
примерно равны.
Коэффициент активности характеризует
степень отклонения свойств реальных
растворов от идеальных. Для идеальных
растворов
![]() .
.
Коллигативные свойства раствора
выражают через изменение химического
потенциала. С учетом формулы
![]() :
:
![]()
Для идеального раствора:
![]()
Поэтому химический потенциал реального
раствора отличается от химического
потенциала идеального раствора на
величину
![]() или
или
![]() .
.
Коэффициент активности соответствует дополнительной работе, которую необходимо затратить при P,T=constдля преодоления взаимодействия между частицами раствора при переносе одного моля компонента идеального раствора в реальный раствор той же концентрации. Менее концентрированному раствору отвечает и меньшая работа переноса. Для идеального раствора эта работа обращается в ноль.
Итак, активность, как аналог концентрации, следует подставить в выражение для химического потенциала компонента идеального раствора, чтобы получить выражение для химического потенциала реального раствора.
Для определения стандартного химического
потенциала µ0неидеальных
растворов важное значение приобретает
выбор стандартного состояния. Обычно
принимают стандартное состояние при
определенныхPиT=const, и когдаа=1 иN=1.
Тогда
![]() – для растворителя.
– для растворителя.
За стандартное состояние растворенного
вещества принимают такое, при котором
его активность равна концентрации, т.е.
![]() .
.
Тогда
![]() .
.
Это уравнение фиксирует тот факт, что раствор ведет себя как идеальный:
![]()
Знак разности
![]() определяет
характер отклонений реального раствора
от идеального. При
определяет
характер отклонений реального раствора
от идеального. При![]()
![]() эти отклонения отрицательные: химический
потенциал идеального раствора превышает
химический потенциал реального
эти отклонения отрицательные: химический
потенциал идеального раствора превышает
химический потенциал реального![]() .
Если
.
Если![]() ,
а
,
а![]() ,
то эти отклонения положительные
,
то эти отклонения положительные![]() ;
они наблюдаются чаще.
;
они наблюдаются чаще.
Понятия об активности и о коэффициенте активности являются одними из фундаментальных и основных в физической химии. Активность выражает все термодинамические свойства растворов: для идеальных растворов она совпадает с концентрацией, а для реальных растворов показывает степень их отклонения от идеальных. Коэффициент активности устанавливает непосредственную связь активности с концентрацией. Коэффициент активности может быть больше и меньше единицы, а следовательно, активность может быть больше или меньше концентрации.
Рассмотрим 2 метода определения активности и коэф-та активности.
