
- •Стандартные электродные потенциалы
- •Электродный процесс
- •Электродные измерение электродных потенциалов
- •Классификация электродов
- •Электроды I рода
- •Электроды II рода
- •Окислительно—восстановительные электроды (редокс—электроды)
- •Типы гальванических элементов
- •Химические элементы
- •Концентрационные элементы
- •Химические источники тока
- •Гальванические первичные элементы
- •Аккумуляторы
- •Топливные элементы
- •Применение потенциометрических методов
- •Определение рН растворов
- •Ионное произведение воды
- •Определения рН растворов водородным электродом
- •Определение рН растворов стеклянным электродом
- •Определение направление овр
- •Определение термодинамических характеристик химических реакций
Типы гальванических элементов
Гальванические элементы, непосредственно преобразующие энергию химического процесса в электрическую, называется химическими. Она состоит из неодинаковых электродов и, следовательно, для них характерна различная химическая природа электродных реакций. Элементы, состоящие из одинаковых электродов, называются концентрационными. В этих элементах в электрическую энергию превращается работа процесса выравнивания активностей окисленной и восстановленной форм реагирующего вещества в обоих электродах. Элементы, в которых один и тот же раствор электролита является общим для обоих электродов, называют элементами без переноса. У них отсутствует диффузионный скачок потенциала. В противном случае говорят од элементах с переносом, имея в виду перенос ионов на границе контакта двух различных растворов.
Химические элементы
К химическим элементам с переносом относятся элемент Даниэля—Якоби:
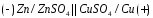

Если устранить диффузионный потенциал, то ЭДС этого элемента равна:

Примером химического элемента без переноса может служить элемент Вестона

состоящий из электрода I рода — 12,5%-ая амальгама кадмия (раствор кадмия в ртути) и электрода II рода — ртутно-сульфатного. ЭДС этого элемента незначительно зависит от температуры и устойчива во времени, поэтому элемент Вестона широко используется в электрохимической практике как источник стандартной ЭДС.

ЭДС выражается уравнением:

Концентрационные элементы
Концентрационные
элементы может работать как источник
ЭДС до тех пор, пока активности окисленной
(или восстановленной) форм реагирующего
вещества в обоих электродах не
выравнивается. Для этих элементов
 ,
так как стандартные потенциалы электродов
равны между собой. Примером элементас
переносом ионов являются
элемент
,
так как стандартные потенциалы электродов
равны между собой. Примером элементас
переносом ионов являются
элемент

 <
<
Серебряный
электрод, погруженный в разбавленный
раствор с активностью ионов серебра
а1,
растворяется и приобретает при этом
отрицательный заряд. В более
концентрированном растворе с активность
ионов серебра а2,
наоборот, на электроде выделяется
 ,
сообщая ему положительный заряд.
,
сообщая ему положительный заряд.

ЭДС этого элемента, без учета диффузионного потенциала,

Также элементы нашли применение при решении ряда теоретических и практических задач: при определении произведений растворимости, констант реакций комплексообразования и др.
К концентрационным элементам без переноса относятся , например, элементы из двух хлорных электродов с различным давлениями газа в электродах и общим раствором электролита (НСl).

 <
<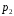
Как обычно, на отрицательном электроде будет протекать реакция окисления:
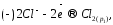
на положительном — реакция восстановления:
 .
.
Суммарный процесс — выравнивание давлений газа в электродах, приводящее к возникновению ЭДС, величина которой равна:

Химические источники тока
К достоинствам химических источников тока относятся высокий КПД, бесшумность, безвредность, возможность использования в космосе и под водой, в переносных устройствах, на транспорте и т.д.
К химическим источникам тока относятся гальванические элементы, аккумуляторы и топливные элементы.
