
Лекции по ФХ 2 семестр / Лекция 3
.docКИНЕТИКА ПОСЛЕДОВАТЕЛЬНЫХ РЕАКЦИЙ.
Последовательными называются реакции, состоящие из нескольких стадий, следующих друг за другом, например, гидролиз трисахаридов в кислой среде:
![]()
Рассмотрим реакцию, состоящую из двух мономолекулярных стадий:
![]()
Вещество В в данной реакции является промежуточным веществом.
Обозначим через а – начальную
концентрацию вещества А (![]() =
а). Тогда концентрация реагента А в
момент времени
=
а). Тогда концентрация реагента А в
момент времени
![]() равна
равна
![]() ,
реагента В в момент времени
,
реагента В в момент времени
![]()
![]() ,
реагента С в момент времени
,
реагента С в момент времени
![]()
![]() .
Т. е. в начале реакции идет образование
вещества В, пока концентрация реагента
А достаточна велика. Одновременно
реагент В расходуется на образование
вещества С.
.
Т. е. в начале реакции идет образование
вещества В, пока концентрация реагента
А достаточна велика. Одновременно
реагент В расходуется на образование
вещества С.
Напишем кинетические уравнения последовательной реакции.
Скорость реакции по изменению концентрации реагента А запишется (I ступень):
![]()
Скорость реакции по изменению концентрации реагента В (II ступень) запишется:
![]()
Скорость реакции по приросту концентрации реагента С (III ступень) запишется:
![]()
Кинетические кривые для последовательных реакций.
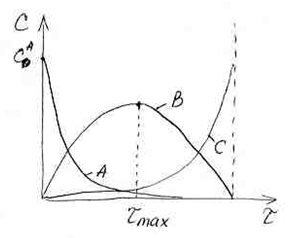
Концентрация вещества А с течением времени плавно уменьшается до нуля, что отображает кинетическая кривая для реагента А.
Концентрация реагента С в ходе реакции плавно возрастает, пока не достигнет своего максимального значения, что также отображается ходом кинетической кривой для данного реагента.
Кинетическая кривая для реагента В имеет максимум. Он обусловлен тем, что в начале процесса, пока концентрация вещества А достаточна большая, расходование вещества В компенсируется расходованием вещества А. На кинетической кривой – рост. Когда вещества А становится очень мало, то оно уже не может компенсировать расход вещества В на II ступени, поэтому на кинетической кривой наблюдается спад.
Время, за которое достигается максимальное
значение концентрации вещества В,
называют
![]() ,
оно зависит от соотношения констант
скоростей стадий
,
оно зависит от соотношения констант
скоростей стадий
![]() и
и
![]() .
.
![]()
Рассмотрим два случая относительно
разности значений констант скоростей
![]() и
и
![]() .
.
1. Когда скорость первой стадии
намного больше скорости второй стадии:
![]() >
>
![]() .
.
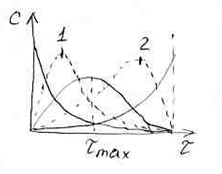
В этом случае достижение максимальной
концентрации промежуточного вещества
В происходит быстро. Максимум,
соответствующий
![]() ,
смещается к началу координат.
,
смещается к началу координат.
2. Когда скорость первой стадии
намного меньше скорости второй стадии:
![]() <
<
![]() .
.
В этом случае накопление промежуточного
вещества В идет медленно,
![]() смещается дальше от начала координат.
После достижения максимального времени
идет быстрый расход компонента В.
смещается дальше от начала координат.
После достижения максимального времени
идет быстрый расход компонента В.
ВЫВОД КИНЕТИЧЕСКОГО УРАВНЕНИЯ ПОСЛЕДОВАТЕЛЬНЫХ РЕАКЦИЙ. МЕТОД СТАЦИОНАРНЫХ КОНЦЕНТРАЦИЙ БОДЕНШТЕЙНА.
Этот метод основан на том, что концентрации промежуточных веществ в какой-то момент времени постоянны, т. е. скорость, рассчитываемая по этому веществу, приравнивается нулю. Таким образом, мы переводим дифференциальное уравнение в алгебраическое.
Существует алгоритм составления кинетического уравнения.
1. Расписываем механизм данной реакции по стадиям.
2. Выбираем промежуточное соединение (как правило, самое неустойчивое).
3. Записываем скорость по данному веществу, используя следующий прием: на стадиях, где это вещество образуется, кинетическое уравнение записываем со знаком «+», а там, где оно расходуется – со знаком «–».
4. Суммарную скорость приравниваем к нулю.
5. Составляем выражение для концентрации промежуточного вещества.
6. Это выражение подставляем в кинетическое уравнение скорость определяющей (лимитирующей) стадии.
Например:
![]()
![]() экспериментально было получено, что
реакция первого порядка
экспериментально было получено, что
реакция первого порядка
Предположим, что данная реакция протекает через следующие стадии, т. е. расписываем механизм:
1.
![]() (
(![]() – это обозначение неустойчивого
вещества)
– это обозначение неустойчивого
вещества)
2.
![]()
3.
![]()
Выразим скорость реакции по веществу
![]() :
:
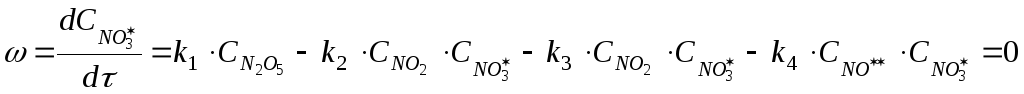
Из этого выражения найдем концентрацию
![]() :
:

Теперь выразим концентрацию неустойчивого
вещества
![]() :
:
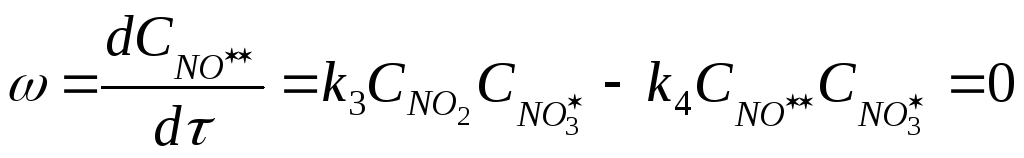

Подставим полученное выражение
концентрации
![]() в выражение концентрации
в выражение концентрации
![]() :
:
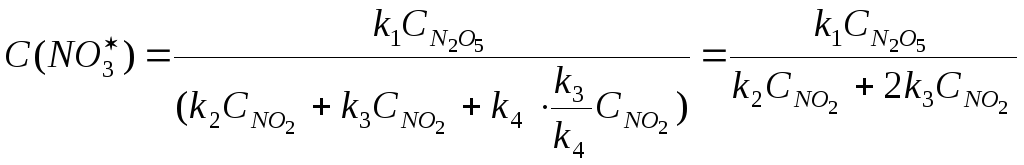
Подставляем полученное значение в кинетическое уравнение для последней лимитирующей стадии процесса:

Таким образом, константа скорости этой реакции является совокупностью констант скоростей трех стадий, которые экспериментально определить нельзя. Экспериментально мы определяем константу скорости k, называемую эффективной константой скорости.
Влияние промежуточных соединений на механизм (порядок) реакции.
Промежуточные соединения принимают участие в процессе, поэтому механизм реакции со временем меняется, а следовательно, меняется порядок реакции. Для изучения этого влияния определяют временной порядок реакции.
Определить зависимость порядка реакции от времени можно следующим образом:
![]() ,
логарифмируем это выражение и получаем
,
логарифмируем это выражение и получаем
![]() .
.
1) Если порядок реакции не зависит от
времени (![]() ),
то в координатах “
),
то в координатах “![]() ”
мы получаем прямую линию, наклон которой
неизменен по времени протекания реакции.
”
мы получаем прямую линию, наклон которой
неизменен по времени протекания реакции.

2) Если порядок реакции зависит от времени
(![]() ),
то получаем веер прямых с различными
углами наклона.
),
то получаем веер прямых с различными
углами наклона.

ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ.
ПРАВИЛО ВАНТ-ГОФФА. УРАВНЕНИЕ АРРЕНИУСА.
Температурная зависимость для простых реакций выражается правилом Вант-Гоффа.
Правило Вант-Гоффа: для простых
гомогенных реакций при увеличении
температуры на 100С скорость
химической реакции возрастает в 2![]() 4
раза.
4
раза.
Выражается это следующей формулой:
![]()
![]() –
температурный коэффициент Вант-Гоффа.
–
температурный коэффициент Вант-Гоффа.
Правило Вант-Гоффа в случае изменения температуры более чем на 100С выражается формулой:
![]() ,
,
где М – коэффициент, кратный 10.
Более того зависимость скорости реакции от температуры определяется уравнением Аррениуса:
![]()
![]() –
предэкспоненциальный множитель.
–
предэкспоненциальный множитель.
![]() ,
где R – универсальная
газовая постоянная, Е – энергия активации.
,
где R – универсальная
газовая постоянная, Е – энергия активации.
Тогда получим следующее выражение:
![]() уравнение Аррениуса
уравнение Аррениуса
Энергия активации – это минимальная энергия, которой должны обладать молекулы для взаимодействия.
Для реакции АВ+С → АС+В изменение энергии вдоль пути реакции можно представить следующим образом:
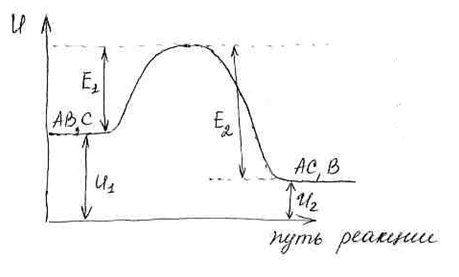
![]() –
внутренняя энергия исходных веществ;
–
внутренняя энергия исходных веществ;
![]() –
внутренняя энергия продуктов реакции;
–
внутренняя энергия продуктов реакции;
![]() –
энергия активации прямой реакции;
–
энергия активации прямой реакции;
![]() –
энергия активации обратной реакции.
–
энергия активации обратной реакции.
С увеличением температуры изменяется не энергия активации процесса, а увеличивается потенциальная энергия самих молекул.
![]() тепловой эффект процесса.
тепловой эффект процесса.
![]()
ТЕРМОДИНАМИЧЕСКИЙ ВЫВОД УРАВНЕНИЯ АРРЕНИУСА.
![]() – уравнение изохоры Вант-Гоффа.
– уравнение изохоры Вант-Гоффа.
![]() –
константа равновесия химической реакции,
есть отношение констант скоростей
прямой и обратной реакций.
–
константа равновесия химической реакции,
есть отношение констант скоростей
прямой и обратной реакций.
![]() ;
;
![]() ,
,
тогда
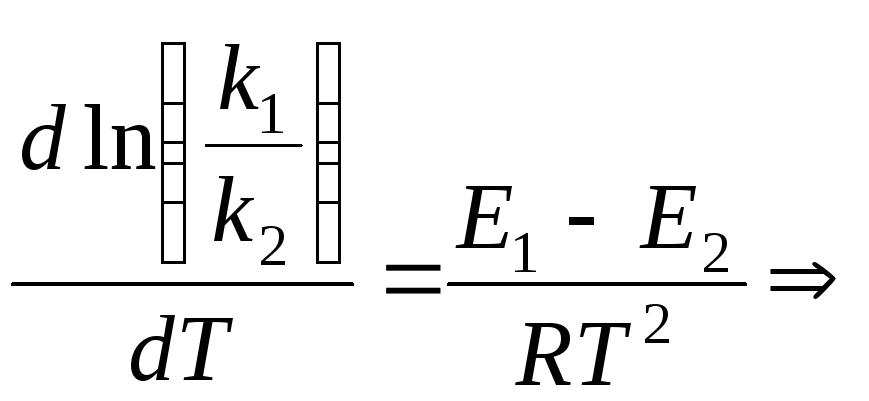
![]() ;
;
![]() .
.
В общем случае получим уравнение
Аррениуса в дифференциальной форме:
![]()
Проинтегрируем по температуре:
![]()
Если энергия активации не зависит от
температуры (![]() ),
то получим:
),
то получим:
![]()
Обозначим
![]() ,
получим уравнение Аррениуса в
интегральной форме:
,
получим уравнение Аррениуса в
интегральной форме:
![]()
Преобразуем это уравнение и получим уравнение Аррениуса в экспоненциальной форме:
![]()
ОПРЕДЕЛЕНИЕ ЭНЕРГИИ АКТИВАЦИИ.
Так как в уравнение Аррениуса входят две неизвестные величины (k и E), для нахождения этих величин мы должны составить, как минимум, два уравнения, т. е. нам необходимо знать значения двух констант скоростей при двух температурах.
![]() (2
(2![]() при 2Т)!
при 2Т)!
Существует 2 способа определения энергии активации.
СПОСОБЫ ОПРЕДЕЛЕНИЯ
-
ГРАФИЧЕСКИЙ
АЛГЕБРАИЧЕСКИЙ

Если
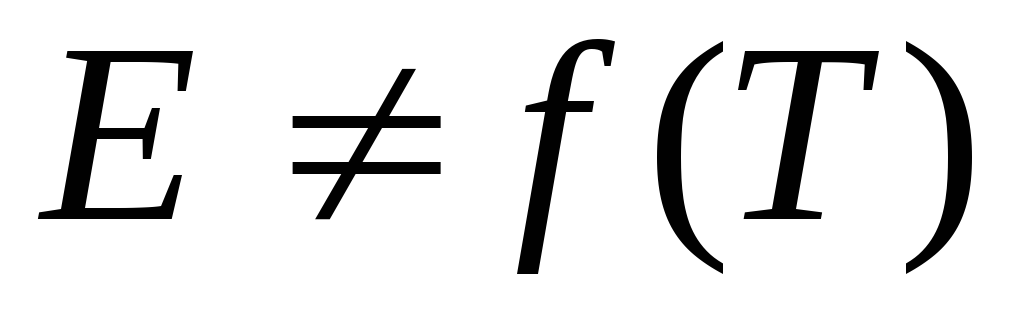 ,
то в координатах
,
то в координатах
 получаем линейную зависимость.
получаем линейную зависимость.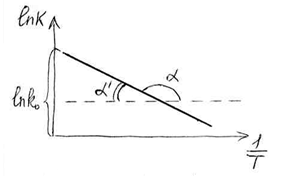
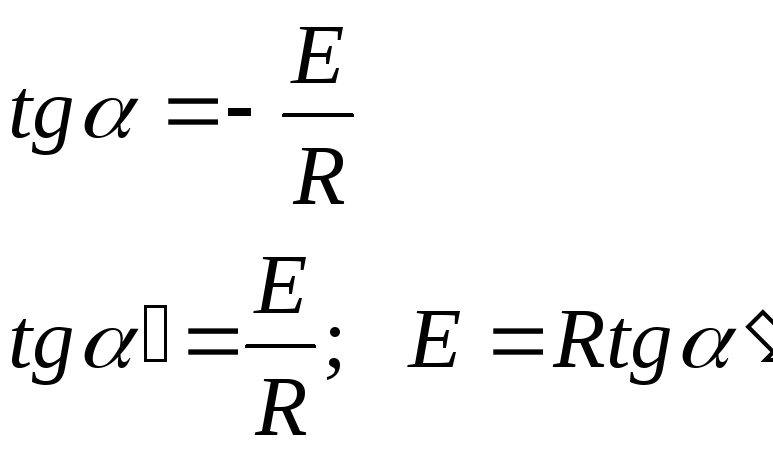

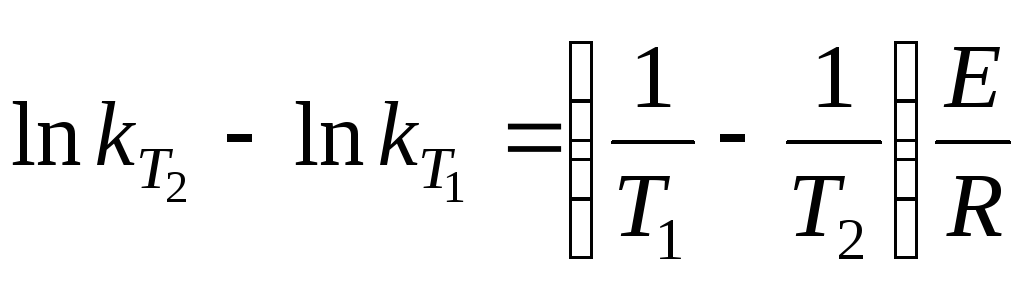


Энергия активации, рассчитанная из экспериментальных данных, называется экспериментальной, или эффективной энергией активации.
Минимальной энергией активации обладают реакции, протекающие по радикальному механизму.

Наличие свободных валентностей этих валентно-ненасыщенных частиц облегчает осуществление процесса. Взаимодействие валентнонасыщенных частиц обладает более высокой энергией активации, соизмеримой с энергией связи.
СВЯЗЬ УРАВНЕНИЯ АРРЕНИУСА С ПРАВИЛОМ ВАНТ-ГОФФА.
Правило Вант-Гоффа. Уравнение Аррениуса.

![]()
![]()
По правилу Вант-Гоффа
![]() .
Если
.
Если
![]() ,
то величиной ∆Т можно пренебречь
в знаменателе.
,
то величиной ∆Т можно пренебречь
в знаменателе.
Получим:
![]()
Если Е=50![]() 100
кДж, Т=300 К,
100
кДж, Т=300 К,
![]() =2
=2![]() 4.
4.
Правило Вант-Гоффа не соблюдается в следующих случаях:
1.
![]() (энергия активации равна нулю), при этом
(энергия активации равна нулю), при этом
![]() .
Данный случай характерен для радикальных
цепных реакций.
.
Данный случай характерен для радикальных
цепных реакций.
2.
![]()
3.
![]()
ПРИМЕНЕНИЕ УРАВНЕНИЯ АРРЕНИУСА ДЛЯ СЛОЖНЫХ РЕАКЦИЙ.
Так как уравнение Аррениуса имеет экспоненциальный вид, для сложных реакций такая же зависимость от температуры будет иметь место только в том случае, если константа скорости сложной реакции равна произведению констант составляющих её стадии или частному констант составляющих её стадии.
 уравнение Аррениуса неприменимо.
уравнение Аррениуса неприменимо.
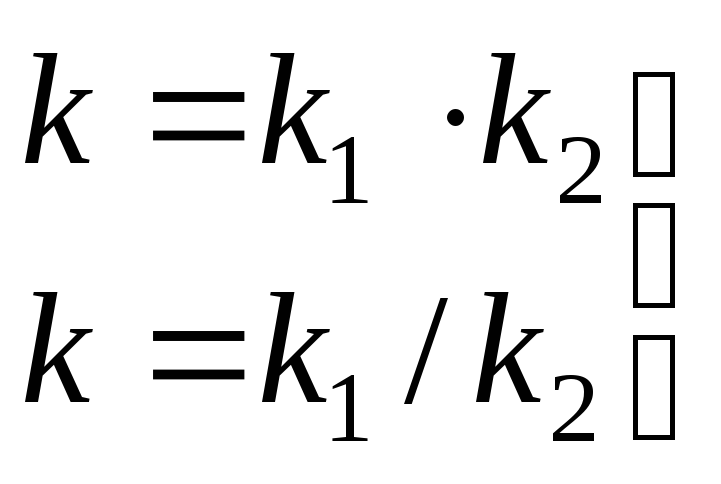 уравнение Аррениуса применимо.
уравнение Аррениуса применимо.
