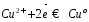- •Стандартные электродные потенциалы
- •Электродный процесс
- •Электродные измерение электродных потенциалов
- •Классификация электродов
- •Электроды I рода
- •Электроды II рода
- •Окислительно—восстановительные электроды (редокс—электроды)
- •Типы гальванических элементов
- •Химические элементы
- •Концентрационные элементы
- •Химические источники тока
- •Гальванические первичные элементы
- •Аккумуляторы
- •Топливные элементы
- •Применение потенциометрических методов
- •Определение рН растворов
- •Ионное произведение воды
- •Определения рН растворов водородным электродом
- •Определение рН растворов стеклянным электродом
- •Определение направление овр
- •Определение термодинамических характеристик химических реакций
Классификация электродов
Электроды в зависимости от устройства и типа электродной реакции делятся на электроды первого рода, второго рода и окислительно—восстановительные, или редокс—электроды.
Электроды I рода — это электроды, потенциал которых зависит от активности (концентрации) или катиона, или аниона.
Электроды II рода — это электроды, потенциал которых зависит как от активности катиона, так и от активности аниона.
Окислительно—восстановительные электроды — это электроды, у которых в растворе находятся окисленная и восстановленная форма, а металл лишь посредничает в передаче электронов от окислителя и восстановителю и не принимает участия в электродной реакции.
Рассмотрим все электроды.
Электроды I рода
Для электродов первого рода электродное равновесие можно рассматривать как обмен или катионом, или анионом между металлом и раствором электролита.
Примерами электродов I рода могут служить следующие электроды:
|
Электрод |
Устройство (схематич. запись) |
Электродная реакция |
Выражение для потенциала электрода |
|
Медный |
|
|
|
|
Водородный |
|
|
|
|
Хлорный |
|
|
|
Электроды II рода
Эти электроды представляют собой металлы, покрытые слоем малорастворимой соли металла и опущенные в раствор хорошо растворимой соли, имеющий общий анион с малорастворимой солью. Эти электроды можно рассматривать обратимыми как по отношению к катиону, так и к аниону, т.е. электродное равновесие представляет собой обмен катионом между металлом и труднорастворимой солью и обмен анионом между раствором и этой солью. Поэтому их потенциал можно выразить через активности катиона или аниона. Примерами электродов второго рода являются каломельный и хлорсеребряный электроды.
|
Электрод |
Устройство электрода (схематич. запись) |
Электродная реакция |
|
Каломельный |
|
|
|
Хлорсеребряный |
|
|
Если рассматривать эти электроды как обратимые по отношению к катиону, то их потенциалы можно вычислить по уравнению:
 ;
;
 .
.
Активность
ионов серебра или ртути определяется
произведением активности их солей постоянной при данной температуре.
Поэтому
постоянной при данной температуре.
Поэтому и
и
 ;
;
где

Описанные электроды второго рода отличаются постоянством потенциала и поэтому употребляются в качестве электродами они составляют гальванические элементы, в которых потенциал электрода сравнения известен. Измерив ЭДС составленного таким образом элемента, можно определить потенциал интересующего нас электрода.
Окислительно—восстановительные электроды (редокс—электроды)
Простым
примером редокс—электрода может служить
платина, опущенная в раствор, содержащий
FeCl2
и FeCl3.
При сочетании такого электрода с другими
происходит окисления ионов Fe2+
в Fe3+
или восстановление Fe3+
в
Fe2+:

В сущности, отличие такого электрода от рассмотренных заключается в том, что здесь продукты окисления и восстановления остаются в растворе, а металл облинивается с компонентами раствора электролита.
Электродный потенциал Fe3+ /Fe2+ электрода равен:

Среди редокс — электродов широкое применение получил хингидронный электрод, использующийся для определения концентрации водородных ионов в растворе. Хингидронный электрод представляет собой платиновую пластинку, опущенную в раствор, насыщенный хингидроном. Хингидрон—эквимолекулярная смесь хинона С6Н4О2 и гидрохинона С6Н4(ОН)2. Гидрохинон — слабая кислота, в незначительной степени диссоциирует на ионы:

В свою очередь, ион гидрохинона может окисляться в хинон:
 ,
если образующиеся при реакции электроны
будут отводиться. В частности, этот
процесс может быть осуществлен в
гальваническом элементе. Суммарная
реакция, протекающая на электроде,
выражается уравнением:
,
если образующиеся при реакции электроны
будут отводиться. В частности, этот
процесс может быть осуществлен в
гальваническом элементе. Суммарная
реакция, протекающая на электроде,
выражается уравнением:
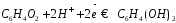 .
.
Потенциал хингидронного электрода
 .
.
В
кислых растворах степень диссоциации
гидрохинона ничтожно мала и поэтому
активностям хинона и гидрохинона можно
считать равными ( ).Тогда
выражение для электродного потенциала
принимает вид:
).Тогда
выражение для электродного потенциала
принимает вид:

Хингидронный электрод может быть использован как измеритель рН растворов, до рН=8 и меньше.