
Лекции по ФХ 2 семестр / Лекция 5
.docКИНЕТИКА РЕАКЦИЙ В РАСТВОРАХ.
Существует три типа реакций в растворах:
1. Скорость реакции не меняется в зависимости от среды.
2. Скорость реакции зависит от среды
(например,
![]() ).
).
3. Реакции в растворах сильных
электролитов (![]() (заряд
ионов, ионная сила)).
(заряд
ионов, ионная сила)).
I. ПРОТЕКАНИЕ РЕАКЦИИ С ТОЧКИ ЗРЕНИЯ ТАС.
![]()

1) Предположим, что:
![]() ,
тогда
,
тогда
![]()
В этом случае скорость определяющей является вторая стадия, и растворитель не оказывает существенного влияния на скорость процесса.
2)
![]() ,
тогда
,
тогда
![]()
В этом случае скорость определяющей является стадия подвода вещества А к веществу В, которая определяется физическими свойствами среды.
скорость
![]()
/ \
диффузия вязкость
![]()
![]()
r – расстояние между
центрами
![]() – вязкость среды
– вязкость среды
молекул Аи В
D – коэффициент диффузии
Na – число Авогадро
Таким образом, по ТАС скорость реакции зависит от свойств растворителя в том случае, если скорость определяющей является 1 стадия, т. е. стадия подвода молекул друг к другу.
ПРОТЕКАНИЕ РЕАКЦИИ С ТОЧКИ ЗРЕНИЯ ТЕОРИИ АКТИВИРОВАННОГО КОМПЛЕКСА (ТАК).
В основе этой теории лежит уравнение Эйринга:
![]()
![]() ,
где
,
где
![]()
Для реакций в растворе, учитывая взаимодействие молекул с растворителем, мы должны вместо величины концентрации подставить величину активности.
![]() ;
;
![]()
![]()
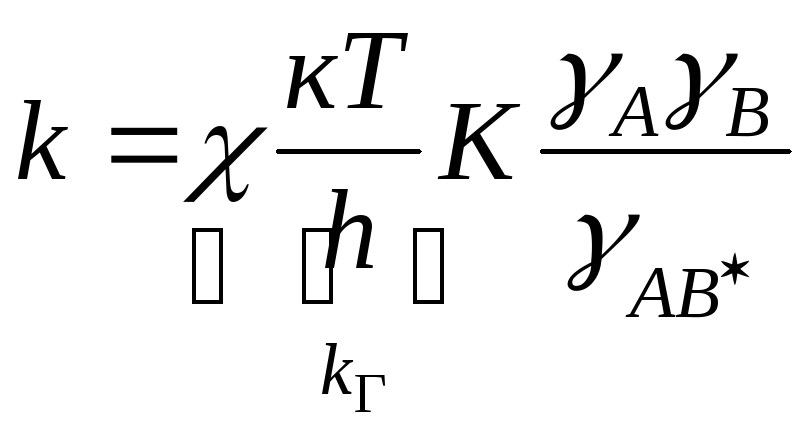 ;
;
![]()
![]() константа
скорости в газовой фазе.
константа
скорости в газовой фазе.
![]() уравнение Бренстеда-Бьеррума
уравнение Бренстеда-Бьеррума
1. Мономолекулярные реакции.
![]()
Предполагаем, что
![]() ,
тогда
,
тогда
![]()
![]()
Скорость мономолекулярной реакции не зависит от характера среды.
ПРИМЕР.
Реакция Среда k∙105
Разложение Газовая фаза 3,4
![]() Хлороформ 3,7
Хлороформ 3,7
Дихлорэтан 4,2
Нитроэтан 3,4
![]() 4,1
4,1
2. Бимолекулярные реакции.
![]()
![]() ;
;
![]()
тогда вышеприведенное уравнение будет иметь вид:
![]()
Для медленной реакции Меншуткина
![]()
в гексане –
![]()
в ацетоне – 100
![]()
в нитробензоле – 1380![]()
По ТАК важным фактором влияния растворителя на скорость реакции является значение коэффициента активности данного вещества в данной реакции.
РЕАКЦИИ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ.
В разбавленных растворах зависимость коэффициента активности иона от ионной силы раствора описывается уравнением Дебая-Хюккеля:
![]() ,
,
где
![]() – коэффициент активности;
– коэффициент активности;
А – const, зависящая от растворителя;
z – заряд иона;
J – ионная сила раствора.
Заряд активированного комплекса в этом случае будет равен:
![]()
Прологарифмируем уравнение Бренстеда-Бьеррума:
![]()
![]() уравнение реакции в растворах
электролитов
уравнение реакции в растворах
электролитов
Для реакций в растворе электролитов
характерно три вида соотношений
![]() .
Рассмотрим все 3 вида. В координатах
.
Рассмотрим все 3 вида. В координатах
![]() при достаточно малых значениях
при достаточно малых значениях
![]() хорошо выполняется линейная зависимость.
хорошо выполняется линейная зависимость.
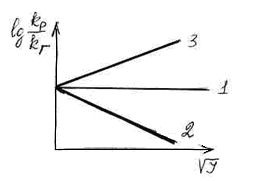
1. Случай 1 наблюдается, если
![]() или
или
![]() =
0 (т. е. имеются незаряженные частицы
одного из веществ). Тогда
=
0 (т. е. имеются незаряженные частицы
одного из веществ). Тогда
![]() .
.
2. Если заряды разноименные, то при
![]() ↑
↑
![]() ↓
(при увеличении ионной силы значение
↓
(при увеличении ионной силы значение
![]() падает).
падает).
3. Если ионы
![]() и
и
![]() одноименные, то при увеличении ионной
силы увеличивается логарифмическое
соотношение констант скоростей в газовой
фазе и в растворе (
одноименные, то при увеличении ионной
силы увеличивается логарифмическое
соотношение констант скоростей в газовой
фазе и в растворе (![]() ↑
и
↑
и
![]() ↑).
↑).
Следует заметить, что данные закономерности соблюдаются лишь в случае сильно разбавленных растворов.
Более сложная зависимость дается уравнением Гаммета.
ЦЕПНЫЕ РЕАКЦИИ.
Цепными называются реакции, при которых одна активная нестабильная частица взаимодействует с веществом с образованием одной или нескольких активных частиц.
Цепные реакции состоят из большого числа повторяющихся стадий:
I. Зарождение цепи.
II. Рост цепи.
III. Обрыв цепи.
По цепному механизму протекают процессы горения, многие фотохимические реакции, некоторые реакции полимеризации и поликонденсации при получении полимеров. По цепному механизму происходит распад ядер урана и плутония в атомных реакторах.
Цепные реакции делят на неразветвленные и разветвленные.
Неразветвленными называют цепные реакции, когда в процессе развития цепи число свободных валентностей в звене цепи остается постоянным.
![]()
(Боденштейн, 1918 г.)
Разветвленными называют цепные реакции, когда развитие цепи идет с увеличением свободных валентностей в звене цепи.
(Семенов Н. Н., 1926 г. Нобелевская премия)
Рассмотрим более подробно все три стадии цепной реакции.
I. Зарождение цепи.
Зарождение цепи начинается с элементарного химического акта, в результате которого в системе появляются частицы со «свободными валентностями» – атомы двухатомной молекулы или радикалы.
Радикальные частицы имеют по одному электрону на ВЗМО и отличаются высокой реакционной способностью.
1. Активные атомы. Например, в смеси
![]() и
и
![]() в газообразном состоянии молекулы
в газообразном состоянии молекулы
![]() могут частично диссоциировать на атомы.
могут частично диссоциировать на атомы.
![]()
Атомарный бром может быть инициатором цепной реакции.
2. Активные радикалы. Например, при получении полимерных материалов в качестве инициаторов цепной реакции используют перекисные соединения. Пероксид бензоила распадается на радикалы:

Эти радикалы, присоединяясь по двойной связи к мономеру, образуют новую частицу со свободной валентностью.
II. Рост цепи.

Совокупность последовательных реакций продолжения цепи, из многократного повторения которой складывается цепной процесс, называется звеном цепи.
Длина цепи – число звеньев на стадии продолжения цепи.
III. Обрыв цепи.
1) Обрыв цепи может происходить за счет столкновения радикальных частиц со стенками сосуда
![]()
адс – адсорбированный.
2) Дезактивация может произойти за счет тройных соударений с молекулами примесей или инертных газов.
![]()
Двойные столкновения к дезактивации не приводят.
![]()
КИНЕТИКА ЦЕПНЫХ РЕАКЦИЙ.
1) Неразветвленные реакции.
![]()
Распишем эту реакцию по стадиям:
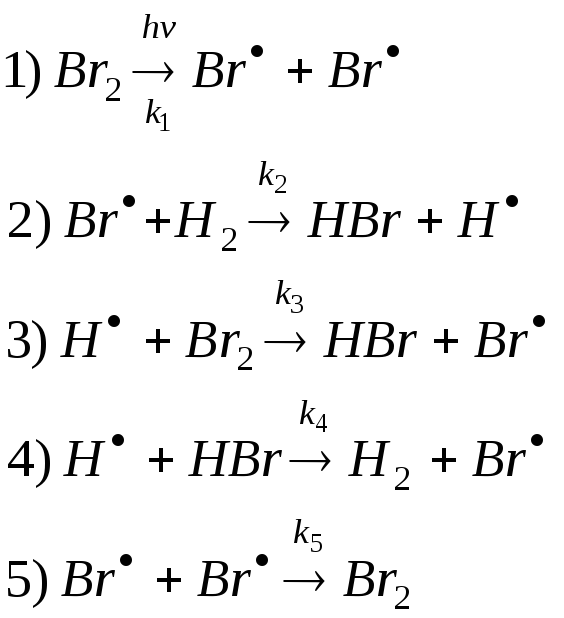
Выведем кинетическое уравнение, используя
метод стационарных концентраций
относительно промежуточных продуктов
– атомов
![]() и
и
![]() .
.
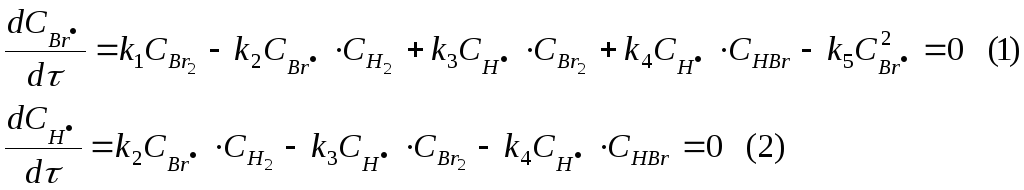
Складываем эти две скорости и получаем:
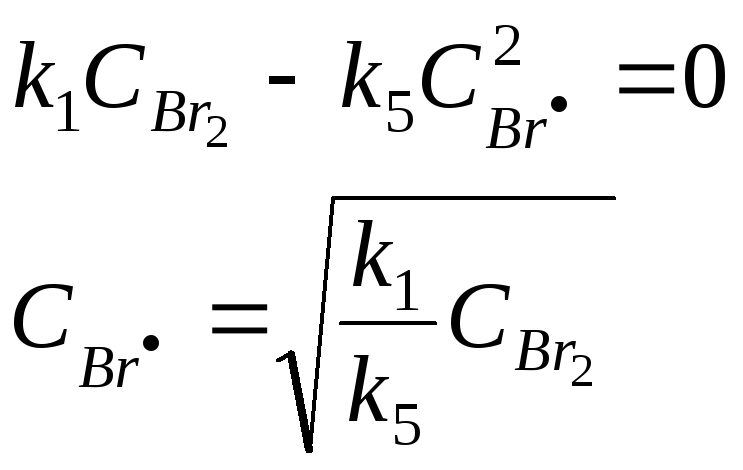
Из второго уравнения выразим концентрацию радикальных частиц водорода:
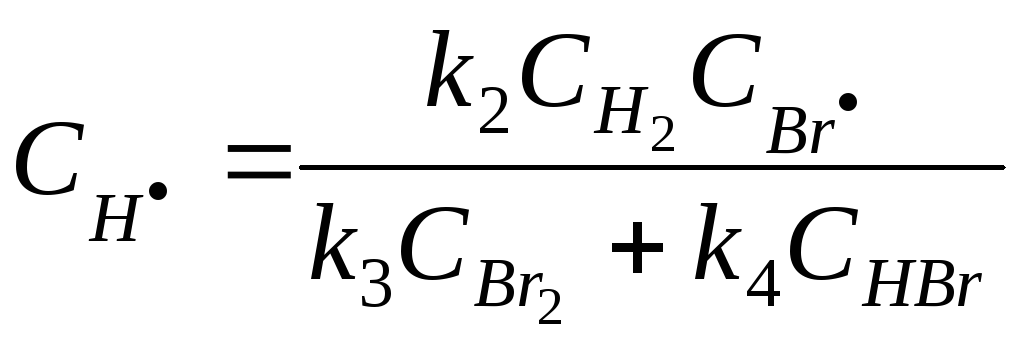
Составим уравнение скорости суммарной реакции:
![]()
и подставим в него значения концентраций атомов водорода и брома:
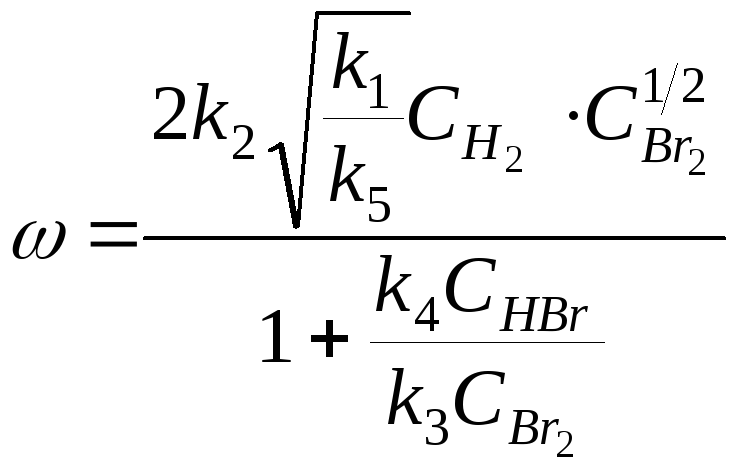
2) Разветвленные реакции.
Реакция синтеза бромистого водорода – пример простой цепи. В этом случае количество первоначально возникших частиц не изменяется. Примером разветвленных реакций является реакция горения водорода:
![]()
Эту реакцию можно разбить на стадии:
![]() зарождение цепи
зарождение цепи
![]() разветвление цепи
разветвление цепи
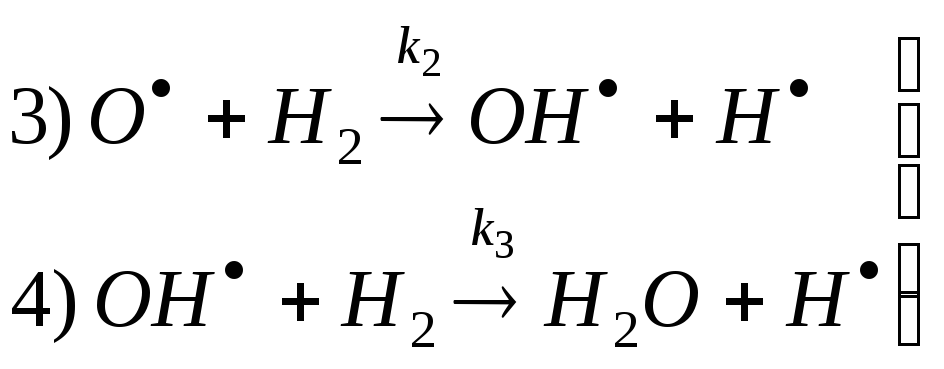 продолжение цепи
продолжение цепи
![]() обрыв цепей на стенке
обрыв цепей на стенке
![]() обрыв цепей в объеме
обрыв цепей в объеме
Образование свободного
радикала
![]() при тройном соударении рассматривается
как реакция обрыва цепи, так как этот
свободный радикал малоактивен и при не
очень больших давлениях не может
продолжать цепь.
при тройном соударении рассматривается
как реакция обрыва цепи, так как этот
свободный радикал малоактивен и при не
очень больших давлениях не может
продолжать цепь.
Обозначим:
![]() число
активных частиц, появившихся в результате
акта зарождения цепи.
число
активных частиц, появившихся в результате
акта зарождения цепи.
![]() количество
всех активных частиц.
количество
всех активных частиц.
![]() ;
;
![]() и
и
![]()
![]()
Система дифференциальных уравнений для концентраций свободных радикалов запишется в виде:
![]()

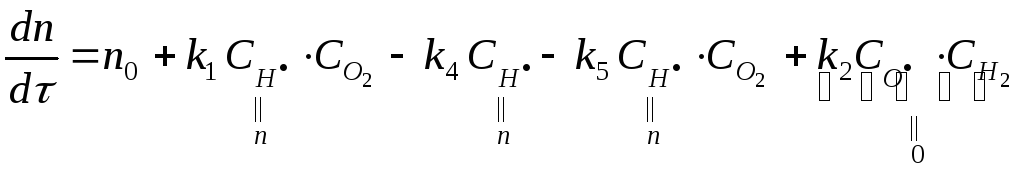
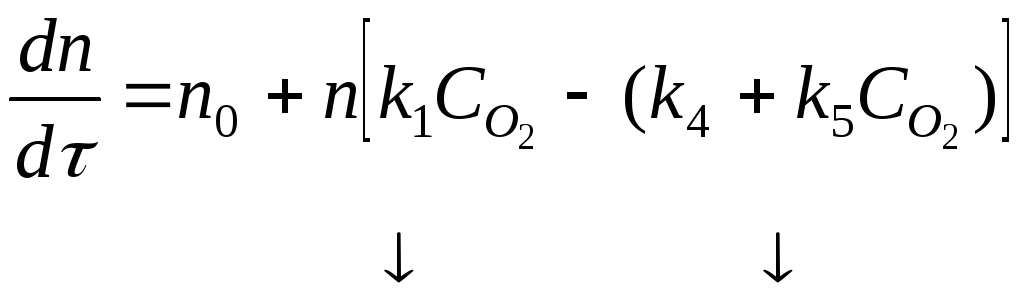
f – фактор g – фактор
разветвления цепи обрыва цепи
![]()
модельное уравнение Семенова
![]() фактор
автоускорения.
фактор
автоускорения.
АНАЛИЗ УРАВНЕНИЯ СЕМЕНОВА.
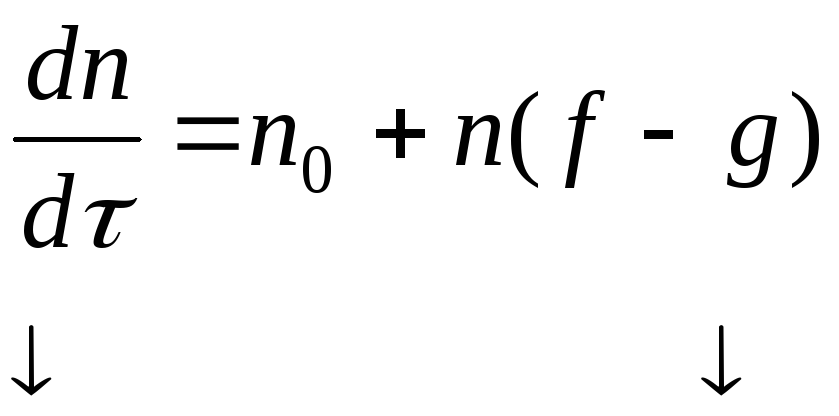
неразветвленный разветвленный
![]()
Для стационарных процессов по теории
Боденштейна
![]() .
.
![]() ,
,
![]() ,
,
![]()
![]()
Рассмотрим разветвленные процессы:
![]() ,
,
![]() ,
,
![]()
![]()
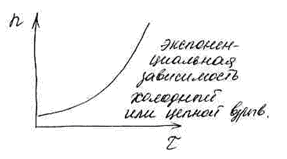
В этом случае имеет место прогрессивное нарастание концентрации радикалов, а следовательно, и скорости цепной реакции. В определенный момент времени скорость становится такой большой, что приводит к цепной воспламеняемости или взрыву.
Пределы взрываемости цепной реакции:
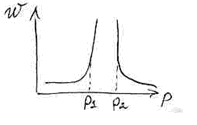
![]() нижний
предел взрываемости. Он зависит от
формы и материала сосуда.
нижний
предел взрываемости. Он зависит от
формы и материала сосуда.
![]() верхний
предел взрываемости. Зависит от
состава и количества примесей, от природы
веществ, в незначительной степени от
температуры.
верхний
предел взрываемости. Зависит от
состава и количества примесей, от природы
веществ, в незначительной степени от
температуры.
Ниже нижнего предела взрываемости обрыв цепи происходит за счет соударения о стенки сосуда.
Выше верхнего предела взрываемости обрыв цепи происходит за счет тройных соударений.
ОСОБЕННОСТИ ЦЕПНЫХ РЕАКЦИЙ.
1. Реальная скорость процесса намного больше теоретической.
2. На скорость процесса влияют форма и материал сосуда.
3. На скорость влияет наличие примесей в реакционной среде.
4. Цепные реакции имеют верхний и нижний предел взрываемости.
