
Лекция
.doc
1 Теоретические основы процесса дегидратации спиртов
2 Технологические основы процесса дегидратации спиртов
1.1 Химизм процесса
Процесс дегидратации спиртов сохранил значение лишь для получения изобутена. Он применяется для извлечения изобутена из С4 фракций газов крекинга и пиролиза, когда одна из стадий состоит в дегидратации трет-бутанола при катализе серной кислотой или сульфокатионитом.
В другом варианте дегидратация с получением стирола проводится с метилфенилкарбинолом, образовавшимся при гидропероксидном способе получения пропиленоксида:
![]()
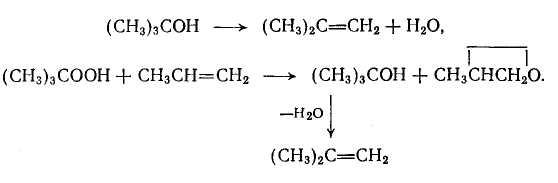
Внутримолекулярная дегидратация спиртов с образованием олефинов протекает согласно правилу Зайцева: водород предпочтительнее отщепляется от того из соседних атомов углерода, который беднее водородом.
![]()
![]()
1.2 Термодинамика и кинетика процесса
Рассмотрим равновесие основной реакции: дегидратации — гидратации:
RCHOH—СН3 ↔RCH=CH2 + H2O ∆Н°298 = 46 кДж/моль.
Внутримолекулярная дегидратация протекает с поглощением тепла, следовательно, ее равновесие смещается вправо при повыфшении температуры.
Как показывает стехиометрия реакций, на их равновесие можно влиять, изменяя давление. Внутримолекулярной дегидратации, идущей с увеличением числа молей веществ, способствует пониженное или обычное давление.
Рассмотрим теперь равновесие в системе межмолекулярная дегидратация спиртов — гидролиз простых эфиров:
![]()
![]()
показывающим, что равновесие смещается вправо при снижении температуры. Следовательно, при 200—400 °С внутри- и межмолекулярная дегидратация конкурируют друг с другом. Термодинамическим методом регулирования направления этих реакций является изменение давления: на образование простого эфира оно не влияет, но получению олефина его снижение благоприятствует
Константу скорости реакции дегидратации триметилкарбинола в изобутилена можно выразить как:
Кр =
![]() ,
,
где Рcm, РН2О ― парциальные давления образующегося триметилкарбинола; РТМК― парциальное давление подаваемого на дегидратацию триметилкарбинола.
Как показывает стехиометрия реакций, на их равновесие можно влиять, изменяя давление. Внутримолекулярной дегидратации, идущей с увеличением числа молей веществ. Лабораторными методами установлено оптимальное давление 0,05-1,5 МПа. Спирт более реакционноспособен , чем вода, поэтому не надо вести реакцию так, чтобы сохранять большой избыток воды по отношению к спирту.
Однако чрезмерное завышение температуры неизбежно приводит к увеличению побочных реакций и разрушению катализатора Дегидратация триметилкарбинола является эндотермическим процессом, следовательно, для заметного увеличения выхода целевого продукта требуется повышать температуру.. Поэтому наилучшие показатели процесса достигнуты при температуре 130 оС.
Дегидратация ТМК проводится под давлением 0,06 МПа и температуре 90 0С Стадии дегидратации:

Данный процесс является эндотермическим и требует затрат тепла 56,59 кДж/моль. То есть повышение температуры ведет к увеличению скорость реакции. На основе экспериментальных данных при изучении кинетики реакции разложения ТМК, установлено, что при увеличении температуры на 10 0С, скорость реакции возрастает в 2 раза. В тоже время из уравнения реакции видно, процесс дегидратации идет с увеличением объема, поэтому процесс должен протекать при пониженном давлении.
В отсутствии воды процесс дегидратации катализируется недиссоциированными группами SО3Н, связанными с носителем (сополимер стирола с дивинилбензолом). Коэффициент обмена составляет 0,2 сек-1. При добавлении воды группы SО3Н гидратируются и скорость реакции резко уменьшается (вплоть до концентрации Н2О 0,7 М). Затем скорость снова возрастает, достигая предела при концентрации воды 11 М. В этих условиях катализатором является гидратированный проток на носителе (более слабый катализатор, чем- SО3Н)
1.3 Катализаторы, механизм процесса
Для дегидратации используют фосфорную кислоту на носителе, оксид алюминия, серную кислоту, фосфаты (например, СаНРО4) и др.
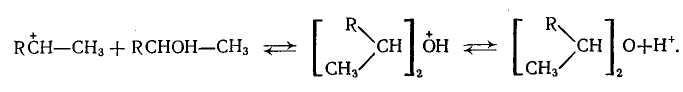
Карбониевые ионы могут образовываться также при протонировании атомов, содержащих неподеленные электронные пары; собственно карбониевый ион образуется в результате последующего отщепления этого атома:
![]()
Равновесие гидратации — дегидратации, как мы видели выше, мало зависит от строения олефина и спирта, поэтому ряд реакционной способности олефинов к гидратации должен соответствовать аналогичному ряду спиртов по их способности к дегидратации:
![]()
Наиболее эффективные катализаторы в процессе дегидратации ТМК - сульфированные ионообменные смолы. Самыми распространенными являются сульфокатиониты (СФК) со стирол-дивинилбензольной матрицей. Достаточно эффективны и применяются в промышленности формованные катализаторы такие как КУ‑2 ФПП. КУ‑2 ФПП выпускаются в форме цилиндров и колец размерами 5‑20 мм и обладают одновременно свойствами катализатора и массообменной насадки.
Основные трудности, возникающие при использовании СФК в промышленности для получения МТБЭ, связаны с большим гидродинамическим сопротивлением слоя. Кроме того, недостатком существующих СФК является относительно невысокая термостабильность (ФПП – формованные полипропиленом).
Для обеспечения высокой производительности катализатора, с одной стороны, и высокой степени превращения исходных реагентов в состоянии близком к равновесному, с другой, необходимо разработать и строго поддерживать температурный режим работы реактора.
1.4 Побочные реакции
При межмолекулярной дегидратации карбокатион не отщепляет протон, а взаимодействует с другой молекулой спирта
Для дегидратации спиртов установлена схема превращений, по которой эфир способен к разложению на олефин и спирт:
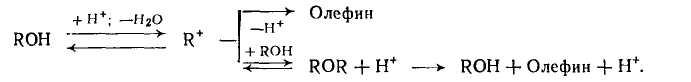
Внутримолекулярная дегидратация имеет более высокую энергию активации по сравнению с образованием простого эфира. По этой причине, а также из рассмотрения приведенной выше схемы следует, что дегидратацию с образованием ненасыщенной связи надо осуществлять при повышенной температуре и низком парциальном давлении или концентрации спирта. Дегидратацию с образованием простого эфира проводят при более низкой температуре, более высоких концентрации и парциальном давлении спирта (например, под некоторым давлением) и при неполной конверсии спирта в реакторе.
В результате рассматриваемых реакций нередко образуется еще один побочный продукт — альдегид или кетон, получающийся за счет дегидрирования спирта: СН3СН2ОН→СН3СНО.
Протонные кислоты не катализируют эту реакцию, но она становится возможной при использовании некоторых носителей или оксидных катализаторов. Из последних наиболее селективны к дегидратации (по сравнению с дегидрированием) ThO2 и А12О3, в то время как многие оксиды обладают смешанным, а другие — преимущественно дегидрирующим действием.
2 Технологические основы процесса дегидратации спиртов
Процесс производства изобутилена из триметилкарбинола состоит из: реакции в дегидрататоре, отмывке от остатков ТМК, очистки от тяжелых углеводородов и азеотропной осушке, также имеется узел по выделению вторбутанола.
Дегидратация триметилкарбинола, протекает в реакторе, состоящем из трех частей: ректификационной, реакционной и шлема. Процесс дегидратации с получением газообразного изобутилена и воды идет при температуре 130 0С, давлении 0,36 МПа на катализаторе Леватит К2620, расположенном в реакционной части реактора. В нижней -ректификационной части происходит полное исчерпание вторбутанола от газов триметилкарбинола. Реакция дегидратации вторбутанола дает цис- и транс- бутилены, которые тяжело отделить от изобутилена в дальнейшей очистке.
Температура верха, является температурой активации катализатора. В кубе же поддерживается температура 135-1400С, для разделения смеси ТМК с фузельной водой. При увеличении температуры возможен проскок верхом вторбутанола и воды, снижение температуры может привести к увеличению потерь триметилкарбинола.
Реакция дегидратации триметилкарбинола сопровождается образованием изобутилена, выход которого согласно принципу Ле-Шателье с повышением температуры растет.
Параметры процесса дегидратации.
Температура верха, 0С 130
Температура куба, 0С 135-140
Давление, МПа 0,36
Конверсия, % ~ 98-99
Селективность, % ~ 98,8
Узел по выделению вторбутанола идет во втором дегидрататоре, в который в качестве питания подается фузельная вода первых дегидрататоров. Второй дегидрататор состоит из нижней ректификационной части, и верхней реакционной. В нижней -ректификационной части происходит полное исчерпание вторбутанола, ТМК из фузельной воды. Поэтому процесс идет при температуре 110 °С и давлении 0,05МПа.
Поскольку вторичные алифатические спирты (вторбутанол) гораздо менее склонны к дегидратации (1:16), то даже большие их примеси не мешают селективности отщеплению воды от третичного спирта.
Изобутилен в виде газов уходит с отдувками. Вторбутанол с водой стекает в отстойную емкость, в которой вторбутанол и вода расслаиваются.
