
2. Реагирующие органические частицы
2.1 Радикалы
Свободными радикалами называются незаряженные частицы (атом или остаток молекулы, состоящий из группы атомов), имеющие в своем составе неспаренный электрон. В органических свободных радикалах неспаренный электрон может быть в основном у атома углерода (например, метильный СН3·), а также у атомов азота (R2N·), кислорода (RO·) и других элементов. Во внешней электронной оболочке этих атомов имеется семь электронов и валентность этих атомов на единицу меньше, чем в обычных органических соединениях.
Порядок устойчивости свободных радикалов следующий:
третичный радикал > вторичный > первичный > СН3·
Чем устойчивее свободный радикал, тем легче он образуется. Устойчивость радикалов определяет ориентацию и реакционную способность молекулы во многих реакциях, в которых образуются свободные радикалы, а также определяет выход продукта.
В зависимости от источника энергии для такого разрыва связи различают два типа расщепления молекулы.
1. Термическое расщепление. При достаточно высоких температурах в газовой фазе любая органическая молекула дает свободные радикалы. При энергии связей от 20 до 40 ккал/моль расщепление можно вызвать и в жидкой фазе. Типичным примером служит расщепление азосоединений:
![]()
2. Фотохимическое расщепление. Энергия света с длиной волны от 600 до 300 нм составляет от 48 до 96 ккал/моль, что соответствует энергии ковалентных связей. Типичным примером фотохимического расщепления служит образование радикалов из хлора и кетонов:
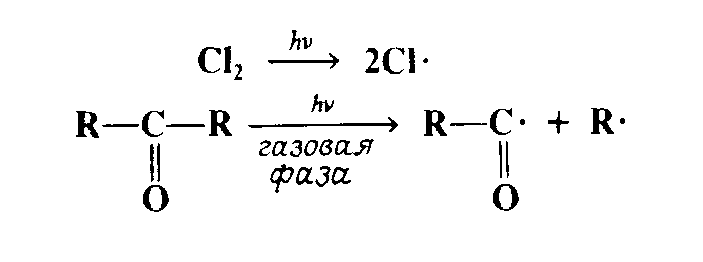
Свободные радикалы могут также образовываться из других свободных радикалов либо при реакции между радикалом и молекулой, либо при расщеплении радикала:
![]()
Кроме того, свободные радикалы получаются при окислении и восстановлении, в том числе электролитическими методами.
При реакциях свободных радикалов могут образовываться либо устойчивые продукты (реакции обрыва цепи), либо другие реакционноспособные радикалы, вступающие в дальнейшую реакцию (реакции роста цепи). Наиболее распространенные реакции обрыва цепи заключаются в комбинации одинаковых или разных радикалов:
![]()
Возможен также обрыв цепи путем диспропорционирования:
![]()
Известно четыре главных типа реакций роста цепи, из которых наиболее распространены первые два.
1. Отрыв радикалом атома или группы от молекулы, обычно атома водорода:
![]()
2. Присоединение радикала к кратной связи:
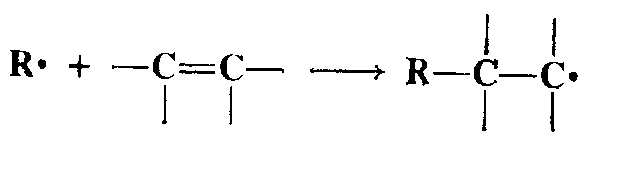
Образующийся при этом радикал может снова присоединяться к кратной связи. Это один из главных механизмов полимеризации винильных соединений.
3. Разложение. Примером служит разложение бензокси-радикала:
![]()
4. Перегруппировка:
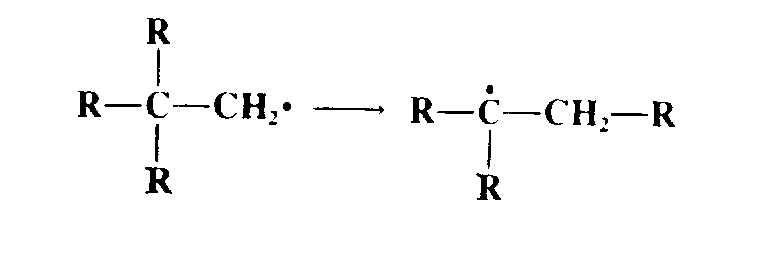
2.2 Карбокатионы
Карбониевые ионы − это группа атомов, содержащих атом углерода только с шестью электронами, т.е. атом углерода, имеющий свободную орбиталь. Также как и свободные радикалы, карбониевые ионы являются очень реакционноспособными частицами.
Порядок устойчивости карбониевых ионов следующий: третичный > вторичный > первичный > СН3+. Различие в устойчивости карбониевых ионов больше, чем в устойчивости свободных радикалов.
Карбокатионы можно генерировать одним из двух общих способов:
1. Прямой ионизацией, при которой группа, связанная с атомом углерода, уходит вместе с электронной парой:
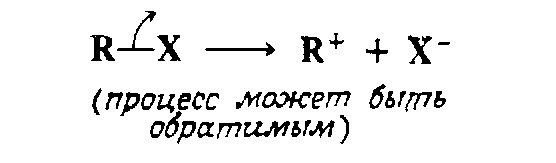
2. Присоединением протона или другой заряженной частицы к одному из атомов ненасыщенной системы, в результате чего соседний атом углерода оказывается положительно заряженным:
![]()
Независимо от способа образования карбокатионы чаще всего представляют собой короткоживущие промежуточные частицы, которые без выделения вступают в дальнейшие реакции. Карбокатионы могут реагировать несколькими путями, давая устойчивые продукты или другие карбокатионы, способные реагировать далее с образованием устойчивых продуктов.
Два главных направления, по которым карбокатионы реагируют с образованием устойчивых продуктов:
1. Комбинация с частицей, имеющей электронную пару:
![]()
Такой частицей могут быть ОН-, галогенид-ион или любой другой отрицательный ион, а также нейтральная частица, способная отдавать электронную пару.
2. Потеря атомом, соседним с карбокатионным центром, протона или другого положительно заряженного иона:
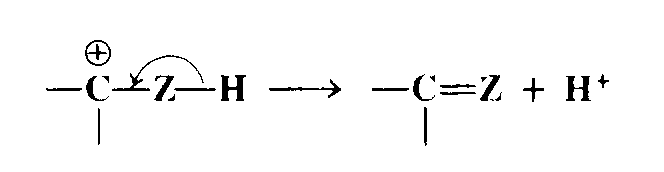
3. Перегруппировка. Водород, алкильная группа или арильная группа мигрирует вместе со своей электронной парой к положительному центру, в результате чего атом углерода, с которым она связана, становится положительно заряженным:
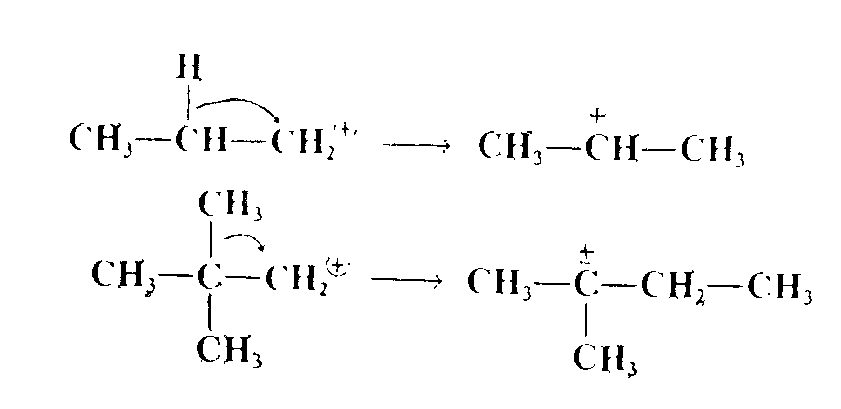
4. Присоединение. Карбокатион может присоединяться к двойной связи, при этом положительный заряд возникает в новом положении:
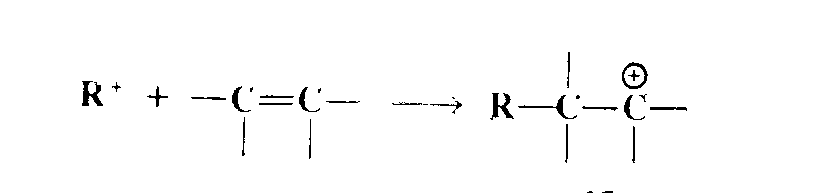
Образующиеся в результате перегруппировки или присоединения новые карбокатионы обычно реагируют далее по пути 1 или 2 и таким образом стабилизируются.
