
- •Электрод. Стандарный электродный потенциал. Гальванический элемент
- •Классификация электродов
- •Гальванический элемент. Схема гальванического элемента. Токообразующая реакция. Э.Д.С. Гальванического элемента.
- •Электролиз. Законы фарадея.
- •Последовательность процессов, протекающих на электродах, определяются потенциалами окислительно-восстановительных реакций, свойствами электролита, растворителя и материала электрода.
- •Перенапряжение выделения водорода и кислорода
- •Законы Фарадея
- •Примеры решения типовых задач
- •Вопросы и задания
- •Лабораторные работы
- •Г) Электролиз раствора Na2so4
- •Работа 6. Определение объемных и электрохимических эквивалентов водорода и кислорода
- •Варианты домашних заданий
- •Равновесные потенциалы водородного и кислородного электродов при различных рН
Перенапряжение выделения водорода и кислорода
Выделение этих двух газов сопровождается торможением процесса выделения на электродах. Торможение процесса зависит от материала электрода и рН раствора. В общем виде, процесс торможения называют перенапряжением выделения кислорода или водорода и обозначают как η.
Наибольшее перенапряжение выделения водорода наблюдается на Pb, Sn, Hg, Zn, Cd (η > 0,7 – 1,2 В). Перенапряжение близкое к нулю наблюдается на Pt, Rh, Pd, Ni. Остальные металлы имеют перенапряжение в пределах от 0,2 до 0,7 В.
Перенапряжение выделения О2 для большинства металлов η > 0,7. В зависимости от рН выделения водорода и кислорода меняется следующим образом:
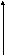 η,
В
η,
В

0 7 14 рН
Роль перенапряжения наглядно можно продемонстрировать на примере совместного выделения кислорода и хлора:
2Cl- - 2e = Cl2 (Е0 =1,35 В) и 2Н2О - 4е = О2 + 4Н+ (Е0 =1,23 В)
Теоретически на аноде должен бы выделяться кислород, так как у него более отрицательный потенциал, но вследствие высокого перенапряжения выделения кислорода на аноде выделяется хлор.
Законы Фарадея
1-й закон Фарадея: При пропускании электрического тока через раствор или расплав электролита массы веществ, выделившихся на электродах, пропорциональны количеству прошедшего электричества.
![]() ,
,
где k – электрохимический эквивалент, г/Кулон или г/Ачас, Q – количество электричества в кулонах (Асек), F = 96500 Кл/моль = 26,8 Ачас/моль – постоянная Фарадея.
С учетом Вт 1-й закон Фарадея выглядит следующим образом:
m = Э ∙ J ∙ τ ∙ Вт
F
Выходом
по току Вт
называется
выраженное в процентах отношение
количества, фактически полученного
продукта электролиза mфакт.
к теоретически рассчитанному mтеор.:
![]()
2-й закон Фарадея:
При прохождении через разные электролиты одного и того же количества электричества массы веществ, выделившихся на электродах, пропорциональны их эквивалентным массам:
![]() ,
,
где m1 и m2 – массы веществ 1 и 2, Э1 иЭ2, г/моль – эквивалентные массы веществ 1 и 2.
Примеры решения типовых задач
ПРИМЕР 1. Увеличится или уменьшится масса цинковой пластинки при взаимодействии с растворами: а) AgNO3; б) NiSO4;
Решение:
сравним значения стандартного потенциала
цинка
![]() со
значениями стандартных потенциалов
никеля
со
значениями стандартных потенциалов
никеля
![]() и серебра
и серебра
![]() .
Поскольку потенциал цинка имеет меньшее
значение, чем потенциал никеля и серебра,
то как более сильный восстановитель
будет вытеснять никель и серебро из
растворов их солей:
.
Поскольку потенциал цинка имеет меньшее
значение, чем потенциал никеля и серебра,
то как более сильный восстановитель
будет вытеснять никель и серебро из
растворов их солей:
Zn + NiSO4 = ZnSO4 + Ni (1); Zn + 2AgNO3 = Zn(NO3)2 + 2 Ag; (2)
При погружении цинка растворы NiSO4 и AgNO3, он будет растворяться, но одновременно на его поверхности будет осаждаться никель или серебро. Изменение массы цинковой пластины зависит от соотношения масс перешедшего в раствор цинка и осевшего на нем металла.
Согласно реакции (1) при растворении 1 моль цинка на поверхности осаждается 1 моль никеля. Сравним мольные массы металлов. Так как мольная масса никеля (58,9 г/моль) меньше, чем мольная масса цинка (65,4 г/моль), то масса цинковой пластины в растворе NiSO4 уменьшится.
Согласно реакции (2) при растворении 1 моль цинка осаждается 2 моль серебра, с мольной массой 107,9 г/моль, следовательно масса цинковой пластинки в растворе AgNO3 увеличится.
ПРИМЕР 2. Вычислить значение электродного потенциала меди, опущенной в раствор соли с концентрацией ионов Cu2+ = 0,001 моль/л.
Решение:
вычисление электродного потенциала
![]() производят
по уравнению Нернста:
производят
по уравнению Нернста:
![]()
![]() ,
где E0
– стандартный электродный потенциал,
В;
,
где E0
– стандартный электродный потенциал,
В;
n – количество эквивалентов металла, совпадающее с числом электронов, участвующих в электродном процессе;
R
= 8,31 Дж/моль![]() К
– универсальная газовая постоянная;
К
– универсальная газовая постоянная;
Т – температура, К;
F = 96500 Кл/моль – постоянная Фарадея;
С – концентрация (активность) катионов металла в растворе, моль/л;
При стандартных условиях (Т= 298К), с учетом численных значений R и F, а также при замене натурального логарифма десятичным, уравнение Нернста принимает вид:
![]()
![]()
На поверхности меди, опущенной в раствор ее соли, устанавливается равновесие: Сu2+ + 2e ↔ Cu.
Для
медного электрода уравнение Нернста
имеет вид:
![]()
![]()
ПРИМЕР
3. Рассчитайте ЭДС свинцово-цинкового
гальванического элемента, в котором
![]()
![]() и
и
![]() .
Узнать знаки полюсов, написать уравнения
электродных процессов, составить схему
гальванического элемента.
.
Узнать знаки полюсов, написать уравнения
электродных процессов, составить схему
гальванического элемента.
Решение: ЭДС гальванического элемента рассчитывают как разность потенциалоа анода и катода: Е= Ек – Еа.
Для определения анода и катода рассчитаем по уравнению Нернста значения электродных потенциалов цинка и свинца.
![]()
![]() электрод
с меньшим значением потенциала является
анодом ( цинковый электрод). На нем
протекает реакция окисления:
электрод
с меньшим значением потенциала является
анодом ( цинковый электрод). На нем
протекает реакция окисления:
(-) А: Zn – 2 e→ Zn2+.
Электрод с большим значением потенциала является катодом( свинцовый электрод), на нем протекает реакция восстановления:
(+) К: Pb2+ + 2e → Pb.
Уравнение токообразующей реакции: Zn + Pb2+ → Zn2+ + Pb.
Схема гальванического элемента: (-)Zn│Zn2+(0,1M)║Pb2+(0,01M)│Pb(+).
Рассчитываем ЭДС гальванического элемента
Е=
Ек
–
Еа
=
![]()
ПРИМЕР 4. Для гальванического элемента
Pt│Cr3+(0,1 моль/л), Cr2+(0,01 моль/л)║0,01 моль/лН+│Н2(pH2 = 1 атм),Pt
Рассчитать ЭДС, написать уравнения реакций, протекающих на аноде и катоде, составить уравнение токообразующей реакции, указать знаки полюсов. По какому направлению движутся электроды во внешней цепи?
Решение: данный гальванический элемент составлен из окислительно-восстановительного и водородного электродов.
Потенциал окислительно-восстановительного электрода рассчитываем по уравнению Нернста:

Стандартный
потенциал пары Сr3+/Cr2+
![]() .
.
Подставив
данные условия задачи, рассчитаем
потенциал окислительно-восстановительного
электрода: .
.
Правый электрод данного гальванического элемента является водородным электродом. Потенциал газового водородного электрода, согласно уравнению Нернста, зависит от концентрации (активности) ионов водорода и давления газа водорода в растворе:
![]() .
Учитывая, потенциал стандартного
водородного электрода
.
Учитывая, потенциал стандартного
водородного электрода
![]() равен нулю, а давление водорода по
условию задачи 1 атм. получим:
равен нулю, а давление водорода по
условию задачи 1 атм. получим:
![]() .
.
Определяем катод и анод. Поскольку окислительно-восстановительный электрод имеет меньший потенциал, то в гальваническом элементе он будет играть роль анода (отрицательный полюс), а водородный электрод – катода (положительный полюс). При работе элемента протекают реакции:
На аноде Cr2+ - e → Cr3+
На катоде 2 Н+ +2е→ Н2.
Суммарная токообразующая реакция описывается уравнением:
2 Cr2+ + 2 Н+ → 2 Cr3+ + Н2
Электроны при замыкании внешней цепи будут двигаться от отрицательного полюса к положительному.
ЭДС данного элемента
![]()
ПРИМЕР 5. Какие процессы протекают на электродах цинкового концентрационного гальванического элемента, если у одного из электродов концентрация (активность) ионов цинка Zn2+ равна 1 моль/л, у другого – 0,0001 моль/л? Какова ЭДС этого элемента?
Решение:
определим потенциалы обоих электродов.
Т.к концентрация (активность) ионов
цинка у первого электрода равна 1 моль/л,
то потенциал его будет равен стандартному
потенциалу цинкового электрода
![]() .
Потенциал второго электрода рассчитаем
по уравнению Нернста
.
Потенциал второго электрода рассчитаем
по уравнению Нернста
![]() Второй
электрод, имеющий меньший потенциал
будет анодом, на нем протекает реакция
окисления Zn
-2 e→Zn2+.
Второй
электрод, имеющий меньший потенциал
будет анодом, на нем протекает реакция
окисления Zn
-2 e→Zn2+.
Первый электрод является катодом, на нем протекает реакция восстановления Zn2+ + 2e→Zn.
Данный гальванический элемент можно отобразить схемой
(-) Zn│Zn2+(0,0001 моль/л)║Zn2+(1 моль/л)│Zn(+).
ПРИМЕР
6. Константа равновесия реакции,
протекающей в гальваническом элементе
(-)Zn│Zn2+║Cd2+│Cd(+),
равна 1,597•1012.
Определите электродный потенциал
кадмия, если электродный потенциал
цинка
![]() .
.
Решение: в данном гальваническом элементе протекает реакция
Zn
+ Cd2+
= Zn2+
+ Cd.
Между константой равновесия реакции,
протекающей в гальваническом элементе
и ЭДС элемента существует зависимость:
![]() .
.
Для
данного элемента
![]() .
.
![]() .
Отсюда
.
Отсюда
![]()
ПРИМЕР 6. Какие процессы будут протекать при электролизе водного раствора сульфата натрия с угольным анодом? Какие процессы изменятся, если угольный электрод заменить на медный?
Решение: в растворе сульфата натрия в электродных процессах могут участвовать ионы натрия Na+, SO42- и молекулы воды. Угольные электроды относятся к инертным.
На катоде возможны следующие процессы восстановления:
Na+
+ e → Na
![]()
2H2O
+ 2e → H2
+
2 OH-
![]()
Потенциал восстановления молекул воды(-0,82В) дан для щелочного раствора, с учетом подщелачивания среды в ходе электролиза. Сравнивая потенциалы катодных реакций, видим, что потенциал восстановления воды наибольший, что соответствует их большей окислительной способности. Поэтому на катоде будет происходить восстановление молекул воды, сопровождающееся выделением водорода и образованием в катодном пространстве гидроксид ионов ОН-. Ионы натрия Na+, приходящие к катоду будут накапливаться у электрода.
На аноде возможны следующие реакции:
2
SO42-
- 2e → S2O82-
![]()
2
H2O
- 4 e → 4H+
+ O2
![]() .
.
Окисление молекул воды идет при меньшем потенциале, следовательно, они обладают большей восстановительной способностью. Поэтому на аноде будет происходить окисление молекул воды с выделением кислорода и образованием кислой среды (ионов водорода Н+). Ионы SO42- будут накапливаться в анодном пространстве.
Таким образом, при электролизе раствора сульфата натрия с угольным инертным анодом в электродных процессах участвуют только молекулы воды. В близи катода ионы Na+ и OH- образуют раствор щелочи NaOH,а у анода ионы H+ и SO42- - раствор серной кислоты. Суммарная реакция электролиза выражается уравнением:
2 Na2SO4 + 6H2O = 2H2 + 4 NaOH + O2 + 2H2SO4.
у катода у анода
При замене инертного (угольного) анода на медный, на аноде становиться возможным протекание еще одной реакции окисления – растворение меди:
Cu
– 2 e
→ Cu2+
![]()
Этот процесс характеризуется меньшим значением потенциала, чем остальные возможные анодные процессы. Поэтому при электролизе Na2SO4 с медным анодом на аноде пройдет окисление меди, а в анодном пространстве будет накапливаться сульфат меди CuSO4. Cуммарное уравнение реакции электролиза выразится уравнением:
Na2SO4 + 2H2O + Cu = H2 + 2 NaOH + CuSO4.
ПРИМЕР 7. Составьте уравнение процессов, протекающих при электролизе водного раствора хлорида никеля NiCl2 с инертным анодом.
Решение: на катоде возможны следующие реакции:
Ni2+
+ 2e
→ Ni
![]()
2H2O
+ 2e
→ H2
+ 2 OH-
![]() .
Потенциал первой реакции выше, поэтому
на катоде протекает восстановление
ионов никеля.
.
Потенциал первой реакции выше, поэтому
на катоде протекает восстановление
ионов никеля.
Большинство процессов при электролизе идет с перенапряжением, особенно образование газов (H2, O2 и др.). Пренебрежение величиной перенапряжения полуреакций может привести к неправильному определению природы электродного процесса.
Возможные анодные реакции:
2
Cl-
- 2 e → Cl2
![]()
2H2O
– 4 e![]() O2
+ 4 H+
O2
+ 4 H+
![]()
Потенциал окисления воды дан для кислого раствора (рН =0), с учетом подкисления раствора при электролизе.
Согласно величинам стандартных электродных потенциалов на аноде должен выделятся кислород. В действительности на электроде выделяется хлор. Величина перенапряжения зависит от материала, из которого изготовлен электрод. Для графита перенапряжение кислорода η0 = 1,17 В, что повышает потенциал окисления воды до 2,4 В.
Следовательно, электролиз раствора хлорида никеля протекает с образованием никеля и хлора: Ni2+ + 2Cl- = Ni + Cl2.
ПРИМЕР 8. При электролизе водного раствора нитрата серебра AgNO3 с нерастворимым анодом в течение 25 мин. С силой тока 3 А на катоде выделилось 4,8 г серебра. Рассчитайте выход по току серебра. Какой процесс протекает на аноде ?
Решение: При электролизе водного раствора нитрата серебра AgNO3 в случае применения нерастворимого анода ( например графитового) на электродах протекают процессы:
(-)
К Ag+
+
e
→ Ag
![]() ,
,
(+)
A
2H2O
– 4 e![]() O2
+ 4 H+
O2
+ 4 H+
![]() , анион NO3-
не окисляем. Суммарное уравнение
электролиза нитрата серебра AgNO3:
2 AgNO3
+ 2H2O
= 2Ag
+ O2
+ 4HNO3.
, анион NO3-
не окисляем. Суммарное уравнение
электролиза нитрата серебра AgNO3:
2 AgNO3
+ 2H2O
= 2Ag
+ O2
+ 4HNO3.
По первому закону Фарадея масса вещества, образующегося при электролизе , прямо пропорциональна количеству пропущенного через раствор электричества Q:
![]() где
где
![]() -
электрохимический эквивалент, Э –
эквивалентная масса, г/моль, F
= 96500 Кл/моль= 26,8 А
-
электрохимический эквивалент, Э –
эквивалентная масса, г/моль, F
= 96500 Кл/моль= 26,8 А![]() час/моль
– постоянная Фарадея.
час/моль
– постоянная Фарадея.
На практике часто вследствие протекания побочных процессов на электродах образуется меньше вещества, соответствует по закону Фарадея. Выходом по току Вт называется выраженное в процентах отношение количества, фактически полученного продукта электролиза mфакт. К теоретически рассчитанному mтеор.:
![]() Определяем
mтеор.:
Определяем
mтеор.:
![]() Выход по току
Выход по току
![]() .
.
ПРИМЕР 9. Рассчитайте силу тока при электролизе раствора, если на катоде в течение 1 час 40 мин выделилось 1,4 водорода (н.у.).
Решение:
согласно закону Фарадея
![]() Так как количество водорода дано в
объемных единицах, то отношение
Так как количество водорода дано в
объемных единицах, то отношение![]() заменяем
отношением
заменяем
отношением
![]() ,
где
,
где
![]() –
эквивалентный объем водорода. Тогда
сила тока
–
эквивалентный объем водорода. Тогда
сила тока
![]()
ПРИМЕР 10. Рассчитайте значение теоретического напряжения разложения водного раствора сульфата никеля NiSO4 при электролизе на платиновых электродах.
Решение: рассчитать теоретическое напряжения разложения электролита, это значит определить разность потенциалов анодного и катодного процессов, протекающих на электродах: Eн.р.= Еа – Ек .
Платиновые электроды относятся к инертным электродам. При электролизе раствора NiSO4 на катоде выделяется никель, а на аноде – кислород:
(-)
К
Ni2+
+ 2e → Ni
![]()
(+)
A 2H2O
– 4 e![]() O2
+ 4 H+
O2
+ 4 H+
![]()
Теоретическое
напряжение разложения Eн.р.![]()
Практическое напряжкние разложения выше теоретического за счет перенапряжения выделения продуктов электролиза.
