
- •Лабораторный практикум
- •Производств”
- •Содержание
- •3. Работа № 3 Электрохимическая очистка промывных
- •Утилизация отработанного раствора химического меднения
- •Регенерация отработанных железо-медно-хлоридных травильных растворов
- •298 Vh2 ( Pопыт - Рвод.Пар)
- •Электрохимическая очистка промывных вод от ионов тяжелых металлов
- •Обезвреживание хромсодержащих сточных вод.
- •Электродиализная очистка промывных вод ванны сернокислого травления стали с регенерацией кислоты
- •Обезвреживание промывных вод от ионов тяжелых металлов методом ионного обмена
Электродиализная очистка промывных вод ванны сернокислого травления стали с регенерацией кислоты
Теоретическая часть
Источниками загрязнения окружающей среды в гальванотехнике являются промывные воды и отработанные концентрированные растворы. В современных условиях на передний план выдвигается экологичность технологических процессов с обеспечением регенерации ценных веществ.
Перед нанесением электролитического покрытия важной подготовительной операцией является операция травления стальных изделий. Одним из основных компонентов раствора данной операции является серная кислота. В результате травления с поверхности металла удаляются оксиды железа, растравливается сталь, что приводит к накоплению в травильном растворе сернокислого железа и эквивалентному уменьшению содержания серной кислоты. Это приводит к уменьшению скорости травления стали, а раствор травления подлежит замене. Залповый сброс таких растворов недопустим, так как нарушает режим работы очистных сооружений и приводит к безвозвратной потере ценных компонентов. Поэтому необходимо обезвредить промывные сточные воды и регенерировать раствор серной кислоты, которая может быть использована при приготовлении свежего раствора ванны травления.
Для обезвреживания и регенерации таких промывных вод могут быть использованы методы, отличающиеся своей эффективностью и экономичностью: химические, сорбционные, обратный осмос, электро-
27
диализ, прямой электролиз и др.
Все они имеют определенные достоинства и недостатки. Одним из перспективных методов обезвреживания и регенерации промышленных вод ванн кислотного травления стали является мембранный электролиз ( электродиализ ).
Цель работы:Произвести очистку промывных сточных вод от ионов железа (II) и регенерировать раствор серной кислоты. Выбрать оптимальные скорости протока промывных сточных вод через электролизер. Определить анодный и катодный выхода по току и удельный расход электроэнергии при электролизе.
Экспериментальная часть
Для выполнения работы собирается установка, представленная на рис. 7. Плотность тока при электролизе может изменяться от 0.3 до 1.2 А/дм2, а скорость протока промывных сточных вод от 0.2 до 1 л/час ( задается преподавателем).
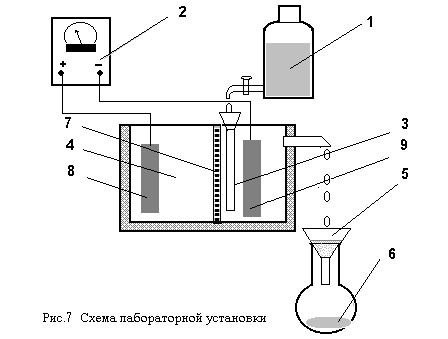
1 -промывная сточная вода;2 -источник постоянного тока ;3 -катодное пространство электролизера;4 -анодное пространство электролизера, заполненное разбавленным раствором серной кислоты;5 - воронка с бумажным фильтром;6 -колба для сбора очищенной воды;7 -анионитовая мембрана электролизера МА-40;8 - анод ;9 - катод.
28
Сточная вода, содержащая ионы железа (II), из емкости 1 поступает в катодное пространство электролизера. При работе электролизера на стальном катоде происходит электролиз воды с выделением водорода по реакции:
2 H2O + 2e- --------> H2 + 2 OH--
Вследствие подщелачивания прикатодного пространства (рН > 8 ) происходит очистка от ионов железа (II) по реакции:
Fe2+ + 2 OH-- ---------> Fe(OH)2
Образующиеся гидроксиды железа отделяются от воды на фильтре 5, а очищенная вода собирается в колбе 6.
На свинцовом аноде в разбавленном растворе серной кислоты протекает реакция
2 H2O — 4 e-- ----> 4 H+ + O2,
что приводит к увеличению концентрации серной кислоты при миграции ионов SO42--из католита через анионитовую мембрану 7. Очищенная от ионов железа вода из католита собирается в емкость 6 и анализируется на содержание ионов железа (II) по методике изложенной в Прил.3 к данной работе.
Выход по току для осаждения ионов железа в виде Fe(OH)2определяется из выражения:
Vk [ Fe2+]
Вт,к = ------------------ 100 % , (23)
Q qFe2+
где, Vk- объем очищаемой воды, прошедший через катодное пространство электролизера, л;
[Fe2+]- разность концентраций по ионам железа в очищенной воде на входе в электролизер и выходе из него , г/л;
Q - количество потекшего электричества через электролизер,А ч.
qFe2+- электрохимический эквивалент Fe2+— 1,042 г/А час.
Концентрация серной кислоты в анолите до и после электролиза определяется титрованием 0.1 н раствором NaOH с индикатором фенолфталеином по методике, приведенной в Прил.3 к данной работе.
Выход по току для процесса регенерации серной кислоты рассчитывается по формуле:
Va [H2SO4]
Вт,а = -------------------- 100 % (24)
Q qH2SO4
29
где, Va-объем серной кислоты в анодном пространстве, л;
[H2SO4] - разность концентраций серной кислоты до и после электролиза , г/л;
Q = I - количество электричества, прошедшее через электролизер, А час;
qH2SO4- электрохимический эквивалент H2SO4- (1.83) , г/А час.
Удельный расход электроэнергии при работе электролизера определяется из выражения , ( Вт ч/л )
Q Uср
W = --------- , (25)
V
где, Uср- среднее напряжение на электролизере, В;
Q - количество протекшего электричества, А час;
V - объем промывных сточных вод, прошедших через катодное пространство , л.
Экспериментальные данные, полученные при выполнении работы представляются в виде таблиц:
Токовая нагрузка на электролизер .............А.
Таблица 1
|
, мин |
|
|
|
|
|
|
|
|
U, В |
|
|
|
|
|
|
|
Концентрация Fe2+на входе .......... ,г/л
Таблица 2
|
[ Fe2+] на выходе ,г/л |
Cкорость протока Vкат, л/час |
Q
,А час |
Втkt
% |
W
,Вт ч/л |
|
|
V1 |
|
|
|
|
|
V2 |
|
|
|
|
|
- |
|
|
|
|
|
- |
|
|
|
|
|
Vn |
|
|
|
Таблица 3
|
Vанолит, л |
[H2SO4]нач г/л |
[H2SO4]кон г/л |
[H2SO4] г/л |
Q, А час |
Втаn % |
|
|
|
|
|
|
|
По опытным данным и расчетным значениям величин строят графики зависимостей [Fe2+] = f (Vкатолита); Bтк= f (Vкатолита) и
30
W = f(Vанолита). Обосновывается оптимальная скорость протока очищаемой воды через катодное пространство при заданной плотности тока. Приводится обсуждение полученных результатов и делаются выводы по работе.
Приложение 3 Методика анализа на ионы Fe2+
Содержание ионов железа (II) в очищаемой воде определяется по результатам титрования раствором перманганата калия (KMnO4).
Окислительно-восстановительный процесс, протекающий при титровании описывается следующими реакциями:
Fe2+ — e-- ----> Fe3+
MnO4-- + 8 H+ + 5 e-- ---> Mn2+ + 4 H2O
___________________________________________________
5 Fe 2+ + MnO4-- + 8 H+ ---> Mn2+ + 5 Fe3+ + 4 H2O
или в молекулярном виде:
10 FeSO4 + 2 KMnO4 + 8 H2SO4 ---> 2 MnSO4 + 5 Fe2(SO4)3 +
+ 8 H2O + K2SO4
В чистую коническую колбу отбирается пипеткой 10 мл очищаемой воды, добавляется 8 — 10 капель концентрированной серной кислоты (1:8) и 50 мл дистиллированной воды. Титрование производится 0,01 н раствором KMnO4.
Содержание ионов железа (II) определяется по формуле, (г/л):
NKMnO4 VKMnO4
[Fe2+] = ------------------------ Э Fe2+ ,
V Fe2+
где, NKMnO4 - нормальность раствора KMnO4, (0/01 н);
VКMnO4- объем раствора KMnO4, пошедшего на титрование , мл;
V Fe2+- Объем очищаемой воды, взятой на титрование, (10мл);
Э Fe2+- г-эквивалент Fe2+— 55?85 г/г-экв.
Методика определения концентрации H2SO4
В чистую коническую колбу отбирают 10 мл отработанного и идущего на очистку раствора серной кислоты, добавляют 50 мл дистиллированной воды , 2--3 капли фенолфталеина и полученный раствор титруют 0.1 н раствором NaOH до перехода окраски.
Концентрация раствора серной кислоты определяется из выражения , (г/л):
N NaOH VNaOH
[H2SO4] =------------------ ЭH2SO4 ,
VH2SO4 31
где, NNaOH- нормальность раствора NaOH на титрование ( 0.1 н );
VNaOH- объем раствора NaOH, пошедшего на титрование, мл;
VH2SO4 - объем раствора H2SO4, взятой на анализ, (10 мл);
ЭH2SO4- эквивалент H2SO4- 49 г/г-экв.
Литература.
1. Гибкие автоматизированные гальванические линии./ Cправочник под ред. В.Л.Зубченко, М.: Машиностроение, 1989. 467 с.
2. Технология очистки сточных вод гальванического производства автомобильной промышленности / РТМ 37.002.0340--80. ЭКТИавтопром, Львов. 1980. 128 с.
Вопросы для самопроверки.
1. Электродные процессы, протекающие в электролизере ?
2. Материалы электродов электролизера ?
3. Взаимосвязь скорости протока и плотности тока при электролизе ?
4. Влияет ли концентрация кислоты в анолите на селективность мембран ?
5. Куда должен подаваться раствор, подлежащий обезвреживанию, при установке катионитовой или анионитовой мембраны ?
6. Как зависит выход по току от объемной плотности тока ?
7. Как будут распределяться потоки в многокамерном электродиализаторе при чередовании анионитовых и катионитовых мембран ?
Лабораторная работа № 6
