
- •Лабораторный практикум
- •Производств”
- •Содержание
- •3. Работа № 3 Электрохимическая очистка промывных
- •Утилизация отработанного раствора химического меднения
- •Регенерация отработанных железо-медно-хлоридных травильных растворов
- •298 Vh2 ( Pопыт - Рвод.Пар)
- •Электрохимическая очистка промывных вод от ионов тяжелых металлов
- •Обезвреживание хромсодержащих сточных вод.
- •Электродиализная очистка промывных вод ванны сернокислого травления стали с регенерацией кислоты
- •Обезвреживание промывных вод от ионов тяжелых металлов методом ионного обмена
Регенерация отработанных железо-медно-хлоридных травильных растворов
Теоретическая часть
Железо-медно-хлоридные растворы широко используются при изготовлении печатных плат и схем в радиоэлектронной промышленности. Процессы, протекающие при травлении медной фольги в этих растворах можно описать следующими химическими реакциями:
Cu + 2 FeCl3 ------> CuCl2 + 2 FeCl2
Cu + CuCl2 -------> 2 CuCl
CuCl + n KCl -------> KnCuCln+1 n=1;2
При увеличении содержания меди (I) в травильных растворах происходит уменьшение содержания железа (III)- основного травильного агента, окислительные свойства раствора уменьшаются и он перестает работать. Для восстановления окислительной способности раствора необходимо извлечь из него стравленную медь и восполнить недостаток ионов железа (III).
Цель работы: Провести электрохимическую регенерацию отработанного железо-медно-хлоридного травильного раствора. Определить количество и состав продуктов, получаемых в катодном и анодном пространстве, выхода по току и удельный расход электроэнергии.
Экспериментальная часть
Электрохимическая регенерация отработанного железо-медно-хлоридного раствора проводится в электролизере диафрагменного типа с разделенными катодным и анодным пространствами ( рис. 3).
В качестве анода используется графитовый электрод, а в качестве катода - медный или титановый. При прохождении электрического тока на катоде возможно одновременное протекание следующих электрохимических процессов:
на катоде:
Cu2+ + 2 e- -----> Cu Eo = +0.34 В
2 H+ + 2 e- -----> H2 Eo = 0.0 В
Fe3+ + e- -----> Fe2+ Eo = — 0.44 В
на аноде :
Fe2+ - e- -------> Fe3+ Eo = — 0.44 B
2 Cl- - 2 e- -------> Cl2 Eo = +1.32 B
10
Залить в электролизер отработанный травильный раствор, заполнить бюретку этим раствором и записать начальный объем электролита в ней, Собрать электрическую схему (рис.3) и по заданию преподавателя установить ток ( в пределах рабочих плотностей тока 0.5 - 2.0 А/дм2).
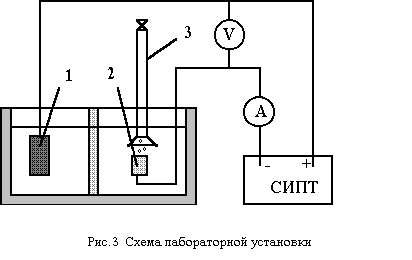 1 — анод ( графит ); 2 — катод (
медная фольга, титановая пластина ); 3
— бюретка с воронкой для сбора
выделяющегося
1 — анод ( графит ); 2 — катод (
медная фольга, титановая пластина ); 3
— бюретка с воронкой для сбора
выделяющегося
водорода; V — вольтметр ; А — амперметр; СИПТ — стабилизированный источник постоянного тока.
Провести процесс электролиза в течение 30 минут, записывая
каждые 10 минут значения: напряжения на электролизере, объем электролита в бюретке и другие параметры (согласно задания). После окончания электролиза выключить источник питания. По полученным данным рассчитать среднее значение тока или напряжения, а по разнице объемов электролита в бюретке определить количество выделившегося водорода на катоде.
Снять крышку электролизера и счистить с катода порошок меди, промыть его, высушить и взвесить.
Взять пробы электролита из катодного и анодного пространств электролизера и определить количество ионов железа (II) титрованием железо-медно-хлоридного раствора 0.1 н раствором KMnO4, согласно прилагаемой методике ,см. Прил .1 к работе).
Зная величину тока и время электролиза, определяем кличе-
ство протекшего через электролизер электричества. Определив массу
11
медного порошка его взвешиванием, объем выделившегося водорода (приведенного к нормальным условиям) , мл
