
- •Лабораторный практикум
- •Производств”
- •Содержание
- •3. Работа № 3 Электрохимическая очистка промывных
- •Утилизация отработанного раствора химического меднения
- •Регенерация отработанных железо-медно-хлоридных травильных растворов
- •298 Vh2 ( Pопыт - Рвод.Пар)
- •Электрохимическая очистка промывных вод от ионов тяжелых металлов
- •Обезвреживание хромсодержащих сточных вод.
- •Электродиализная очистка промывных вод ванны сернокислого травления стали с регенерацией кислоты
- •Обезвреживание промывных вод от ионов тяжелых металлов методом ионного обмена
Обезвреживание хромсодержащих сточных вод.
Теоретическая часть.
Одним из важных источников загрязнения окружающей среды являются промывные воды и отработанные концентрированные растворы электрохимических производств. Практически все сбросы этих производств имеют ярко выраженную биологическую активность и способны вызывать неблагоприятные последствия. Сбрасываемые соединения металлов, входящих в состав электролитов, весьма токсичны и представляют опасность для здоровья людей и живых организмов. Например, одним из наиболее вредных компонентов сточных вод являются соединения , содержащие Cr (VI).
Пыли и аэрозоли 3-х и 6-ти валентного хрома действуют прижигающе на покровный эпителий носа и, разрушая его, вызывают изъязвления и пропадание носовых перегородок. Аэрозоли Cr (VI) могут кроме того проникать в легкие и желудочно-кишечный тракт и вызывать общее отравление организма.
При обработке концентрированных отработанных растворов может быть осуществлена их регенерация , утилизация и обезвреживание.
Полученные после регенерации растворы могут вновь направляться в технологический процесс. При утилизации из растворов извлекают наиболее ценные, дефицитные компоненты, которые могут вновь использованы в данном или другом технологическом процессе. Обезвреживание отработанных растворов чаще всего сводится к их нейтрализации перед сбросом. Если в процессе нейтрализации образуются однородные по химическому составу твердые осадки, то последние могут быть использованы в качестве “товарных” продуктов, например, удобрений в сельском хозяйстве.
Основными процессами, дающими хромсодержащие сточные воды являются: хромирование, хроматирование цинковых и кадмиевых покрытий, травление и электрополирование стальных деталей, Травление и анодирование деталей из алюминиевых сплавов и другие технологические процессы. Жидкие отходы этих технологических процессов содержат: Cr6+, Cr3+, Zn2+, Cd2+|, Cu2+, Fe3+, Fe2+, Na+, K+, Ba2+, SO42-, PO43-, NO3-, Cl-, CO22-, SiO32-, а также блескообразователи и смачиватели.
Целесообразность выбора того или иного метода и схемы очистки жидких отходов зависит от состава, концентрации, режима поступления и объемов стоков, медико биологических и технологических
19
требований к очищенной воде, необходимости и возможности регенерации, утилизации и повторного использования воды и ценных компонентов. Кроме того, выбор метода и схемы очистки проводится с учетом сравнения технико-экономических показателей различных вариантов.
Среди методов, применяемых для очистки и обезвреживания хромсодержащих жидких отходов, можно назвать следующие:
1. Обезвреживание сульфитными соединениями;
2. Обезвреживание железным купоросом;
3. Обезвреживание пероксидом углерода;
4. Метод Ланси;
5. Электрохимический метод;
6. Биохимический метод.
Каждый из перечисленных методов имеет как достоинства, так и недостатки.
Что касается электрохимического метода, то к его преимуществам можно отнести возможность очистки растворов до концентрации хрома 1 гм/л с выходом по току, близким к 100 %, а к недостаткам — необходимость дополнительного оборудования и энергозатрат, а так же возможности пассивации электродов.
Электрохимическая очистка хромсодержащих сточных вод может быть осуществлена с растворимыми и с нерастворимыми анодами.
При электролизе таких растворов с растворимыми железными анодами могут протекать следующие электродные процессы:
на катоде:
Cr2O72- + 14 H+ + 6 e- -------> 2 Cr3+ + 7 H2O E0 = 1.333 B
CrO42- + 8 H+ + 3 e- -------> Cr3+ + 4 H2O E0 = 1.477 B
2 H+ + 2 e- ----> H2 E0 = — 0.0 B
на аноде:
Fe — 2 e- ------> Fe2+ E0 = — 0.44 B
Образующиеся при анодном окислении ионы Fe2+восстанавливают в объеме раствора хромат и бихромат-ионы по реакциям:
Cr2O72- + 6 Fe2+ + 14 H+ -------> 2 Cr3+ + 7 H2O + 6 Fe3+
CrO42- + 3 Fe2+ + 8 H+ -------> Cr3+ + 4 H2O + 3 Fe3+
Так как во всех катодных процессах и химических реакциях, протекающих в объеме раствора, происходит расходование протонов водорода, что приводит к защелащиванию раствора, то далее в объеме
20
раствора могут протекать вторичные процессы с образованием гидро- ксидов хрома и железа:
Fe3+ + 3 OH- ------- > Fe(OH)3
Cr3+ + 3 OH- ------- > Cr(OH)3
При электролизе с нерастворимыми (Pb или Pb- Sb) анодами могут протекать следующие электродные процессы:
на катоде:
Cr2O72- + 14 H+ + 6 e- -------> 2 Cr3+ + 7 H2O E0 = 1.333 B
2 H+ + 2 e- ----> H2 E0 = 0.0 B
на аноде:
H2O — 2 e- ----- > 1/2 O2 + 2 H+ E0 = 1.17 B
2 Cr3+ + 7 H2 O — 6 e- ----- > Cr2O72- + 14 H+ E0 = 1.333 B
В случае попадания в сточные воды ионов Fe3+на электродах будет протекать еще один процесс:
Fe3+ + e- <===> Fe2+ Е0= — 0.44 В
В присутствии ионов Fe(III) катодный процесс восстановления Cr(VI) до Cr(III) интенсифицируется и одновременно ингибируется анодный процесс окисления Cr(III) до Cr(VI).
После электрохимической обработки к жидким отходам добавляются реагенты для осаждения Cr(III) в виде Cr(OH)3.
Электролизеры для восстановления Cr(VI) могут быть диафрагменного и бездиафрагменного типа.
В качестве диафрагмы в них используют пористые синтетические материалы и ионообменные мембраны. Электролизеры могут быть прямоточного и противоточного типа, различной конфигурации, с вертикальным и горизонтальным расположением пластинчатых, стержневых, гофрированных, перфорированных электродов. Электроды могут быть также стружечными и гранулированными.
В практике очистки жидких отходов гальванических цехов наибольшее распространение получили электролизные ванны с вертикально расположенными электродами и вертикальным или горизонтальным движением обрабатываемой воды.
Электролизеры с непроточной камерой применяют при концентрации хрома в исходной воде выше допустимой, а также при повышении концентрации в воде ионов, склонных к образованию отложений ( Cu2+, Mg2+,PO42-, и других).
21
Допустимые концентрации Cr(VI) в зависимости от солесодержания сточных вод приведены в табл. 1.
Таблица 1
|
Солесодержание мг/л |
Концентрация Cr(VI), мг/л |
Солесодержание мг/л |
Концентрация Cr(VI), мг/л |
|
80 — 150 |
5 |
400 — 500 |
30 |
|
150 — 200 |
10 |
500 — 700 |
40 |
|
200 — 300 |
15 |
700 — 900 |
50 |
|
300 — 400 |
20 |
900 — 1000 |
60 |
Солесодержащими компонентами раствора являются хорошо растворимые соли, содержащие ионы Na+, K+, SO42-, Cl-.
При электролизе с растворимыми железными анодами в непроточном режиме в анодной камере устанавливается кислая среда и пакет железной стружки растворяется с образованием ионов Fe(II), которые восстанавливают в объеме католита ионы Cr(VI) до Cr(III). После обработки в электролизере вода подается на фильтрование или отстаивание.
При электрохимическом восстановлении ионов Cr(VI)с использованием нерастворимых анодов могут обрабатываться жидкие отходы с большими концентрациями Cr(VI) (более 2 г/л). Электролиз проводится со свинцовыми или свинцово-сурьмянистыми анодами, не подвергающимися электролитическому растворению. Катоды изготовляются из легированной стали. Электролиз чаще всего ведется в бездиафрагменном непроточном электролизере периодического действия. После электрохимической обработки к жидким отходам добавляются щелочные реагенты для осаждения Cr(III) в виде Cr(OH)3.
Цель работы: Проведение процесса электрохимической очистки хромсодержащих сточных вод, определение зависимости выхода по току и удельного расхода электроэнергии от режима электролиза и состава сточных вод, оценка качества очистки.
Экспериментальная часть.
Вариант № 1.
Электрохимическая очистка сточных вод от соединений Cr(VI) в непроточном диафрагменном электролизере с растворимым стружечным железным анодом.
Взять рас вор K2Cr2 O7с концентрацией 0.5 г/л , отобрать 10 мл раствора и разбавить его до 100 мл дистиллированной водой (объем разбавления согласно задания преподавателя), получили концентрацию Cr(VI) — 50 мг/л. Замеряем оптическую плотность приготовленного раствора.
22
Перед измерением устанавливаем стрелку прибора на нуль (верхняя шкала). Записываем начальную оптическую плотность раствора. Перед тем, как залить исследуемый раствор в электролизер, железную стружку в анодном пространстве протравливаем в растворе, содержащем соляную и серную кислоты (70 мл НСl + 150 мл H2SO4). Для этого травильный раствор заливаем в электролизер и протравливаем стружку в течение 3 минут. После этого раствор сливаем и промываем электролизер дистиллированной водой два раза. Заливаем исследуемый раствор, К железному катоду подключаем ( — ) , а к титановому аноду ( + ) клеммы источника постоянного тока . Устанавливаем ток по заданию преподавателя в пределах 50 — 100 мА (или постоянное напряжение). Проводим электролиз в течении часа. Раствор сливаем через фильтр и замеряем его оптическую плотность.
Опыт проводится в диафрагменном электролизере конструкции Украинского института водного хозяйства, принципиальная схема которого приведена на рис. 5.
1 2 3 4 5 6 7
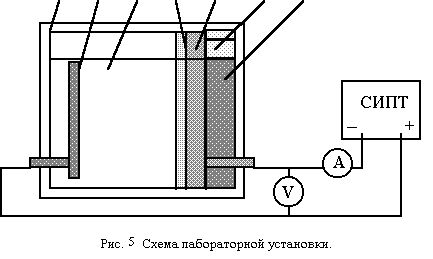
1— корпус; 2 — катод ( сталь легированная); 3 — катодная камера;
4 — диафрагма; 5 — перфорированный анод; 6 — анодная камера;
7 — пакет стальной стружки; А — амперметр; V — вольтметр.
Катод выполнен из хромоникелевой стали Х18Н9, имеет поверхность Sktпримерно 20 см2.
Анодный комплект представляет собой перфорированную пластину из титана и пакет стальной стружки.
23
Со стороны, обращенной к катоду, анод отделен от последнего диафрагмой из хлориновой ткани, вставленной в рамку из органического стекла, которая плотно прижата к корпусу электролизера.
В промытый H2SO4 ( 1:4 ) и дистиллированной водой электролизер залить 150 мл раствора ,подлежащего очистке от Cr(VI), состав которого задается преподавателем. При расчете силы тока учитывать, что катод работает одной стороной, обращенной к диафрагме.
Электролиз вести в течение расчетного времени, с замером напряжения через каждые 15 минут при поддержании постоянной силы тока (ил напряжения). По окончании опыта католит и анолит одновременно сливаются в один цилиндр объемом 100 мл. Электролизер промывается последовательно H2SO4( 1: 4 ) и дистиллированной водой. Обработанная вода, содержащая Cr(III) фильтруется от Fe(OH)3и Cr(OH)3. Фильтрат подвергается анализу на содержание Cr(VI) по величине оптической плотности по калибровочному графику.
Результаты измерений заносятся в таблицу 2
Таблица 2
|
, мин |
I, А |
U, B |
Cисх Cr(VI) |
Cкон Cr(VI) |
|
|
|
|
|
|
По результатам опыта рассчитывается общий выход по току при электролизе для восстановления Cr(VI) :
( С0 — С1 ) Vk
Втобщ = ----------------------- х 100 % , ( 20 )
q Cr6+/Cr3+ I
где С0 и С1— концентрация Cr(VI) соответственно в исходном и обез- вреженном растворах, г-экв/л;
q Cr6+/Cr3+— электрохимический эквивалент восстановления Cr(VI) до Сr(III) .
Эффект превращения Cr6+в Cr3+рассчитываем по формуле:
Эп = 1 - С1 / С0 ( 21 )
(при полном восстановлении Сr6+Эп= 1).
Определяется удельный расход электроэнергии на обезвреживание 1 л хромсодержащих стоков
Uср Icp
W = -------------------х 103 , кВт ч/л , ( 22 )
Vр-ра Эп
24
где Ucp; Icp — среднее напряжение или средний ток на ванне за время электролиза.
Опытные и расчетные данные для процесса обезвреживания сводят табл. 3.
Сила тока I = ____ A, Объем раствора Vр-ра= ____ мл
Исходная концентрация Cr(VI) C0= _______ мг/л.
Таблица 3
|
Время с начала опыта, ,мин |
Кол-во электричества Q, А ч |
Напряжение, U, В |
Концентрация Cr6+, мг/л |
Втобщ, % |
Втп, % |
Эп |
W, кВт ч/л |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
15 |
|
|
|
|
|
|
|
|
30 |
|
|
|
|
|
|
|
Вариант 2
Электрохимическая очистка сточных вод от Cr(VI) в непрточном бездиафрагменном электролизере с нерастворимым анодом. Опыт проводится в электролизере схема которого приведена на рис. 6.

1 — стакан емкостью 2500 мл; 2 — катод из стали Х18Н9Т;
3 — крышка с отверстием; 4 — анод из свинца; А — амперметр;
V — вольтметр.
25
В электролизер заливается 200 мл исходного раствора, концентрация Cr(VI) в котором задается преподавателем. Рассчитывается сила тока по заданной плотности тока и поверхности катода. Собирается электрическая схема и включается источник постоянного тока. Устанавливается ток и электролиз проводится в течение 1,5 — 2-х часов с замером напряжения через каждые 15 минут и поддержанием заданной величины тока. По окончании опыта раствор анализируется на содержание Cr(VI).
По результатам опыта рассчитывается выход по току (Втобщ), эффект превращения Cr(VI) в Cr(III) — Эпи удельный расход электроэнергии на обезвреживание 1 литра хромсодержащего раствора — W , соответственно по формулам (20) , (21) и (22).
Экспериментальные и расчетные данные сводятся в табл. 4.
Сила тока I = ____ A, Объем раствора Vр-ра= ____ мл
Исходная концентрация Cr(VI) C0= _______ мг/л.
Таблица 4
|
Время с начала опыта, , мин |
Кол-во электричества Q, А ч |
Напряжение U,В |
Концентрация Cr6+, мг/л |
Втобщ, % |
Втп, % |
Эп |
W, кВт ч/л |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
15 |
|
|
|
|
|
|
|
|
30 |
|
|
|
|
|
|
|
Литература.
1. Гибкие автоматизированные гальванические линии./ Справочник под ред. В.Л.Зубченко .М: Машиностроение, 1989. 467 с.
2. С.В.Яковлев, И.Г.Краснобородько, В.Н.Рогов. Технология электрохимической очистки воды., Л.: Стройиздат, 1987. 308 с.
3. А.А.Гвоздев., Б.С.Ксенофонтов Очистка производственных сточных вод и утилизация осадков, М.: Химия, 1988. 343 с.
Вопросы для самопроверки.
1. Какие методы очистки сточных вод используются для обезвреживания хромсодержащих растворов?
2. Электрохимические методы обезвреживания хром-содержащих растворов.
3. Процессы, протекающие на электродах в бездиафрагменном электролизере с нерастворимыми электродами.
26
4. Процессы, протекающие на электродах в электролизерах с растворимым анодом.
5. Необходимость использования диафрагмы и требования к материалу диафрагмы.
6. Выбор конструкции и материалов для растворимых и нерастворимых электродов.
7.В чем отличия в параметрах процесса обезвреживания хромсодержащих сточных вод при проведении электролиза при постоянном напряжении на ванну и на постоянном токе.
Лабораторная работа № 5
