
3. Стехиометрия
.pdfФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Нижегородский государственный университет им. Н.И. Лобачевского
СТЕХИОМЕТРИЯ
Конспект лекций по курсу неорганической химии
Рекомендовано методической комиссией химического факультета для студентов ННГУ, обучающихся по направлению подготовки 020100 “Химия” и специальностям 020101 “Химия”, 020801 “Экология”, 240306 “Химическая технология монокристаллов, материалов и изделий электронной техники”
Нижний Новгород
2010
2
УДК 541.15
ББК 24
СТЕХИОМЕТРИЯ: Составитель: Сибиркин А.А. Конспект лекций по курсу неорганической химии. – Нижний Новгород: Нижегородский госуниверситет, 2010. – с.
Рецензент:
В третьей части конспекта лекций на современном уровне излагаются основы учения о стехиометрии на базе представлений о химической переменной. Подробно на примерах представлены способы решения основных расчетных задач. В свете понятия о химической переменной развито и методически разработано учение об эквивалентах.
Конспект лекций предназначено для студентов ННГУ, обучающихся по направлению подготовки 020100 “Химия” и специальностям 020101 “Химия”, 020801 “Экология”, 240306 “Химическая технология монокристаллов, материалов и изделий электронной техники”.
Ответственный за выпуск:
заместитель председателя методической комиссии химического факультета ННГУ,
к.х.н., доцент Гуленова М.В.
УДК 541.15
ББК 24
3
Стехиометрия
Стехиометрия − это раздел химии, изучающий количественные соотношения между участниками реакции.
Задачами стехиометрии являются расчеты количеств вещества, массы или объема участников реакции.
Современное учение о стехиометрии основывается на понятии химической переменной.
Химическая переменная. Количества участвующих в реакции веществ пропорциональны стехиометрическим коэффициентам. Для реакции
ν A A +ν B B →νCC +ν D D
справедливо выражение:
χ = − |
nA = − |
nB = |
nC = |
nD |
|
ν A |
ν B |
νC |
ν D |
Отношение количества реагирующего вещества к коэффициенту одинаковы для всех участников реакции и определяет химическую переменную.
Знак минус у исходных веществ связан с тем, что nA и nB меньше нуля, так как эти вещества расходуются. Для продуктов реакции n > 0, и потому в формуле будет знак плюс.
Свойства химической переменной.
1.Значение Δχ не зависит от выбора участника реакции.
2.Размерность Δχ − моль, так как она является отношением
количества вещества к безразмерному стехиометрическому коэффициенту.
3.Знак Δχ указывает на направление процесса. Так, Δχ > 0 соответствует прямой реакции, Δχ < 0 − обратной реакции, Δχ = 0 − отсутствию изменений в системе.
4.Величина Δχ экстенсивна, и это позволяет использовать ее для расчета других экстенсивных свойств.
5.Если возможно протекание нескольких реакций, то каждой из них ставится в соответствие свое значение Δχ.

4
Применение химической переменной в стехиометрических расчетах. Исходя из определения Δχ и количества вещества, получаем:
Dχ = ± |
n |
= ± |
|
m |
= ± |
|
V |
|
ν |
ν M |
νVm |
||||||
|
|
|
||||||
Каждая из частей выражения, записанная для одного участника реакции, равна таковой для другого участника. Это
позволяет сразу получить расчетное неявное выражение в стандартных задачах.
Пример 1. Рассчитайте объем водорода, измеренный при температуре 20 °С и давлении 98 кПа, который выделится при действии на 19.5 г цинка избытка соляной кислоты.
Уравнение реакции:
Zn + 2HCl → ZnCl2 + H2
(составлять химическое уравнение необходимо, так как потребуются стехиометрические коэффициенты).
Выберем для Zn фрагмент с массой (есть число в условии), а для H2 − фрагмент с объемом (есть в вопросе задачи). Подставляя стехиометрические коэффициенты в соответствующие фрагменты, получаем:
Dχ = |
Dm |
|
|
= |
|
DV |
|
|
|
= |
|
DV |
|||
|
|
||||||||||||||
1× M |
|
|
1×V |
|
|
|
|
æ |
RT ö |
||||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
Zn |
|
|
|
m |
|
H2 |
|
1ç |
|
÷ |
||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
è |
P ø |
||
откуда после подстановки данных условия:
,
H2
DV |
H2 |
= |
RT |
|
|
|
× Dm |
|
|
= 7.46 л |
|
|
|
|
|
||||||||
|
|||||||||||
|
|
P |
|
H2 |
M |
|
Zn |
|
|||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
||||||
В задачах произвольной сложности привлекается условие материального баланса. Масса вещества, вступившего в реакцию или образующаяся в ее результате, выражается через химическую переменную следующим образом:

5
m = M n = ±ν M χ .
Пример 2. Рассчитайте массу SO3, которую необходимо добавить к 200 г 95 % водного раствора H2SO4, чтобы получить 5 % олеум.
Решение. Уравнение реакции:
SO3 + H2O → H2SO4
Схема материального баланса:
Система уравнений материального баланса (компоненты обозначены соответствующими греческими буквами):
SO3 |
(α) |
m1 |
|
−1 |
χ Mα = |
ω3m3 |
H2O |
(β) |
|
(1−ω2 )m2 |
−1 |
χ M β = |
0 |
H2SO4 |
(γ) |
|
ω2 m2 |
+1 |
χ Mγ = |
(1−ω3 )m3 |
В системе из трех уравнений есть три неизвестные, а именно,
m1 (ответ), χ |
и m3 . Задача корректна. |
Из второго уравнения |
|||
находим: |
|
|
|
|
|
χ = |
(1−ω2 )m2 |
= |
(1- 0.95)×200 г |
= 0.556 моль. |
|
M β |
18 г / моль |
||||
|
|
|
|||
Отношение левой и правой частей третьего и первого уравнений дает уравнение с одним неизвестным (переменная m3
исключается в результате деления):
|
|
|
m1 −1 χ Μα |
= |
|
|
ω3 |
, |
|
|
|||||
|
|
|
|
1 |
|
|
|
||||||||
|
|
ω2m2 +1 χMγ |
−ω3 |
|
|
||||||||||
m = |
|
|
ω3 |
(ω |
m |
|
+ χ M |
γ |
)+ χ M |
α |
, |
||||
1−ω3 |
|
||||||||||||||
1 |
2 |
|
2 |
|
|
|
|
|
|
|
|||||

6
m1 = 00..0595 (0.95×200г + 0.556 моль×98г / моль)+
+ 0.556 моль×80 г / моль = 00..0595 ×244.5г + 44.5 г = 57.4 г
Ответ: 57.4 г.
Избыток и недостаток реагентов. Пусть в реагирующую систему
ν A A +ν B B →νCC +ν D D
введены исходные вещества A и B в таких количествах, что
|
nA |
> |
nB |
, или χ A > χB . |
ν A |
|
|||
ν B |
||||
Говорят, что вещество A находится в избытке, а B − в недостатке. Полностью прореагировать может только недостающее вещество, так что
χ = min{χA , χB }= χB .
Это уравнение позволяет рассчитать максимальное значение χ , соответствующее полному протеканию реакции.
Пример. Рассчитайте массовую долю вещества в растворе, полученном взаимодействием 1000 г воды и 115 г натрия.
Решение. Уравнение реакции: 2Na+2H2O→2NaOH+H2.
Рассчитаем изменение химической переменной:
ì |
|
115 г |
|
|
1000 г |
ü |
|
|
Dχ = min{χNa , χH2O }= miní |
|
|
|
; |
|
|
ý |
= |
2 |
× 23 г / моль |
2 |
|
|||||
î |
|
×18 г / мольþ |
|
|||||
= min{2.5моль; 27.8моль}= 2.5моль.
Теперь χ можно считать известной величиной в системе уравнений материального баланса. Схема материального баланса:

7
Система уравнений материального баланса:
Na |
(α) |
m1 |
− 2 |
χ Mα = |
0 |
H2O (β) |
|
m2 − 2 |
χ M β = |
(1−ω3 )m3 |
|
NaOH (γ) |
|
+ 2 |
χ Mγ = |
ω3m3 |
|
H2 |
(δ) |
|
+1 χ Mδ = |
m4 |
|
Первое уравнение не содержит неизвестных величин (изменение химической переменной найдено ранее). Четвертое уравнение использоваться не будет, так как содержит величину, которую находить не нужно. Отношение второго и третьего
уравнений дает выражение с единственной и притом искомой неизвестной:
1-ω |
3 |
= |
m2 |
− 2 χ M β |
= |
1000г - 2 |
× 2.5 моль×18г / моль |
= |
910г |
= 4.55, |
|
ω3 |
|
|
2 Dχ Mγ |
|
2× 2.5 |
моль×40 г / моль |
200г |
||||
|
|
|
|
|
|
||||||
1−ω3 = 4.55ω3 , ω3 = 5.155 = 0.180.
Ответ: 18 %.
Выход реакции. В том случае если реакция протекает не до конца, фактическое изменение Δχф меньше стехиометрического изменения Δχ. Глубина протекания процесса характеризуется
стехиометрическим выходом
η = Dχχф .
Если реакция протекает до конца, то η = 1, а если не полностью – то
0 < η <1.
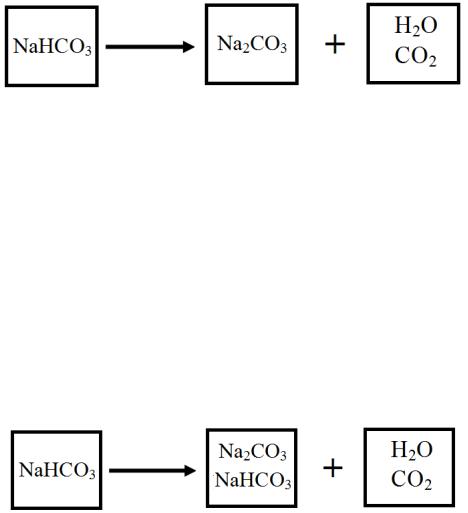
8
Пример. При разложении 4.00 г NaHCO3 получено 3.00 г твердого остатка. Рассчитайте выход реакции (в процентах от стехиометрического).
Решение. Уравнение реакции:
2NaHCO3 → Na2CO3 + CO2 + H2O.
Стехиометрическое значение Δχ находим из схемы, отвечающей полному разложению гидрокарбоната натрия:
Для расчета Δχ оказывается достаточно записать только одно уравнение материального баланса (хотя всего их могло быть четыре):
NaHCO3 (α) |
m1 |
|
|
|
− 2 |
χ Mα = |
0 |
||
откуда |
|
|
|
|
|
|
|
|
|
Dχ = |
m1 |
|
= |
4.00 г |
|
= 0.0238 моль. |
|||
2 M |
|
2×84 г / моль |
|||||||
|
|
α |
|
|
|||||
Фактическое изменение химической переменной Δχф находим из другой схемы материального баланса:
Система уравнений материального баланса в этом случае тоже могла быть представлена четырьмя уравнениями, но для расчета потребуются только два из них:
NaHCO3 |
(α) |
m1 |
− 2 χф Mα = |
m2α |
Na2CO3 |
(β) |
|
− χф M β = |
m2β |

9
Поскольку сумма m2α + m2β приведена в условии, то можно
почленно сложить уравнения и получаем выражение с одной неизвестной:
|
m1 − χф (2Mα − M β )= m2 , |
||||
Dχф = |
m1 − m2 |
= |
(4.00 г − 3.00 г) |
|
= 0.0161моль, |
|
(2×84 -106)г / моль |
||||
|
2Mα - M β |
|
|||
и, наконец,
η = Dχχф = 00..02380161мольмоль = 0.676.
Ответ: η =67.6 %.
Установление состава смесей. |
Пусть |
смесь |
содержит |
n компонентов. Их массы обозначают |
m1 , m2 |
и т.д. |
Через них |
выражают массы или объемы продуктов химического превращения, пользуясь определением химической переменной. Получается система уравнений, которая далее решается.
Пример. При взаимодействии 3.34 г сплава железа и
алюминия с избытком раствора соляной кислоты выделилось 1.792 л газа (н. у.) Рассчитайте массы железа и алюминия в сплаве.
Решение. Уравнения реакций:
Fe + 2HCl → FeCl2 + H2, |
χ1 |
2Al + 6HCl → 2AlCl3 + 3H2. |
χ2 |
Пусть m1 −масса железа, m2 − масса алюминия. Тогда:
Dχ1 = |
|
m1 |
|
= |
|
DV1 |
|
|
|
|
|
= |
|
|
DV1 |
, |
|
|||
|
1×56 г / моль |
|
|
|
1×V |
m |
|
H2 |
|
1×22.4 л / моль |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Dχ2 = |
|
m2 |
|
= |
|
DV2 |
|
|
|
= |
|
|
DV2 |
|
|
, |
||||
|
|
|
|
|
|
|||||||||||||||
2×27 г / моль |
|
3×Vm |
|
H2 |
|
|
3×22.4 л / моль |
|||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
DV1 + DV2 = 2256.4 m1 + 6754.2 m2 = 1.792.
10
Принимая во внимание, что
m1 + m2 = 3.34 г ,
получаем систему уравнений относительно m1 и m2 . Решением системы находим, что m1 = 2.80 г и m2 = 0.54 г.
Ответ: 2.80 г железа и 0.54 г алюминия.
Полное изменение параметра состояния реагирующей системы и его применение в стехиометрических расчетах.
Рассмотрим процесс
ν A A +ν B B →νCC +ν D D,
для которого
χ = − |
ν |
nA = − |
ν |
nB |
= |
ν |
nC |
= |
ν |
nD . |
|
A |
B |
|
C |
|
D |
||||
|
|
|
|
|
|
|
Общее изменение количества вещества в этой системе равно сумме изменений количества вещества каждого из участников реакции
n = nA + nB + nC + nD .
Здесь nA и nB отрицательны, |
nC и nD положительны. |
Эти величины в отличие от |
масс реагирующих веществ, |
могут не компенсировать друг друга. Разность количеств вещества n продуктов реакции и реагентов в отличие от разности их масс m, является в общем случае ненулевой. Свяжем n с χ
следующим образом:
n = − χν Α − χν Β + χν C + χν D = = χ(−ν Α −ν B +νC +ν D ) = χ ν ,
где
ν = −ν Α −ν B +νC +ν D −
разность стехиометрических коэффициентов. Из последнего
выражения
