
Федеральное агентство по образованию
Нижегородский государственный университет
им. Н.И.Лобачевского
Химический факультет
Кафедра неорганической химии
Окислительно-восстановительные реакции
Отчёт по лабораторной работе
Преподаватель:
Р.М.Шапошников
Студенты группы 211 (II):
Т. Г. Огурцов,
О. А. Шилягина
Нижний Новгород, 2008
Задания лабораторной работы:
Окислительно – восстановительные реакции с участием перманганата калия, бихромата калия, серной и азотной кислот;
Реакции внутримолекулярного окисления – восстановления и диспропорционирования;
Окисление серы азотной кислотой.
Окислительно – восстановительные реакции с участием перманганата калия, серной и азотной кислот
Цель работы: провести окислительно – восстановительные реакции с участием перманганата калия, серной и азотной кислот.
Оборудование и реактивы: пробирки, пипетки, резиновая груша, стеклянные стаканы, фильтровальная бумага, спиртовка, дистиллированная вода, кристаллический перманганат калия (KMnO4), концентрированные соляная, серная, азотная кислоты (HCl, H2SO4, HNO3), иодид калия (KI), 0,1Н раствор перманганата калия (KMnO4), 10% и 0,1Н раствор серной кислоты (H2SO4), 10% и концентрированный раствор гидроксида натрия (NaOH), раствор сульфита натрия (Na2SO3), гранулы цинка (Zn), медная стружка (Cu), дихромат аммония ((NH4)2Cr2O7), нитрит натрия (NaNO2), сульфат марганца (MnSO4).
Теоретическая часть:
Протекание химических реакций в целом обусловлено обменом частицами между реагирующими веществами. Часто обмен сопровождается переходом электронов от одной частицы к другой.Процесс потери электронов частицей называют окислением, а процесс приобретения электронов – восстановлением. Окисление и восстановление протекают одновременно, поэтому взаимодействия, сопровождающиеся переходом электронов от одних частиц к другим, называют окислительно-восстановительными реакциями.
Протекание окислительно-восстановительных реакций сопровождается изменением степеней окисления элементов участвующих в реакции веществ. При восстановлении степень окисления элемента уменьшается, при окислении – увеличивается. Вещество, в состав которого входит элемент, понижающий степень окисления, называют окислителем, вещество, в состав которого входит элемент, повышающий степень окисления, называют восстановителем.
Практическая часть:
В препараторской насыпали в пробирку небольшое количество кристаллического перманганата калия;
Добавили несколько капель концентрированной соляной кислоты (наблюдаем шипение и выделение газа - хлора);
2 КMnO4
+ 16HCl 5Cl2↑
+ 2KCl
+ 2MnCl2
+ 8H2O
КMnO4
+ 16HCl 5Cl2↑
+ 2KCl
+ 2MnCl2
+ 8H2O
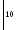
(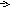 MnO4)-
+ 8H+
+ 5
MnO4)-
+ 8H+
+ 5![]() Mn2+
+ 4H2O
Mn2+
+ 4H2O
2 Cl-
- 2
Cl-
- 2![]() 2Cl0
2Cl0
2 (MnO4)-
+ 16H+
+ 10Cl- 2
Mn2+
+ 8H2O
+ 10Cl0
(MnO4)-
+ 16H+
+ 10Cl- 2
Mn2+
+ 8H2O
+ 10Cl0
Поднесли к отверстию пробирки смоченную раствором йодида калия фильтровальную бумагу. Выделяющийся из пробирки хлор замещал йодид ион в растворе йодида калия. В результате этого мы наблюдали потемнение фильтровальной бумаги вокруг отверстия пробирки, связанное с выделение йода;
2 KI
+ Cl2
2KCl + I2↓
KI
+ Cl2
2KCl + I2↓
В 3 пробирки налили по 1 мл. 1Н раствора перманганата калия;
В первую пробирку добавили 1 мл. 10% раствор серной кислоты;
Во вторую пробирку 10% раствор гидроксида натрия;
В каждую из трёх пробирок добавили 1Н раствор сульфида натрия;
В первой пробирке (кислая среда):
2 КMnO4
+ 3H2SO4
+ 5Na2SO3 K2SO4
+ 2MnSO4
+ 5Na2SO4
+ 3H2O
КMnO4
+ 3H2SO4
+ 5Na2SO3 K2SO4
+ 2MnSO4
+ 5Na2SO4
+ 3H2O
(
 MnO4)-
+ 8H+
+ 5
MnO4)-
+ 8H+
+ 5![]() Mn2+
+ 4H2O
Mn2+
+ 4H2O
S O32-
+ H2O
- 2
O32-
+ H2O
- 2![]() SO42-
+ 2H+
SO42-
+ 2H+
2 (MnO4)-
+ 16H+
+ 5SO32-
+ 5H2O 2
Mn2+
+ 8H2O
+ 5SO42-
+ 10H+
(MnO4)-
+ 16H+
+ 5SO32-
+ 5H2O 2
Mn2+
+ 8H2O
+ 5SO42-
+ 10H+
Наблюдаем обесцвечение раствора;
Во второй пробирке (щелочная среда):
2 КMnO4
+ 2NaOH + Na2SO3
Na2
MnO4
+ K2MnO4
+ Na2SO4
+ H2O
КMnO4
+ 2NaOH + Na2SO3
Na2
MnO4
+ K2MnO4
+ Na2SO4
+ H2O
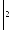
( MnO4)-
+ 1
MnO4)-
+ 1![]() (MnO4)2-
(MnO4)2-
S O32-
+ 2OH-
- 2
O32-
+ 2OH-
- 2![]() SO42-
+ H2O
SO42-
+ H2O
2 (MnO4)-
+ SO32-
+ 2OH- 2(MnO4)2-
+ SO42-
+ H2O
(MnO4)-
+ SO32-
+ 2OH- 2(MnO4)2-
+ SO42-
+ H2O
Наблюдаем появление светло – зелёной окраски, из – за появление иона (MnO4)2-;
В третей пробирке (нейтральная среда):
2 КMnO4
+ 3Na2SO3
+ Н2О
2MnO2↓
+ 3Na2SO4
+ 2KOH
КMnO4
+ 3Na2SO3
+ Н2О
2MnO2↓
+ 3Na2SO4
+ 2KOH
(
 MnO4)-
+ 2H2O
+3
MnO4)-
+ 2H2O
+3![]() (MnO2)0
+ 4OH-
(MnO2)0
+ 4OH-
S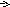 O32-
+ 2OH-
- 2
O32-
+ 2OH-
- 2![]() SO42-
+ H2O
SO42-
+ H2O
2 (MnO4)-
+ 4H2O
+ 3SO32-
+ 6OH-
2(MnO2)0
+ 8OH-
+ 3SO42-
+ 3H2O
(MnO4)-
+ 4H2O
+ 3SO32-
+ 6OH-
2(MnO2)0
+ 8OH-
+ 3SO42-
+ 3H2O
Цвет раствора стал бурым, благодаря появлению оксида марганца (IV);
Вывод:
Перманганат – ион проявляет более высокую окислительно – восстановительную активность в кислой среде.
Налили в две пробирки по 1 мл. 0,01Н раствора перманганата калия и добавили несколько капель 10% раствора серной кислоты;
В первую пробирку добавили добавили 1Н раствор сульфита натрия, а во вторую 1Н раствор йодида калия до появления устойчивой окраски;
Первая пробирка:
2 КMnO4
+ 3H2SO4
+ 5Na2SO3 K2SO4
+ 2MnSO4
+ 5Na2SO4
+ 3H2O
КMnO4
+ 3H2SO4
+ 5Na2SO3 K2SO4
+ 2MnSO4
+ 5Na2SO4
+ 3H2O
(
 MnO4)-
+ 8H+
+ 5
MnO4)-
+ 8H+
+ 5![]() Mn2+
+ 4H2O
Mn2+
+ 4H2O
S O32-
+ H2O
- 2
O32-
+ H2O
- 2![]() SO42-
+ 2H+
SO42-
+ 2H+
2 (MnO4)-
+ 16H+
+ 5SO32-
+ 5H2O 2
Mn2+
+ 8H2O
+ 5SO42-
+ 10H+
(MnO4)-
+ 16H+
+ 5SO32-
+ 5H2O 2
Mn2+
+ 8H2O
+ 5SO42-
+ 10H+
Раствор обесцветился;
Вторая пробирка:
2 КMnO4
+ 8H2SO4
+ 10KI 5I2↓
+ 6K2SO4
+ 2MnSO4
+ 8H2O
КMnO4
+ 8H2SO4
+ 10KI 5I2↓
+ 6K2SO4
+ 2MnSO4
+ 8H2O
(
 MnO4)-
+ 8H+
+ 5
MnO4)-
+ 8H+
+ 5![]() Mn2+
+ 4H2O
Mn2+
+ 4H2O
2 I-
- 2
I-
- 2![]() 2I0
2I0
2 (MnO4)-
+ 16H+
+ 10I-
2Mn2+
+ 8H2O
+ 10I0
(MnO4)-
+ 16H+
+ 10I-
2Mn2+
+ 8H2O
+ 10I0
Выделяющийся йод образовывал с избытком иодида калия йодную воду, вследствие чего раствор приобрёл коричневую окраску;
В одну пробирку положили несколько гранул цинка, а во вторую – немного медной стружки;
Прилили в обе пробирки 10% раствор серной кислоты;
Z n
+ H2SO4
ZnSO4
+ H2↑
– выделяется водород;
n
+ H2SO4
ZnSO4
+ H2↑
– выделяется водород;
С u
+ H2SO4
Реакция
не идёт, так как медь стоит в ряду
активности металлов правее водорода и
не способна вытеснить водород из кислоты;
u
+ H2SO4
Реакция
не идёт, так как медь стоит в ряду
активности металлов правее водорода и
не способна вытеснить водород из кислоты;
Повторили опыт с концентрированной серной кислотой;
Z n
+ 2H2SO4
ZnSO4
+ SO2
↑
+
2H2O
n
+ 2H2SO4
ZnSO4
+ SO2
↑
+
2H2O
Z
 n0
- 2
n0
- 2![]() Zn2+
Zn2+
S O42-
+ 4H+
+ 2
O42-
+ 4H+
+ 2![]() (SO2)0
+ 2H2O
(SO2)0
+ 2H2O
Z n0
+ SO42-
+ 4H+
Zn2+
+ (SO2)0
+ 2H2O
n0
+ SO42-
+ 4H+
Zn2+
+ (SO2)0
+ 2H2O
C u
+ 2H2SO4
CuSO4
+ SO2
↑
+
2H2O
u
+ 2H2SO4
CuSO4
+ SO2
↑
+
2H2O
C
 u0
- 2
u0
- 2![]() Cu2+
Cu2+
S O42-
+ 4H+
+ 2
O42-
+ 4H+
+ 2![]() (SO2)0
+ 2H2O
(SO2)0
+ 2H2O
C u0
+ SO42-
+ 4H+
Cu2+
+ (SO2)0
+ 2H2O
u0
+ SO42-
+ 4H+
Cu2+
+ (SO2)0
+ 2H2O
В обоих случаях наблюдаем выделение оксида серы (IV);
В две чистых пробирки поместили немного медных стружек;
В первую пробирку прилили немного концентрированной азотной кислоты, а во вторую немного разбавленной азотной кислоты;
С u
+ 4HNO3
(конц.)
Сu(NO3)2
+ 2NO2
↑ + 2H2O
– выделяется бурый газ NO2;
u
+ 4HNO3
(конц.)
Сu(NO3)2
+ 2NO2
↑ + 2H2O
– выделяется бурый газ NO2;
C
 u0
- 2
u0
- 2![]() Cu2+
Cu2+
( NO3)-
+ 2H+
+1
NO3)-
+ 2H+
+1![]() (NO2)0
+ H2O
(NO2)0
+ H2O
C u0
+ 2(NO3)-
+ 4H+
Cu2+
+ 2(NO2)0
+ 2H2O
u0
+ 2(NO3)-
+ 4H+
Cu2+
+ 2(NO2)0
+ 2H2O
3 Сu
+ 8HNO3
(разб.) 3Сu(NO3)2
+2NO
↑ + 4H2O
– выделяется бесцветный газ оксид азота
(II)
Сu
+ 8HNO3
(разб.) 3Сu(NO3)2
+2NO
↑ + 4H2O
– выделяется бесцветный газ оксид азота
(II)

C u0
- 2
u0
- 2![]() Cu2+
Cu2+
( NO3)-
+ 4H+
+3
NO3)-
+ 4H+
+3![]() (NO)0
+ 2H2O
(NO)0
+ 2H2O
3 Cu0
+ 2(NO3)-
+ 8H+
3Cu2+
+ 2(NO)0
+ 4H2O
Cu0
+ 2(NO3)-
+ 8H+
3Cu2+
+ 2(NO)0
+ 4H2O
Вывод:
Перманганат калия, серная и азотная кислоты проявляют сильные окислительные свойства, причём наиболее сильные окислительные свойства перманганат калия проявляет в кислой среде.
