
Теоретические основы химии для з.о.2006
.pdf
Концентрация ионов в водных растворах сильных электролитов рассчитывается по формуле
Сионов = aСn,
где a– степень электролитической диссоциации; С – концентрация электролита, моль/л; n – число ионов данного вида в одном моле электролита.
В случае слабых электролитов
Сион = aС.
В растворах слабых электролитов устанавливается равновесие между молекулами электролита и ионами, образовавшимися за счет диссоциации слабого бинарного электролита, например:
СН СООН |
СН СОО– + Н+. |
3 |
3 |
На основании закона действующих масс можно записать выражение константы равновесия:
|
CН+ CСН СОО− |
|
Kс = |
3 |
. |
CСН СООН |
||
|
3 |
|
Константу равновесия Kс в данном случае называют константой диссоциации и обозначают K. Константа диссоциации электролита связана со степенью диссоциации соотношением, которое является математическим выражением закона разбавления Оствальда:
K = |
α2C |
0 |
, |
(1) |
||
1 |
− α |
|||||
|
|
|
||||
где С0 – молярная концентрация растворенного электролита, моль/л. Выражение (1) применимо только для слабых электролитов. Этой
формулой следует пользоваться для расчетов в случаях, когда отноше-
ние С/K £ 102 (a ³ 0,1).
Если a << 1, то соотношение (1) упрощается:
K » a2С0.
K
Åñëè a << 1, òî a =  C0 .
C0 .
Константы диссоциации слабых кислот и оснований приведены в справочниках. Зная значение константы диссоциации и концентрацию растворенного электролита, можно вычислить степень диссоциации.
В неорганической химии чаще всего в качестве растворителя используется вода. Вода является слабым электролитом и диссоциирует с образованием ионов Н+ и ОН–:
Н2О Н+ + ОН–.
Для чистой воды и разбавленных водных растворов электролитов произведение концентраций ионов водорода и гидроксид-ионов – величина постоянная, которая называется ионным произведением воды:
Kw = CH+ COH− = 10−14 (22°C).
Для водных растворов важное значение имеет определение характера среды (кислая или щелочная). Характер среды определяется соотношением концентрации ионов Н+ и ОН–. Для этого используют водородный показатель рН – отрицательный десятичный логарифм молярной концентрации ионов водорода в растворе:
pH = -lgCH+
или гидроксильный показатель рОН:
pOH = -lgCOH− .
рН + рОН = 14.
Для чистой воды рН = 7. Растворы, для которых рН » 7, называют нейтральными. Если рН< 7, то раствор кислый, а если рН> 7 – щелочной.
ПРИМЕР 1. Вычислить концентрацию ионов Н+, ОН– и рН раство-
ра 0,1 н. H2SO4.
Решение. H SO – сильная кислота: H SO = |
2H+ + SO2−. |
|||||||||||
2 |
4 |
|
|
|
|
|
|
|
2 |
4 |
|
4 |
Для сильных электролитов a = 1. В реакции диссоциации образуют- |
||||||||||||
ся 2 иона Н+. Молярная концентрация H SO в два раза меньше ее нор- |
||||||||||||
|
|
|
|
|
|
|
|
|
2 |
4 |
|
|
мальной концентрации и равна 0,05 моль/л. |
|
|
||||||||||
Концентрация ионов водорода |
|
|
|
|
||||||||
CH+ = anС0 = 1 × 2 × С0 = 2С0 = 2 × 0,05 = 0,1 моль/л; |
||||||||||||
C |
|
− |
= |
Kw |
= |
10−14 |
=1×10 |
−13 |
моль/л; |
|||
OH |
C |
+ |
|
0,1 |
|
|||||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
H
рН = -lgCH+ = –lg(0,1) = 1. + –
ПРИМЕР 2. Вычислить концентрацию ионов Н , ОН и рН 0,1 М раствора HNO2.
Решение. Запишем уравнение диссоциации кислоты:
60 |
61 |

HNO |
H+ + NO−. |
2 |
2 |
Поскольку кислота слабая, степень диссоциации находим по формуле
|
|
K |
|
|
4×10−4 |
|
|
|
|
a = |
; a = |
|
= 40×10−4 |
= 6,32×10−2 , |
|||||
C0 |
0,1 |
|
|||||||
|
|
|
|
|
|
|
|
||
где KHNO2 = 4 ×10−4.
При диссоциации кислоты образуются ионы Н+, концентрацию которых вычислим по формуле
CH+ = aС0 = 6,32 × 10–2 × 0,1 = 6,32 × 10–3 моль/л.
Концентрацию ионов ОН– определим из выражения ионного произведения воды:
C |
OH− |
= |
Kw |
= |
10−14 |
=1,58×10 |
−10 |
моль/л. |
|
C |
+ |
6,32×10−3 |
|
||||||
|
|
|
|
|
|
||||
|
|
|
H |
|
|
|
|
|
|
рН = -lgCH+ = –lg(6,32 ×10–3) = 3 – lg(6,32) = 3 – 0,80 = 2,20.
ПРИМЕР 3. Определить степень диссоциации угольной кислоты в 0,01 М растворе, учитывая только первую ступень диссоциации, если рН этого раствора равен 4,17.
Решение. Уравнение диссоциации кислоты: |
|
|||||||||||
|
|
|
|
H |
CO |
3 |
H+ + HCO− (I ступень). |
|
||||
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
Найдем концентрацию ионов Н+. Для этого найдем антилогарифм |
||||||||||||
числа –4,17, поскольку рН = -lgCH+ , то |
|
|
||||||||||
|
|
C |
H |
+ = 10−pH = 10−4,17 = 6,76×10−5 моль/л. |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Степень диссоциации определим следующим образом: |
||||||||||||
C |
|
+ = aС Þ a = |
СН+ |
= |
6,76×10−5 |
= 6,76 ×10 |
−3 |
|||||
H |
|
|
. |
|||||||||
|
|
|||||||||||
|
|
|
|
0 |
|
|
С0 |
|
0,01 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
В растворах слабых электролитов многоосновных кислот и многокислотных оснований диссоциация преимущественно осуществляется по первой ступени и количество ионов Н+ или ОН– определяется этим процессом. Количеством ионов, образующихся при последующих ступенях диссоциации пренебрегают, так как оно незначительно.
ПРИМЕР 4. Вычислить рН 0,1 М НСООН, к 1 л которого добавлено 0,1 моля НСООNa.
Решение. Запишем уравнения диссоциации слабого и сильного электролитов:
|
|
|
С |
+ С |
− |
|
||
НСООН Н+ + НСОО–; |
K |
= |
|
Н |
НСОО |
|
= 1,8 |
× 10–4. |
|
СНСООН |
|
||||||
|
д |
|
|
|
|
|
||
|
|
|
|
|
|
|
||
НСООNa ® Na+ + НСОО–; |
a = 1. |
|
|
|
|
|
||
Вклад в общую концентрацию формиат-ионов НСОО– в растворе процесса диссоциации кислоты очень мал (слабый электролит), поэто-
му CHCOO− определяется процессом диссоциации соли, которая относится к сильным электролитам и диссоциирует практически нацело:
= aCHCOONa = 0,1 моль/л.
Обозначим за х концентрацию ионов водорода в растворе:
CH+ = x, CHCOO− = 0,1 моль /л.
Равновесная концентрация кислоты за счет диссоциации изменится очень незначительно, поэтому принимаем ее равной начальной:
CНСООН = 0,1 моль/л.
Тогда |
|
|
|
|
|
|
|
K |
|
= |
С |
Н |
+ ×0,1 |
= 1,8 × 10–4; |
|
д |
|
0,1 |
|
||||
|
|
|
|
|
|||
CH+ = 1,8 × 10–4.
Водородный показатель
pH = -lgCH+ = –lg(1,8 ×10–4) = 4 – lg1,8 = 3,15.
Направление обменной реакции между двумя электролитами в растворе определяется возможностью образования между ионами:
1)малорастворимого соединения, выпадающего в виде осадка
(BaSO4, AgI, CaF2 и др.);
2)малодиссоциированного соединения (СН3СООН, NH4OH, H2S(p-р),
HClO и др.), иона (HCO3− , HS− , HPO24− ) или устойчивой комплексной частицы молекулы или иона ([SiF6]2–, [Ag(NH3)2]+, [Pt(NH3)2Cl2] и др.);
3) газа (СО2, H2S, NH3 и др.).
При записи молекулярно-ионных уравнений необходимо придерживаться следующих правил: а) сильные электролиты следует писать в виде ионов, входящих в их состав, поскольку именно в таком состоянии они находятся в растворе; б) малодиссоциированные соединения – мо-
62 |
63 |
лекулы и сложные ионы (в том числе и комплексные), а также малорастворимые соединения и газы следует записывать в недиссоциированном состоянии, в котором они присутствуют в растворе, независимо от того, являются они исходными реагентами или продуктами реакции.
Например:
1) молекулярное уравнение:
NaOH + HCl = NaCl + H2O;
сильн.эл. сильн.эл. сильн.эл. слаб.эл.
полное ионно-молекулярное уравнение:
Na+ + OH– + H+ + Cl– = Na+ + Cl– + H2O;
сокращенное ионно-молекулярное уравнение:
H+ + OH– = H2O. 2) молекулярное уравнение:
CuSO4 + H2S = CuS↓ + H2SO4;
сильн.эл. слаб.эл. нераст.соль сильн.эл.
полное ионно-молекулярное уравнение:
Cu2+ + SO24− + H2S = CuS ↓ + 2H+ + SO24− ;
сокращенное ионно-молекулярное уравнение: Cu2+ + H2S = CuS↓ + 2H+.
Контрольныезадания
201.Определить концентрацию ионов водорода и хлорид-ионов в
растворе, полученном при растворении 2 мл 8%-ного раствора соляной кислоты (ρ = 1,039 г/мл) водой до 2 л.
202.Для приготовления 200 мл раствора уксусной кислоты использовали 0,06 г кислоты. Определить концентрации ионов водорода и аце- тат-ионов в полученном растворе.
203.Рассчитать степень диссоциации синильной кислоты в 1 М; 0,01 М и 0,001 М растворах.
204.Вычислить концентрацию ионов водорода и гидроксид-ионов в 0,01%-ном растворе гидроксида бария (ρ = 1 г/мл), считая, что гидроксид бария диссоциирует нацело в одну ступень.
205.Вычислить концентрацию ионов водорода в 0,1 М растворе уксусной кислоты. Как изменится рН раствора при добавлении к его 500 мл 4 г ацетата натрия?
206.Определить рН раствора, полученного при разбавлении 20 мл 36%-ного раствора гидроксида калия (ρ = 1,356 г/мл) до 500 мл водой,
считая, чтогидроксид натрия в водном растворе диссоциирует полностью. 207. Сколько граммов цианида калия следует добавить к 500 мл 0,1 М раствора циановодородной кислоты, чтобы рН раствора стал равным 7? 208. К 500мл 0,1М раствора уксусной кислотыдобавили равный объем
0,1 М раствора ацетата натрия. Вычислить рН полученного раствора. 209. Вычислить концентрацию цианид-ионов в 0,01 М растворе си-
нильной кислоты. Как изменится концентрация этих же ионов, если рН раствора HCN будет равен 3?
210. При 20°С растворимость СО2 в воде составляет 1,7 г/л. Вычислить рН насыщенного при этой температуре раствора диоксида углерода, учитывая только первую ступень диссоциации.
211. Сколько граммов гидроксида калия содержится в 1 л раствора, рН которого составляет 12?
212. Вычислить константу диссоциации слабой кислоты, если рН 0,01 М ее раствора составляет 4,6.
213. К 10 мл 0,05 М раствора NH4OHприбавили 5 мл 0,05 М раствора HCl. Вычислить рН полученного раствора.
214. К 20 мл 0,4 М раствора СН3СООНприлили 10 мл 0,4 н. раствора NаОН. Вычислить рН раствора.
215. Раствор 0,0128 М уксусной кислоты имеет значение рН 3,3. Вычислить константу диссоциации уксусной кислоты.
216. Определить концентрацию ионов ОН– в растворе, если известно, что в 500 мл его содержится 0,098 г серной кислоты. Диссоциацию кислоты считать полной.
217. Как изменится концентрация ионов ОН– в 0,02 М растворе гидроксида аммония, если к 2 л этого раствора добавить 1,07 г NH4Cl?
218. Сколько молей ацетата натрия следует добавить к 1 л 0,01 М раствора уксусной кислоты, чтобы изменить рН раствора на единицу?
219. Для процесса диссоциации слабой одноосновной кислоты G2980 = 34,218 кДж. Определить значение константы диссоциации этого
электролита. Сделать вывод относительно его силы.
220.Сколько миллилитров 2 М уксусной кислоты нужно растворить
вводе, чтобы получить 1 л раствора с рН, равным трем?
Для заданий 221–235. Написать в молекулярной, ионно-молеку- лярной форме уравнения следующих реакций:
221.Pb(NO3)2 + KI →; NaOH + H2S →; H2SO4 + NaOH →.
222.HNO2 + Ba(OH)2 →; AgNO3 + BaCl2 →; CaCO3 + HCl →.
223.CaCl2 + H2SO4 →; AlCl3 + KOH →; NH4OH + H2SO4 →.
64 |
65 |
224.Na2CO3 + H2SO4 →; NH4Cl + KOH→; HCN + KOH →.
225.CaCO3 + HCl →; NaOH + H2SO4 →; Ca(OH)2 + CO2 →.
226.HCN + KOH →; BaCl2 + K2SO4 →; K2S + HCl →.
227.CH3COOH + Mg→; (NH4)2SO4 + NaOH→; AgNO3 + Na2CO3 →.
228.CH3COONa + HCl →; NH4OH+ HNO3 →; Ba(OH)2 + HCl →.
229.Al(OH)3 + KOH→; KHCO3 + H2SO4 →; Cr2(SO4)3 + KOH→.
230.Zn(OH)2 + NaOH →; KOH + H2S →; AgNO3 + K2CrO4 →.
231.NaHCO3 + HCl →; FeCl3 + NaOH →; NH4OH + H2SO4 →.
232.Zn(NO3)2 + KOH →; AgNO3 + K3PO4 →; HNO2 + NaOH →.
233.NaOH + SO2 →; KCN + HNO3 →; CaCl2 + H3PO4 →.
234.HCOOH + KOH →; Na2SO3 + HCl →; AgNO3 + KI →.
235.NH4OH + CH3COOH →; NaHS + H2SO4 →; CuSO4 + Na2S →.
Для заданий236–240. Написать в молекулярной форме уравнения ре-
акций, соответствующих следующим ионно-молекулярным уравнениям:
236.Ca2+ + CO32− = CaCO3;Al3+ + 3OH– = Al(OH)3; H+ + OH– = H2O.
237.NH+4 + OH– = NH3 + H2O; Fe3+ + 3OH– = Fe(OH)3; CO32− + 2H+ = CO2 + H2O.
238.Al(OH)3 + 3H+ = Al3+ + 3H2O; CH3COO– + H+ = CH3COOH; Ag+ + Cl– = AgCl.
239.Ag+ + I– = AgI; Cu(OH)2 + 2H+ = Cu2+ + 2H2O; 2H+ + S2– = H2S.
240.Ba2+ + SO24− = BaSO4; H+ + NO−2 = HNO2; Fe(OH)2 + 2H+ = Fe2+ + 2H2O.
8.ГИДРОЛИЗ
8.1.Гидролиз солей
Обменное взаимодействие соли с водой, приводящее к образованию слабого электролита, называется гидролизом солей.
Гидролизуподвергаются растворимые соли, образованные: а) слабой кислотой и сильным основанием; б) слабым основанием и сильной кислотой; в) слабым основанием и слабой кислотой.
В гидролизе участвуют катионы слабого основания и анионы слабой кислоты, в большинстве случаев гидролиз – процесс обратимый, протекает ступенчато. Гидролиз приводит к изменению рН среды.
Уравнения реакций гидролиза составляют в молекулярной и ионномолекулярной формах.
Соли, образованные слабым основанием и сильной кислотой, и соли, образованные слабой кислотой и сильным основанием, в обычных условиях подвергаются гидролизу в незначительной степени. Вторая и последующие ступени, если они возможны, почти не протекают, поэтому при рассмотрении процесса гидролиза вышеназванных солей ограничиваются первой ступенью.
Например, гидролиз соли Na2CO3 в растворе:
Na2CO3 |
|
NaOH – сильное основание |
|
→ Na+ |
+ CO32− |
||
|
|
H2CO3 – слабая кислота |
|
|
|
||
гидролизу подвергается анион слабой кислоты: |
|
|
|||||
|
|
CO2− |
+ H O |
HCO− + ОН– (І ступень); |
|
||
|
3 |
2 |
3 |
|
|
|
|
в молекулярной форме: |
|
|
|
|
|||
|
|
Na2CO3 + H2O NaНCO3 + NaОН; |
|
||||
в растворе соли избыток ионов ОН–, среда щелочная, рН > 7. |
|||||||
Гидролиз соли ZnSO4 в растворе: |
|
|
|||||
ZnSO4 |
|
Zn(OH)2 – слабое основание |
|
→ Zn2+ |
+ SO2− |
||
гидролизу |
H2SO4 – сильная кислота |
|
|
4 |
|||
подвергается катион слабого основания: |
|
||||||
|
|
Zn2+ + H O |
ZnОН+ + Н+ (І ступень); |
|
|||
|
|
|
2 |
|
|
|
|
в молекулярной форме: |
|
|
|
|
|||
|
2ZnSO4 + 2H2O |
(ZnОН)2SO4 + H2SO4; |
|
||||
66 |
67 |

в растворе соли избыток ионов Н+, среда кислая, рН < 7.
Гидролиз соли, образованной слабым основанием и слабой кислотой, протекает, как правило, до конца; в результате образуются слабое основание и слабая кислота:
Al2S3 |
Al(OH)3 – слабое основание |
→ 2Al3+ + 3S2– |
|
H2S – слабая кислота |
|
Гидролизу подвергаются катионы слабого основания и анионы слабой кислоты:
Al |
3+ |
+ H2O « AlOH |
2+ |
|
|
+ ü |
|
|||
|
|
|
+ H ï |
(І ступень) |
||||||
2− |
+ H |
− |
+ |
OH |
− |
ý |
||||
S |
|
O « HS |
|
ï |
|
|||||
|
|
|
2 |
|
|
|
|
|
þ |
|
Образующиеся ионы Н+ и ОН– нейтрализуют друг друга, что вызывает смещение равновесия в сторону усиления гидролиза. Вследствие этого становится возможным протекание следующих ступеней гидролиза:
AlOH |
2+ |
+ H2O « |
+ |
+ ü |
|
|
Al(OH)2 |
+ H ï |
|||
HS− + H |
O « H S + OH− |
ý (II ступень) |
|||
ï |
|||||
|
|
2 |
2 |
|
þ |
По указанной выше причине протекет и третья ступень гидролиза:
Al(OH)+ + H O |
Al(OH) |
3 |
+ Н+ (III ступень). |
|||
2 |
2 |
|
|
|
|
|
Суммарное ионно-молекулярное уравнение имеет вид |
||||||
2Al3+ + 3S2– + 6H O |
2Al(OH) + 3H S, |
|||||
или в молекулярном виде |
2 |
|
|
3 |
2 |
|
|
|
|
|
|
||
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S. |
|
|||||
Таким образом, сульфид алюминия гидролизуется в растворе полностью и необратимо с образованием нерастворимого гидроксида Al(OH)3 и слабой кислоты H2S. рН раствора близок к 7. Характер среды (слабокислая или слабощелочная) определяется константой диссоциации слабого основания или слабой кислоты по первой ступени.
При сливании водных растворов двух солей, имеющих разную природу, т. е. одна образована слабой кислотой и сильным основанием, а другая – слабым основанием и сильной кислотой, происходит совместный гидролиз этих солей. Одна соль гидролизует по аниону, а другая – по катиону. Образующиеся в результате гидролиза ионы ОН– и Н+ нейтрализуют друг друга, и равновесие каждой из ступеней гидролиза смещается вправо, т. е. гидролиз усиливается и в некоторых случаях идет до конца, например:
Al2(SO4)3 + 3Na2SO3 + 6H2O = 2Al(OH)3 + 3Н2SO3 + 3Na2SO4;
в ионно-молекулярной форме уравнение гидролиза имеет вид
2Al3+ + 3SO32− + 6H2O = 2Al(OH)3 + 3Н2SО3.
8.2. Количественныехарактеристикипроцессагидролизасоли
Количественными характеристиками процесса гидролиза являются степень гидролиза (b) и константа гидролиза (Kг).
Степень гидролиза (β) – отношение количества прогидролизовавшей соли к общему количеству соли в растворе:
β = Cгидр .
С0
Константа гидролиза – константа равновесия процесса гидролиза. Степень гидролиза (b) связана с константой гидролиза соли соот-
ношением
K= β2Cсоли .
г1- β
Если b << 1, то равенство упрощается:
Kг = b2Ссоли,
тогда
|
|
|
|
|
b = |
Kг |
. |
|
|
|
|
|
||
|
С |
|
|
|
|
соли |
C |
|
|
|
|
|
2 |
|
Упрощенной формулой нельзя пользоваться, если |
|
³10 . |
||
K |
||||
На величинустепени гидролиза соли, кроме химической природы, влияют температура, концентрация соли и присутствие ионов Н+ или ОН–.
Рассмотрим влияние указанных факторов на глубину протекания
гидролиза на примере гидролиза соли Sn(NO3)2. |
|
Запишем уравнение гидролиза соли, образованной слабым основа- |
|
нием и сильной кислотой: |
|
Sn(NO3)2 + H2O |
SnOHNO3 + HNO3; |
Sn2+ + H O |
SnOH+ + H+. |
2 |
|
Чтобы подавить гидролиз (уменьшить степень гидролиза) следует: а) охладить раствор; б) увеличить концентрацию соли в растворе;
68 |
69 |
в) подкислить раствор, т. е. ввести ионы Н+, одноименные образующимся при гидролизе.
Чтобы усилить гидролиз этой соли, т. е. увеличить степень гидролиза следует:
а) повысить температуру; б) разбавить раствор;
в) ввести в раствор ионы ОН–, которые нейтрализуют ионы Н+, образуя воду, т. е. подщелочить раствор.
1) Для средних солей, образованных слабой кислотой и сильным основанием, константа гидролиза рассчитывается по формуле
Kг = |
Kw |
. |
(Kw |
= 10 |
–14 |
– ионное произведение воды). |
|||||
Kд. к-ты по посл.ст. |
|||||||||||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||
Например: |
|
|
|
|
|
|
|
|
|
||
|
Na2SO3 + H2O |
|
NaHSO3 + NaOH; |
||||||||
|
SO2− + H O |
|
HSO− + OH–; |
||||||||
|
3 |
|
2 |
|
|
|
|
3 |
|
|
|
|
|
|
Kг |
= |
|
Kw |
|
|
. |
||
|
|
|
K2 (H SO |
) |
|||||||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
2 |
3 |
|
|
|
2) Для солей, образованных слабым основанием и сильной кислотой, константа гидролиза определяется по формуле
Kг |
= |
|
Kw |
|
. |
|
Kд. осн. по посл.ст. |
||||||
Например: |
|
|
||||
|
|
|
|
|
||
Ni(NO3)2 + H2O |
NiOHNO3 + HNO3; |
|||||
Ni2+ + H O |
|
NiOH+ + H+; |
|
|||
2 |
|
|
|
|
|
|
|
Kг = |
Kw |
. |
|
||
|
K2 (Ni(OH)2 ) |
|
||||
|
|
|
|
|
||
3) Для солей, образованных слабой кислотой и слабым основанием, константа гидролиза вычисляется по формуле
Kг = |
Kw |
. |
||
Kдис. к-ты |
Kдис. осн |
|||
|
|
|||
Например:
СН3СООNH3 + H2O СН3СООH+ NH4OH;
Kг = |
|
Kw |
|
. |
KCH COOH KNH |
|
|||
|
OH |
|||
|
3 |
4 |
|
|
Рассмотрим примеры задач, связанных с расчетами характеристик процессов гидролиза.
ПРИМЕР 1. Вычислить константу гидролиза, степень гидролиза и рН 0,1 М раствора Na2SO3.
Решение.
Na2SO3 |
|
NaOH – сильное основание |
|
® 2Na+ + SO32− |
||||||||||||||||
|
|
|
H2SO3 – слабая кислота |
|
|
|||||||||||||||
Гидролизу подвергается анион слабой кислоты: |
||||||||||||||||||||
|
|
SO2− |
+ H O |
|
|
HSO− |
+ ОН–; рН > 7; |
|||||||||||||
|
|
|
|
3 |
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
||
в молекулярной форме: |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
Na2SO3 + H2O |
|
|
|
NaНSO3 + NaOH. |
||||||||||||||
Рассчитываем константу гидролиза: |
|
|
|
|||||||||||||||||
|
|
Kг |
= |
|
K |
w |
|
|
= |
|
10−14 |
=1,61×10−7 |
||||||||
|
|
K2 (H |
|
|
|
|
|
6,2×10−8 |
||||||||||||
|
|
|
|
|
2 |
SO ) |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
(K2 (H SO ) = 6,2 × 10–8 |
берем из справочника). |
|
||||||||||||||||||
2 |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
1,61×10-7 |
|
|
|
|
|
||||
|
|
b = |
|
Kг |
|
|
= |
|
=1,27 ×10 |
−3 |
||||||||||
|
|
|
|
|
|
|
|
|
|
. |
||||||||||
|
|
|
Ссоли |
|
|
|
|
0,1 |
|
|||||||||||
Для определения рН раствора нужно вычислить равновесную концентрацию ионов ОН– в растворе, образующихся в результате гидролиза
Na2SO3:
COH− = bC0 , или COH− = 
 KгС0 .
KгС0 .
COH− = 
 1,61×10−7 × 0,1 = 1,27 ×10−4 моль/л,
1,61×10−7 × 0,1 = 1,27 ×10−4 моль/л,
тогда
pOH = -lgCOH− = –lg(1,27 × 10–4) = –lg(1,27) – lg(10–4) = –0,10 + 4 = 3,90;
рН = 14 – рОН= 14 – 3,90 = 10,10.
ПРИМЕР 2. В растворе соли NH4Сl pH = 5,13 рассчитать молярную концентрацию соли, степень и константу гидролиза.
Решение. Запишем диссоциацию соли:
70 |
71 |
NH4OH – слабое основание HСl – сильная кислота
Гидролизу подвергается катион слабого основания:
|
|
|
|
NH+ |
+ H O NH OH + H+; |
|
|
||||||||||||||
|
|
|
|
|
|
4 |
|
|
|
2 |
|
|
|
|
4 |
|
|
|
|
||
в молекулярной форме: |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
NH4Сl + H2O NH4OH + HСl. |
|
|
|||||||||||||||||
Рассчитываем константу гидролиза: |
|
|
|
||||||||||||||||||
Kг = |
|
|
|
K |
w |
|
|
|
= |
|
10−14 |
= 5,56×10−10 |
|
||||||||
|
K |
д (NH4OH) |
1,8 |
×10−5 |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
(Kд NH4OH = 1,8 × 10–5 берем из справочника). |
|
|
|||||||||||||||||||
Используя формулу CH+ |
= |
KгСсоли |
, найдем концентрацию соли, |
||||||||||||||||||
однако предварительно по значению рН определим C |
H |
+ . |
|||||||||||||||||||
C |
H |
+ =10−pH =10−5,13 = 7,4×10−6 моль/л, |
|
||||||||||||||||||
тогда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С2 + |
|
|
(7,4×10−6 )2 |
|
|
|
|||||||||||
Ссоли |
= |
= |
|
» 0,1 моль/л. |
|
||||||||||||||||
|
Н |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
Kг |
|
|
|
5,56×10−10 |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Степень гидролиза можно рассчитать исходя из формул:
β = |
|
K |
г |
, или |
β = |
С |
Н |
+ |
. |
b = |
7,4×10−6 |
= 7,4×10 |
−5 |
Ссоли |
Ссоли |
0,1 |
. |
||||||||||
Контрольныезадания
Для заданий 241–257. Для солей, подвергающихся гидролизу, записать уравнения реакций гидролиза в ионно-молекулярной и молекулярной формах, указать характер среды:
241.Фторид натрия, сульфат магния, нитрат бария, сульфит калия, хлорид железа (III).
242.Фосфат натрия, хлорид меди (II), нитрит натрия, сульфат калия, ацетат магния, сульфат алюминия.
243.Нитрат железа (III), перхлорат калия, сульфит натрия, сульфид алюминия, сульфат цинка, хлорит натрия.
244.Хлорид стронция, гипохлорит натрия, нитрат алюминия, сульфит хрома (III), силикат калия, сульфат никеля (II).
245.Карбонат калия, хлорид железа (III), сульфат натрия, хлорид цинка, цианид натрия.
246.Хлорид алюминия, сульфид калия, сульфат никеля, перхлорат калия, нитрат олова (II).
247.Сульфат железа (III), нитрат свинца (II), карбонат рубидия, хлорат натрия, силикат калия.
248.Ацетат калия, сульфат цинка, нитрат алюминия, сульфат рубидия, сульфид натрия.
249.Фосфат натрия, сульфатмеди(II), нитраткалия, хлорид железа (III), гипохлорит натрия.
250.Сульфит натрия, нитрат меди (II), гипохлорит калия, перманганат натрия, нитрат бария.
251.Цианид цезия, ортофосфат калия, перхлорат калия, хлорид аммония, хлорид меди (II).
252.Сульфаткалия, сульфатаммония, нитритбария, сульфатжелеза (II), сульфид натрия.
253.Селенид натрия, хлорид железа (II), нитрат железа (III), нитрат рубидия, нитрит калия.
254.Сульфит калия, цианид калия, сульфат цинка, нитрат цезия, ортофосфат калия.
255.Хлорид хрома (III), сульфат аммония, сульфид калия, сульфат калия, силикат натрия.
256.Нитрат цезия, хлорат аммония, нитрат марганца (II), ортоарсенат калия, карбонат рубидия.
257.Нитрит цезия, нитрат кальция, ацетат аммония, сульфат железа (II), селенит калия.
258.К раствору FeCl3 добавили следующие вещества: a) HCI; б) KОН; в) ZnCl2; г) Na2СО3. В каких случаях гидролиз хлорида железа (III) усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей.
259.При смешивании растворов AlCl3 и Na2CO3 каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Записать уравнения реакции в молекулярной и ионно-молекулярной формах.
260.К раствору Na2СО3 добавили следующие вещества: a) HCl; б) NaOH; в) Cu(NO3)2; г) K2S. В каких случаях гидролиз карбоната натрия усилится? Почему? Составить ионно-молекулярные уравнения гидролиза соответствующих солей.
261.Вычислить константугидролиза, степень гидролиза и рН 0,5 н. раствора хлорида цинка.
72 |
73 |
262. Вычислить константу гидролиза, степень гидролиза 0,1 М ра- |
9. ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ |
|
||||
створа гипохлорита натрия. |
|
|
|
|
|
|
263. Вычислить константугидролиза, степень гидролиза и рН 0,06 М |
|
|
|
|
||
раствора силиката натрия. |
|
|
Способность вещества растворяться в определенном растворителе |
|||
264. Вычислить рН 0,1%-ного раствора сульфита калия, считая плот- |
называется растворимостью. Эта способность определяется природой |
|||||
ность раствора равной единице. |
|
|
растворяемого вещества и растворителя. Растворимость веществ глав- |
|||
265. Сколько граммов цианида калия следует растворить в 200 мл |
ным образом принято выражать в следующих единицах измерения – |
|||||
воды для приготовления раствора, рН которого равен 10? |
|
|
моль/л и г/л. Если вещество в растворителе больше растворяться не мо- |
|||
266. pН 0,1 М раствора соли щелочного металла составляет 8,11. |
жет, то это означает, что максимальная растворимость уже достигнута |
|||||
Вычислить константу диссоциации кислоты, образующей соль. |
|
|
и раствор стал насыщенным по отношению к растворяемому веществу. |
|||
267. В 100 мл воды растворили 0,106 г карбоната натрия. Вычислить |
Следующие порции растворяемого вещества будут выпадать в осадок. |
|||||
степень гидролиза соли и рН полученного раствора. |
|
|
В зависимости от природы растворяемого вещества и растворителя на- |
|||
268. Степень гидролиза соли щелочного металла и одноосновной |
сыщенным может быть раствор, в котором концентрация растворенно- |
|||||
кислоты в 0,1 М растворе составляет 0,002%. Вычислить константы гид- |
го вещества значительна, и такой, в котором его концентрация |
очень |
||||
ролиза и диссоциации кислоты, образующей соль. |
|
|
невелика. Вещества, концентрация насыщенных растворов которых зна- |
|||
269. Степень гидролиза хлорида цинка по первой ступени в 0,5 М |
чительна по величине, называют легкорастворимыми, и наоборот, ве- |
|||||
растворе равна 4 × 10–3. Вычислить на основании этих данных K |
д |
гидро- |
щества, концентрация насыщенных растворов которых очень мала, на- |
|||
ксида цинка по второй ступени. |
|
зывают труднорастворимыми. Как известно, в растворах электролитов |
||||
|
|
|||||
270. Сравнить степень гидролиза карбоната и гидрокарбоната на- |
параллельно с процессами растворения происходят процессы диссоци- |
|||||
трия в 0,01 М растворах. |
|
|
ации. В растворах труднорастворимых электролитов между веществом, |
|||
|
|
|
находящимся в твердой фазе (избыток по сравнению с тем количеством |
|||
|
|
|
растворяемого вещества, которое может раствориться при данных ус- |
|||
|
|
|
ловиях), и ионами, образовавшимися в результате диссоциации раство- |
|||
|
|
|
рившейся части вещества, устанавливается равновесие. |
|
||
|
|
|
Рассмотрим процесс растворения ортофосфата серебра, относяще- |
|||
|
|
|
гося к труднорастворимым соединениям. Равновесный процесс раство- |
|||
|
|
|
рения можно представить так: |
|
|
|
|
|
|
[Ag3PO4] + aq |
3{ Ag+}aq + { PO43− }aq |
(2) |
|
|
|
|
Выражение константы равновесия этого гетерогенного процесса |
|||
|
|
|
записывается на основании закона действующих масс и называется кон- |
|||
|
|
|
стантой растворимости или произведением растворимости (ПР): |
|
||
|
|
|
ПР = C3 + С |
3− . |
(3) |
|
|
|
|
|
Ag |
PO4 |
|
В выражение константы не входит концентрация твердого фосфата серебра, так как твердое вещество в гетерогенном процессе не является действующей массой. Для большей части малорастворимых веществ значения ПР в виде таблиц представлены в справочной литературе. Величина ПР зависит только от природы малорастворимого электроли-
74 |
75 |

та и температуры и не изменяется с изменением концентраций ионов в его насыщенном растворе.
Исходя из значения ПР и пользуясь уравнением (3), можно рассчитать растворимость (моль/л) труднорастворимого электролита и равновесные концентрации ионов, образовавшихся за счет его диссоциации.
ПРИМЕР 1. Вычислить массу хромата серебра, находящуюся в его насыщенном растворе объемом 1 л. ПРAg2CrO4 = 4,05 × 10–12.
Решение. Равновесие растворимости в насыщенном растворе
Ag2CrO4:
|
|
|
[Ag |
|
CrO ] + aq |
|
2{Ag+ } |
|
+ { CrO2− |
} . |
|
|||||||
|
|
|
2 |
|
|
|
|
4 |
|
|
|
aq |
4 |
aq |
|
|||
|
|
|
|
|
|
|
ПР = C2 |
+ C |
2− |
= 4,05×10−12. |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
Ag |
CrO |
|
|
|
|
|
|
|
Пусть С0 |
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
||
– концентрация насыщенного раствора Ag2CrO4. Соль |
||||||||||||||||||
Ag2CrO4 – сильный электролит, a » 1. |
|
|
|
|
|
|
||||||||||||
C |
Ag |
+ = С0α n = 2С0 (α = 1, n = 2); C |
|
2− = С0 (α = 1, n = 1). |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
CrO |
|
|
|
||
Получаем |
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
ПР = (2С )2С = 4C3 , |
|
|
|
|||||
откуда |
|
|
|
|
|
|
|
|
|
|
|
0 |
0 |
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
С |
|
|
= 3 |
|
4,05×10−12 |
= 1,004 × |
–4 |
|
|
|
|||||
|
|
|
0 |
|
|
4 |
|
10 моль/л. |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Поскольку С0 = |
|
m |
|
, |
|
|
|
|
|
|
|
|
||||||
|
MV |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
m(Ag CrO ) = С МV = 1,004 × 10–4 × 332 × 1 = 3,3 × 10–2 г. |
|||||||||||||||||
|
|
|
2 |
|
|
4 |
|
|
0 |
|
|
|
|
|
|
|
|
|
Полученные данные позволяют вычислить объем воды, необходи- |
||||||||||||||||||
мый для растворения определенной навески соли. |
|
|
|
|||||||||||||||
ПРИМЕР 2. Вычислить объем воды, необходимый для растворения |
||||||||||||||||||
50 мг хромата серебра. |
|
|
|
|
|
|
|
|
|
|
||||||||
Решение. Воспользуемся результатами, полученными в примере 1, |
||||||||||||||||||
согласно которым в 1 л насыщенного раствора Ag CrO |
содержится |
|||||||||||||||||
3,3 × 10–2 г Ag CrO . При такой низкой концентрации2соли4 |
объем насы- |
|||||||||||||||||
|
|
2 |
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
щенного раствора практически равен объему воды. Таким образом, |
||||||||||||||||||
|
|
|
в 1 л воды растворяется 3,3 × 10–2 ã Ag |
CrO , |
|
|||||||||||||
|
|
|
â õ ë âîäû |
|
|
|
|
|
2 |
|
4 |
|
||||||
|
|
|
» |
|
0,05 ã Ag2CrO4; |
|
||||||||||||
0,05 х = 0,033 = 1,52 л.
Равновесие, установившееся в растворе малорастворимого электролита [уравнение (2)], можносместить в соответствии с принципом Ле Шателье. Если в насыщенный раствор ввести электролит, содержащий ионы, одноименные тем, которые образуются в результате диссоциации труднорастворимого вещества, то равновесие сместится влево, что приведет к образованию дополнительного количества осадка. Если в рассматриваемом примере [уравнение (2)] увеличить концентрацию ионов PO34− за счет введения в раствор хорошо растворимой соли Na3PO4, то растворимость соли Ag3PO4 уменьшится, и количество осадка увеличится.
Вывод. Присутствие одноименных ионов в растворе труднорастворимого электролита понижает егорастворимость в данном растворителе.
ПРИМЕР 3. Определить растворимость хлорида серебра в чистой
воде и в 0,1 М растворе хлорида натрия. ПР |
AgCl |
= 1,56 × 10–10. |
|
|
Решение. Внасыщенном раствореAgCl устанавливается равновесие: |
||||
[AgCl] + aq |
{Ag+} + { Cl–} ; a = 1. |
(4) |
||
|
aq |
|
aq |
|
ПР = CAg+ CCl− =1,56×10−10.
При отсутствии других электролитов в системе концентрации ионов Ag+ и Cl– одинаковы:
CAg+ = CCl− = C0. ПР = CAg+ CCl− = C02 .
Растворимость AgCl в чистой воде:
С0 = 
 ПР =
ПР = 
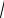 1,56 ×10−10 = 1,25×10−5 моль/л.
1,56 ×10−10 = 1,25×10−5 моль/л.
Увеличение концентрации ионов Cl– за счет введения в раствор NaCl приведет к смещению равновесия (4) влево, к уменьшению концентрации ионов Ag+ за счет образования дополнительного количества осадка AgCl. Равновесная концентрацияионов Cl–будетслагаться из концентрацииионов Cl– за счет диссоциации растворенной части AgCl и ионов Cl–, образующихся за счет диссоциации NaCl: CCl− = CCl− (из AgCl) + CCl− (из NaCl). Хлорид натрия хорошо растворим и является сильным электролитом: NaCl ® Na+ + Cl– ; a = 1. Концентрацией ионов Cl–, образующихся за счет равновесия (4) можно пренебречь, так как она незначительна в сравнении с концентрацией ионов Cl–, образующихся при диссоциации NaCl:
CCl− (из AgCl) << CCl− (из NaCl). При растворенииAgCl в 0,1 М растворе NaCl произведение растворимости AgCl не изменится.
Обозначим растворимость AgCl в 0,1 М растворе NaCl через С1 (моль/л). Тогда
76 |
77 |
|
|
|
|
CAg+ = aC1 = C1. |
|
|
|
|
|
|
ПР = 0,1С = 1,56 × 10–10. |
||
|
|
|
|
|
1 |
|
|
С |
= |
1,56×10−10 |
= 1,56 ×10–9 |
моль/л. |
|
|
|
0,1 |
||||
|
1 |
|
|
|
||
Значение С1 |
значительно меньше С0. |
|
||||
Для решения вопроса о возможности образования осадка в растворе |
||||||
используют значение ПС, которое по форме совпадает с выражением для ПР труднорастворимого электролита, но представляет собой произведение не равновесных концентраций ионов, образующихся за счет диссоциации труднорастворимого электролита, а тех, которые заданы экспериментатором. ПС – произведениеконцентраций ионов, входящих в состав труднорастворимого электролита, в степенях, соответствующих стехиометрическим коэффициентам ионов в уравнении равновесия растворимости.
Условием образованияв системе осадка являетсянеравенство ПС > ПР, т. е. осадок выпадает в том случае, если произведение концентраций ионов, образующих малорастворимый электролит, в степенях, соответствующих стехиометрическим коэффициентам ионов вуравнении равновесиярастворимости, будет больше произведения растворимости (константы равновесия растворимости). При условии ПС < ПР осадок в системе не образуется.
ПРИМЕР 4. Будет ли выпадатьосадок при смешивании 100 мл 0,02 М раствора нитрата свинца с 200 мл 0,2 н. раствора соляной кислоты?
Решение. В осадок может выпасть малорастворимый PbCl2. В исход-
ных растворах концентрация ионов Pb2+ = 0,02 моль/л, C |
Cl |
− = 0,2 моль/л. |
||||
При смешивании растворов концентрация ионов Pb2+ уменьшится в 3 раза |
||||||
и составит |
0,02 |
= 0,0067 моль/л, C − = |
0,2×2 |
= 0,133 моль/л, поскольку |
||
|
3 |
|||||
3 |
Cl |
|
|
|
||
|
|
|
|
|
|
|
раствор, содержащий Cl– ионы, разбавили от 200 до 300 мл. |
||||||
|
ПСPbCl2 = СPb2+ СCl2 − = 0,0067 ×(0,133)2 = 1,19 ×10−4. |
|||||
ПРPbCl2 |
= 2,12×10−5. ПСPbCl2 > ПРPbCl2 . Осадок выпадает. |
|||||
Контрольныезадания
271. Дать определение произведения растворимости. Записать выражения произведения растворимости для CaSO4, Ag2CrO4, Ba3(PO4)2. Вычислить растворимость PbCl2 (моль/л и г/л) при 25°С.
272.В каких единицах измеряется растворимость веществ? Записать
выражения произведения растворимости для АgCl, CaF2, Ag3PO4. Растворимость сульфата бария составляет 1,05 × 10–5 моль/л. Вычислить его произведение растворимости.
273.К 0,01 н. растворусерной кислоты медленно добавляют раствор,
содержащий 0,01 моль/л СаCl2 и 0,01 моль/л SrCl2. Какой осадок начнет выпадать в первую очередь?
274.Какой равновесный процесс происходит в насыщенном растворе
Ag3PO4? Предложите способы смещения равновесия в стороны образования и растворения осадка. Растворимость ортофосфата серебра при неко-
торой температуреравна 6,4 × 10–5 г на 100 г раствора. Вычислить ПРAg3PO4 .
275.Сравнить растворимость (моль/л) солей CaСO3, Сa3(PO4)2, используя величины их ПР. Вычислить объем воды, необходимый для растворения 1 г Сa3(PO4)2.
276.От каких факторов зависит значение ПР? Определить массуосадка, образующегося при полном выпаривании 10 л насыщенного раствора хлорида серебра при условии отсутствия разбрызгивания раствора в процессе выпаривания.
277.Какое условие должно быть соблюдено, чтобы из раствора вы-
пал осадок малорастворимого вещества? ПРCa3 (PO4 )2 = 1 × 10–25. Вычис-
4в насыщенном растворе Сa3(PO4)2.
278.Как изменится количество осадка CaSO4 в насыщенном растворе при добавлении сульфата натрия? В каком объеме насыщенного раствора содержится 100 мг иодида свинца (II)?
279.Определить в какую сторону смещено равновесие в следующих системах, используя для этого значения ПР веществ, участвующих в реакциях:
CaSO4 + Na2CO3 = CaCO3 + Na2SO4; NaCl + AgI = NaI + AgCl;
BaSO4 + Na2CO3 = BaCO3+Na2SO4; Pb3(PO4)2+ 6KBr = 2K3PO4 +3PbBr2.
280.Сколько граммов хромата бария можно растворить в 10 л воды при стандартной температуре?
281.Будет ливыпадать осадокпри смешиванииравныхобъемов 0,06н.лить концентрацию ионов Са2+ и PO3−
2равно 3,7 ×10–8.
282.Будет ли выпадать осадок при добавлении к 100 мл 0,01 н. раствора нитрата серебра 100 мл 0,01 н. раствора сульфата калия?
283.Образуется ли осадок, если к 800 мл 0,001 М раствора нитрата серебра прилить 400 мл 0,0005 М раствора хлорида калия?раствора Pb(NO3)2 и 0,04 н. раствора NaF? ПРPbF
78 |
79 |
