
- •Теоретические основы химии
- •Основные понятия и законы химии Атомно - молекулярное учение.
- •Закон сохранения массы веществ
- •Составление химических уравнений
- •Расчеты по химическим уравнениям
- •Закон постоянства состава
- •Закон кратных отношений
- •Закон объемных отношений
- •Закон Авогадро и молярный объем газа
- •Следствия.
- •Закон эквивалентов
- •Основные классы неорганических
- •2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
- •Основания
- •Получение оснований
- •Химические свойства оснований
- •Кислоты
- •Классификация кислот
- •Химические свойства кислот
- •Получение кислот
- •Средние соли
- •Химические свойства солей
- •Кислые соли
- •Графическое изображение формул
- •Энергетика химических реакций
- •Химическое равновесие. Константа химического равновесия
- •Энтропия
- •Энергия Гиббса направленность химических процессов
- •Примеры термодинамических расчетов
- •Полученные значения h и s характеризуют процесс испарения SnBr2. Процесс эндотермический, испарение требует нагревания. При испарении энтропия увеличивается.
- •Химическая кинетика. Скорость химической реакции
- •Молекулярность элементарных реакций
- •Уравнение Аррениуса
- •Катализ
- •Смещение химического равновесия
- •3 Влияние температуры на положение равновесия
- •Фазовые равновесия
- •Основные характеристики растворов
- •Растворимость газов в газах
- •Растворимость газов в жидкостях
- •Взаимная растворимость жидкостей
- •Растворимость твердых веществ в жидкостях
- •Растворы неэлектролитов
- •1. Давление насыщенного пара разбавленных растворов
- •2. Давление пара идеальных и реальных растворов
- •3. Температура кристаллизации разбавленных растворов
- •4. Температура кипения разбавленных растворов
- •5. Осмотическое давление разбавленных растворов
- •6. Понятие активности растворенного вещества
- •Слабые электролиты. Константа диссоциации
- •Сильные электролиты
- •PН растворов
- •Произведение растворимости
- •Гидролиз солей
- •Количественные характеристики процесса гидролиза соли.
- •Комплексные соединения
- •Направленность реакций в растворах электролитов
- •Протонная теория Брёнстеда-Лоури
- •В случае взаимодействия нейтральных молекулпродукт реакции (например bf3∙nh3) часто называют аддуктом.
- •Теория сольвосистем
- •Металлы, как типичные восстановители, окисляются до соединений, содержащих атомы металлов в более высоких степенях окисления, в зависимости от природы металла и характера среды:
- •Электродные потенциалы
- •Гальванические элементы
- •Электролиз
- •Законы электролиза
- •Примеры электролиза Расплавы
- •Растворы
- •Хими́ческие исто́чники то́ка
- •Коррозия металлов и методы защиты металлов от коррозии
- •Электрохимическая коррозия
- •Защита металлов от коррозии
- •Строение атома
- •Волновое уравнение. Квантовомеханическое объяснение строения атома
- •Электронная структура атомов и периодическая система элементов
- •Структура периодической системы элементов д.И. Менделеева.
- •Периодичность свойств химических элементов и их соединений
- •Ковалентная связь. Метод валентных связей
- •Способы образования ковалентной связи
- •Гибридизация атомных орбиталей
- •Метод молекулярных орбиталей
- •Ионная связь
- •Водородная связь
- •Квантовомеханические теории строения комплексных соединений
- •1. Теория валентных связей
- •2. Гибридизация орбиталей и структура комплексов
- •3. Теория кристаллического поля.
- •4. Цветность комплексных соединений
Средние соли
Получение
Большинство способов получения солей основано на взаимодействии веществ с противоположными свойствами:
Металла с неметаллом:
2Na + Cl2 = 2NaCl
Металла с кислотой:
Zn + 2HCl = ZnCl2 + H2
Металла с раствором соли менее активного металла
Fe + CuSO4 = FeSO4 + Cu
Основного оксида с кислотным оксидом:
MgO + CO2 = MgCO3
Основного оксида с кислотой
CuO + H2SO4═ CuSO4 + H2O
Основания с кислотным оксидом
Ba(OH)2 + CO2 = BaCO3↓ + H2O
Ооснования с кислотой:
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
Соли с кислотой:
MgCO3 + 2HCl = MgCl2 + H2O + CO2
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Раствора основания с раствором соли:
Ba(OH)2 + Na2SO4 = 2NaOH + BaSO4↓
Растворов двух солей
3CaCl2 + 2Na3PO4 = Ca3(PO4)2↓ + 6NaCl
Химические свойства солей
1.Термическое разложение.
CaCO3 = CaO + CO2
2Cu(NO3)2 = 2CuO + 4NO2 + O2
NH4Cl = NH3 + HCl
2.Обменные реакции с кислотами, основаниями и другими солями.
AgNO3 + HCl = AgCl + HNO3
Fe(NO3)3 + 3NaOH = Fe(OH)3 + 3NaNO3
CaCl2 + Na2SiO3 = CaSiO3 + 2NaCl
3. Окислительно-восстановительные реакции, обусловленные свойствами катиона или аниона (подробнее рассматриваются позже).
2KMnO4 + 16HCl = 2MnCl2 + 2KCl + 5Cl2 + 8H2O
4. Гидролиз (подробнее рассматривается позже).
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
FeCl3 + H2O = Fe(OH)Cl2 + HCl
Na2S + H2O = NaHS +NaOH
Кислые соли
Получение
1.Взаимодействие кислоты с недостатком основания.
KOH + H2SO4 = KHSO4 + H2O
2. Взаимодействие основания с избытком кислотного оксида
Ca(OH)2 + 2CO2 = Ca(HCO3)2
3.Взаимодействие средней соли с кислотой
Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2
Химические свойства.
1.Термическое разложение с образованием средней соли
Ca(HCO3)2 = CaCO3 + CO2 + H2O
2.Взаимодействие со щёлочью. Получение средней соли.
Ba(HCO3)2 + Ba(OH)2 = 2BaCO3 + 2H2O
Основные соли
Получение
1.Гидролиз солей, образованных слабым основанием и сильной кислотой
ZnCl2 + H2O = [Zn(OH)]Cl + HCl
2.Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов
AlCl3 + 2NaOH = [Al(OH)2]Cl + 2NaCl
3. Взаимодействие солей слабых кислот со средними солями
2MgCl2 + 2Na2CO3 + H2O = [Mg(OH)]2CO3 + CO2 + 4NaCl
Химические свойства.
1.Термическое разложение.
[Cu(OH)]2CO3(малахит) = 2CuO + CO2 + H2O
2.Взаимодействие с кислотой: образование средней соли.
Sn(OH)Cl + HCl = SnCl2 + H2O
Взаимные превращения и способы получения кислых, средних и основных солей можно представить схемой:
щелочь

КИСЛЫЕ  СРЕДНИЕ
СРЕДНИЕ ОСНОВНЫЕ
ОСНОВНЫЕ
СОЛИ
 СОЛИ
СОЛИ СОЛИ
СОЛИ
кислота
Рассмотрим на примерах все возможные взаимные превращения кислых, средних и основных солей:
(2) (3)
Fe(HSO4)2
 FeSO4
FeSO4
 (FeOH)2SO4.
(FeOH)2SO4.


(4)
FeSO4 + H2SO4 Fe(HSO4)2.
Fe(HSO4)2 + 2KOH FeSO4 + K2SO4 + 2H2O.
2FeSO4 + 2KOH (FeOH)2SO4 + K2SO4.
(FeOH)2SO4 + H2SO4 2FeSO4 + 2H2O.
ГЕНЕТИЧЕСКАЯ СВЯЗЬ МЕЖДУ РАЗЛИЧНЫМИ КЛАССАМИ СОЕДИНЕНИЙ
|
|
Графическое изображение формул
При составлении графических формул не учитывают характер связи в соединениях, а исходят из степени окисления атомов, входящих в состав веществ. Количество черточек, соединяющих атомы, должно совпадать с их степенями окисления. Составление графических формул позволяет глубже понять взаимосвязь между веществами, относящимися к различным классам неорганических соединений.
Например:
основания: NaOH, Ca+2(OH)2, Al+3(OH)3
O–2
– H+
Na+1 – O–2 – H+ H – O – Ca+2 – O–2 – H+ H – O – Al+3
O – H
кислоты: HNO3, H2SO4, H3PO4
O–2
H+
– O–2
O–2
H+
– O–2





H+
– O–2
– N+5
S H+
– O–2
– P+5
= O–2


O–2
H+
– O–2
O–2
H+
– O–2


соли: CaSO4, Na3PO4, NaNO3
O–2
O Na – O O




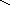

Ca+2
S Na – O – P = O Na – O – N
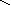


O–2
O Na – O O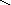


(FeOH)2SO4 Fe(H2PO4)2
H –
O – Fe – O O O – H H – O




S
O = P – O – Fe – O – P = O 


H–O–Fe–OOO–HH–O


