
- •Теоретические основы химии
- •Основные понятия и законы химии Атомно - молекулярное учение.
- •Закон сохранения массы веществ
- •Составление химических уравнений
- •Расчеты по химическим уравнениям
- •Закон постоянства состава
- •Закон кратных отношений
- •Закон объемных отношений
- •Закон Авогадро и молярный объем газа
- •Следствия.
- •Закон эквивалентов
- •Основные классы неорганических
- •2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
- •Основания
- •Получение оснований
- •Химические свойства оснований
- •Кислоты
- •Классификация кислот
- •Химические свойства кислот
- •Получение кислот
- •Средние соли
- •Химические свойства солей
- •Кислые соли
- •Графическое изображение формул
- •Энергетика химических реакций
- •Химическое равновесие. Константа химического равновесия
- •Энтропия
- •Энергия Гиббса направленность химических процессов
- •Примеры термодинамических расчетов
- •Полученные значения h и s характеризуют процесс испарения SnBr2. Процесс эндотермический, испарение требует нагревания. При испарении энтропия увеличивается.
- •Химическая кинетика. Скорость химической реакции
- •Молекулярность элементарных реакций
- •Уравнение Аррениуса
- •Катализ
- •Смещение химического равновесия
- •3 Влияние температуры на положение равновесия
- •Фазовые равновесия
- •Основные характеристики растворов
- •Растворимость газов в газах
- •Растворимость газов в жидкостях
- •Взаимная растворимость жидкостей
- •Растворимость твердых веществ в жидкостях
- •Растворы неэлектролитов
- •1. Давление насыщенного пара разбавленных растворов
- •2. Давление пара идеальных и реальных растворов
- •3. Температура кристаллизации разбавленных растворов
- •4. Температура кипения разбавленных растворов
- •5. Осмотическое давление разбавленных растворов
- •6. Понятие активности растворенного вещества
- •Слабые электролиты. Константа диссоциации
- •Сильные электролиты
- •PН растворов
- •Произведение растворимости
- •Гидролиз солей
- •Количественные характеристики процесса гидролиза соли.
- •Комплексные соединения
- •Направленность реакций в растворах электролитов
- •Протонная теория Брёнстеда-Лоури
- •В случае взаимодействия нейтральных молекулпродукт реакции (например bf3∙nh3) часто называют аддуктом.
- •Теория сольвосистем
- •Металлы, как типичные восстановители, окисляются до соединений, содержащих атомы металлов в более высоких степенях окисления, в зависимости от природы металла и характера среды:
- •Электродные потенциалы
- •Гальванические элементы
- •Электролиз
- •Законы электролиза
- •Примеры электролиза Расплавы
- •Растворы
- •Хими́ческие исто́чники то́ка
- •Коррозия металлов и методы защиты металлов от коррозии
- •Электрохимическая коррозия
- •Защита металлов от коррозии
- •Строение атома
- •Волновое уравнение. Квантовомеханическое объяснение строения атома
- •Электронная структура атомов и периодическая система элементов
- •Структура периодической системы элементов д.И. Менделеева.
- •Периодичность свойств химических элементов и их соединений
- •Ковалентная связь. Метод валентных связей
- •Способы образования ковалентной связи
- •Гибридизация атомных орбиталей
- •Метод молекулярных орбиталей
- •Ионная связь
- •Водородная связь
- •Квантовомеханические теории строения комплексных соединений
- •1. Теория валентных связей
- •2. Гибридизация орбиталей и структура комплексов
- •3. Теория кристаллического поля.
- •4. Цветность комплексных соединений
Количественные характеристики процесса гидролиза соли.
Количественными характеристиками процессов гидролиза являются степень гидролиза () и константа гидролиза (Кг).
Степень гидролиза ()отношение количества прогидролизовавшейся соли к общему количеству соли в растворе:
=
 .
.
Константа гидролиза–константа равновесия процесса гидролиза.
Степень гидролиза () связана с константой гидролиза соли соотношением:
Кг
=
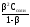 .
.
Если
1, то равенство упрощается:Кг
= 2Ссоли,
тогда =
 .
.
Упрощенной
формулой нельзя пользоваться,
если 102.
102.
На величину степени гидролиза соли, кроме химической природы, влияют температура, концентрация соли и присутствие ионов Н+или ОН-.
Рассмотрим влияние указанных факторов на глубину протекания гидролиза на примере гидролиза соли Sn(NO3)2.
Запишем уравнение гидролиза соли (образованной слабым основанием и сильной кислотой):
Sn(NO3)2
+ H2O
![]() SnOHNO3
+ HNO3;
SnOHNO3
+ HNO3;
Sn2++H2O![]() SnOH++H+.
SnOH++H+.
Чтобы подавить гидролиз(уменьшить степень гидролиза) следует:
а) охладить раствор. Гидролиз (реакция, обратная нейтрализации) – эндотермический процесс. При нагревании, в соответствии спринципом Ле Шателье, гидролиз усиливается. Следует отметить также, что при нагревании Kw увеличивается в большей степени, чем константы диссоциации кислот и оснований.
б) увеличить концентрацию соли в растворе;
в) подкислить раствор, т.е. ввести ионы Н+, одноименные образующимся при гидролизе.
Чтобы усилить гидролизэтой соли, т.е. увеличить степень гидролиза следует:
а) повысить температуру;
б) разбавить раствор;
в) ввести в раствор ионы ОН-, которые нейтрализуют ионы Н+, образуя воду, т.е. подщелочить раствор.
1) Для средних солей, образованных слабой кислотой и сильным основанием, константа гидролиза рассчитывается по формуле:
Кг=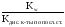 (Kw=
10-14– ионное произведение воды).
(Kw=
10-14– ионное произведение воды).
Например: Na2SO3 + H2O NaHSO3 + NaOH;
SO + H2O
+ H2O
![]() HSO
HSO + OH-;
+ OH-;
Кг
=
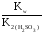 .
.
2) Для солей, образованных слабым основанием и сильной кислотой, константа гидролиза рассчитывается по формуле:
Кг
=
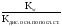 .
.
Например:
Ni(NO3)2
+ H2O
![]() NiOHNO3
+ HNO3;
NiOHNO3
+ HNO3;
Ni2++H2O![]() NiOH++H+;
NiOH++H+;
Кг=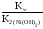 .
.
3) Для солей, образованных слабой кислотой и слабым основанием, константа гидролиза рассчитывается по формуле:
Кг=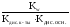 .
.
Например:
СН3СООNH4+H2O![]() СН3СООH+NH4OH;
СН3СООH+NH4OH;
Кг=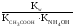 .
.
В растворах кислых солейдля определения рН раствора необходимо сопоставить соответствующие константы гидролиза и диссоциации кислотного остатка. Такое сопоставление показывает, что в растворе гидрокарбоната натрия рН7, тогда как в растворе гидросульфита натрия рН7.
Рассмотрим примеры задач, связанных с расчетами характеристик процессов гидролиза.
ПРИМЕР 1. Вычислить константу гидролиза, степень гидролиза и рН 0,1 М раствораNa2SO3.
РЕШЕНИЕ.
|
Na2SO3 |
NaOH– сильное основание H2SO3– слабая кислота |
2Na+
+ SO |
Гидролизу подвергается анион слабой кислоты:
SO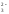 + H2O
+ H2O
![]() НSO
НSO + ОН-;
рН
7;
+ ОН-;
рН
7;
в молекулярной форме:
Na2SO3+H2O![]() NaНSO3+NaOH.
NaНSO3+NaOH.
Рассчитываем константу гидролиза:
Кг=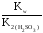 =
=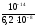 = 1,6110-7
= 1,6110-7
(К2
Н SO
SO = 6,210-8берем
из справочника).
= 6,210-8берем
из справочника).
=
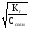 =
=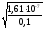 = 1,2710-3.
= 1,2710-3.
Для определения рН раствора нужно определить равновесную концентрацию ионов ОН-в растворе, образующихся в результате гидролизаNa2SO3:
СОН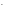 = С0или СОН
= С0или СОН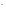 =
= .
.
СОН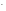 =
=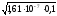 = 1,2710-4моль/л,
тогда
= 1,2710-4моль/л,
тогда
рОН
= -lgСОН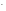 = -lg(1,2710-4) = -lg(1,27) –lg(10-4)
= -0,10 + 4 = 3,90;
= -lg(1,2710-4) = -lg(1,27) –lg(10-4)
= -0,10 + 4 = 3,90;
рН = 14 – рОН = 14 – 3,90 = 10,10.
ПРИМЕР 2. В растворе солиNH4СlpH= 5,13 рассчитать молярную концентрацию соли, степень и константу гидролиза.
РЕШЕНИЕ. Запишем диссоциацию соли:
|
NH4Сl |
NH4OH– слабое основание HСl – сильная кислота |
NH
|
Гидролизу подвергается катион слабого основания:
NH
 +H2O
+H2O![]() NH4OH
+H+;
NH4OH
+H+;
в молекулярной форме:
NH4Сl+H2O![]() NH4OH
+HСl.
NH4OH
+HСl.
Рассчитываем константу гидролиза:
Кг= =
=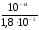 = 5,5610-10
= 5,5610-10
(Кд
NН OH= ,810-5 берем
из справочника). Используя формулу
СН
OH= ,810-5 берем
из справочника). Используя формулу
СН =
= ,
найдем концентрацию соли, предварительно
по значению рН определим СН
,
найдем концентрацию соли, предварительно
по значению рН определим СН .
.
СН =
10-рН= 10-5,13= 7,410-6моль/л,
=
10-рН= 10-5,13= 7,410-6моль/л,
тогда
Ссоли=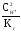 =
=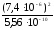 0,1 моль/л.
0,1 моль/л.
Степень гидролиза можно рассчитать исходя из формул:
=
 или=
или=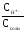 .=
.=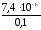 = 7,410-5.
= 7,410-5.

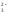
 + Сl -
+ Сl -