
- •Теоретические основы химии
- •Основные понятия и законы химии Атомно - молекулярное учение.
- •Закон сохранения массы веществ
- •Составление химических уравнений
- •Расчеты по химическим уравнениям
- •Закон постоянства состава
- •Закон кратных отношений
- •Закон объемных отношений
- •Закон Авогадро и молярный объем газа
- •Следствия.
- •Закон эквивалентов
- •Основные классы неорганических
- •2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
- •Основания
- •Получение оснований
- •Химические свойства оснований
- •Кислоты
- •Классификация кислот
- •Химические свойства кислот
- •Получение кислот
- •Средние соли
- •Химические свойства солей
- •Кислые соли
- •Графическое изображение формул
- •Энергетика химических реакций
- •Химическое равновесие. Константа химического равновесия
- •Энтропия
- •Энергия Гиббса направленность химических процессов
- •Примеры термодинамических расчетов
- •Полученные значения h и s характеризуют процесс испарения SnBr2. Процесс эндотермический, испарение требует нагревания. При испарении энтропия увеличивается.
- •Химическая кинетика. Скорость химической реакции
- •Молекулярность элементарных реакций
- •Уравнение Аррениуса
- •Катализ
- •Смещение химического равновесия
- •3 Влияние температуры на положение равновесия
- •Фазовые равновесия
- •Основные характеристики растворов
- •Растворимость газов в газах
- •Растворимость газов в жидкостях
- •Взаимная растворимость жидкостей
- •Растворимость твердых веществ в жидкостях
- •Растворы неэлектролитов
- •1. Давление насыщенного пара разбавленных растворов
- •2. Давление пара идеальных и реальных растворов
- •3. Температура кристаллизации разбавленных растворов
- •4. Температура кипения разбавленных растворов
- •5. Осмотическое давление разбавленных растворов
- •6. Понятие активности растворенного вещества
- •Слабые электролиты. Константа диссоциации
- •Сильные электролиты
- •PН растворов
- •Произведение растворимости
- •Гидролиз солей
- •Количественные характеристики процесса гидролиза соли.
- •Комплексные соединения
- •Направленность реакций в растворах электролитов
- •Протонная теория Брёнстеда-Лоури
- •В случае взаимодействия нейтральных молекулпродукт реакции (например bf3∙nh3) часто называют аддуктом.
- •Теория сольвосистем
- •Металлы, как типичные восстановители, окисляются до соединений, содержащих атомы металлов в более высоких степенях окисления, в зависимости от природы металла и характера среды:
- •Электродные потенциалы
- •Гальванические элементы
- •Электролиз
- •Законы электролиза
- •Примеры электролиза Расплавы
- •Растворы
- •Хими́ческие исто́чники то́ка
- •Коррозия металлов и методы защиты металлов от коррозии
- •Электрохимическая коррозия
- •Защита металлов от коррозии
- •Строение атома
- •Волновое уравнение. Квантовомеханическое объяснение строения атома
- •Электронная структура атомов и периодическая система элементов
- •Структура периодической системы элементов д.И. Менделеева.
- •Периодичность свойств химических элементов и их соединений
- •Ковалентная связь. Метод валентных связей
- •Способы образования ковалентной связи
- •Гибридизация атомных орбиталей
- •Метод молекулярных орбиталей
- •Ионная связь
- •Водородная связь
- •Квантовомеханические теории строения комплексных соединений
- •1. Теория валентных связей
- •2. Гибридизация орбиталей и структура комплексов
- •3. Теория кристаллического поля.
- •4. Цветность комплексных соединений
Закон эквивалентов
(Рихтер 1800г.):
Все вещества реагируют в эквивалентных соотношениях или массы реагирующих друг с другом веществ, а также массы продуктов этой реакции пропорциональны молярным массам эквивалентов этих веществ:
 =
=

Эквивалент - реальная или условная частица, которая в данной кислотно-основной реакции, в реакции ионного обмена равноценна одному молю атомарного (одному молю ионов) водорода или в окислительно-восстановительной реакции – одному молю электронов.
Фактор
эквивалентности fэкв(Х)
– число, обозначающее долю реальной
или условной частицы, которая в реакции
ионного обмена равноценна одному молю
атоматомарного (одному молю ионов)
водорода или в окислительно-восстановительной
реакции – одному молю электронов.
Фактор эквивалентности (fэкв =
 )
может равняться единице или быть меньше
ее.
)
может равняться единице или быть меньше
ее.
Молярная
масса эквивалента вещества М[ (Х)]
равна произведению фактора эквивалентности
fэкв(Х) на молярную массу вещества Х.
Молярную массу эквивалента различных
веществ можно рассчитать по формулам:
(Х)]
равна произведению фактора эквивалентности
fэкв(Х) на молярную массу вещества Х.
Молярную массу эквивалента различных
веществ можно рассчитать по формулам:
М( оксида)
=
оксида)
= ;
;
М( кислоты)
=
кислоты)
= ;
;
М( основания)
=
основания)
= ;
;
М( соли)
=
соли)
= .
.
Например:
М( H2SO4)
=
H2SO4)
=

М(H
М(H SO
SO )
=
)
=
98 = 49 г/моль.
98 = 49 г/моль.
М(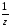 Са(ОН)2)
=
Са(ОН)2)
=
 ;
;
М( Al
Al (SO4)3)
=
(SO4)3)
=
 =
= .
.
Пример 1. Определить эквивалент Mg, зная, что 3 весовых части магния соединяются с 2 весовыми частями О.
Mэ(Mg)
3 : 2 = ЭMg : 8
ЭMg
=
 = 12
= 12
Пример 2. CaCl2 содержит 36% Са и 64%Cl. Определить эквивалент кальция, зная, что эквивалент хлора равен 35,5
36 : 64 = ЭСа : 35,5
ЭСа
=
 = 20
= 20
Основные классы неорганических
Простые вещества. Молекулы состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ.
Сложные вещества (или химические соединения). Молекулы состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ.
|
Неорганические вещества | |
|
Простые |
Металлы |
|
Неметаллы | |
|
Сложные |
Оксиды |
|
Основания | |
|
Кислоты | |
|
Соли | |
Резкой границы между металлами и неметаллами нет, т.к. есть простые вещества, проявляющие двойственные свойства.
Аллотропия - способность некоторых химических элементов образовывать несколько простых веществ, различающихся по строению и свойствам.
С - алмаз, графит, карбин, фуллурены.
O - кислород, озон.
S - ромбическая, моноклинная, пластическая.
P - белый, красный, чёрный.
Явление аллотропии вызывается двумя причинами:1) различным числом атомов в молекуле, например кислород O2 и озон O3; 2) образованием различных кристаллических форм, например алмаз и графит.
ОКСИДЫ
Оксиды - это сложные вещества, состоящие из двух элементов, один из которых кислород.
Классификация
|
|
|
|
Несолеобразующие |
CO, N2O, NO |
|
Солеобразующие |
Основные -это оксиды металлов, в которых последние проявляют небольшую степень окисления +1, +2 Na2O; MgO; CuO |
|
|
Амфотерные -это оксиды металлов со степенью окисления +3, +4 (Al2O3; Cr2O3; SnO2=) и +2: ZnO, BeO, SnO, PbO. В качестве гидратов им соответствуют амфотерные гидроксиды. |
|
|
Кислотные -это оксиды неметаллов со всеми степенями окисления и металлов со степенью окисления от +5 и выше: SO2; SO3; P2O5; Mn2O7; CrO3. |
|
|
Основным оксидам соответствуют основания, кислотным оксидам – кислоты, амфотерным – амфотерные гидроксиды. |
Получение оксидов
1. Взаимодействие простых и сложных веществ с кислородом:
2Mg + O2 = 2MgO
4P + 5O2 = 2P2O5
S + O2 = SO2
2CO + O2= = 2CO2
2CuS + 3O2 = 2CuO + 2SO2
CH4 + 2O2 = CO2 + 2H2O
4NH3 + 5O2═ 4NO + 6H2O
