
- •Теоретические основы химии
- •Основные понятия и законы химии Атомно - молекулярное учение.
- •Закон сохранения массы веществ
- •Составление химических уравнений
- •Расчеты по химическим уравнениям
- •Закон постоянства состава
- •Закон кратных отношений
- •Закон объемных отношений
- •Закон Авогадро и молярный объем газа
- •Следствия.
- •Закон эквивалентов
- •Основные классы неорганических
- •2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
- •Основания
- •Получение оснований
- •Химические свойства оснований
- •Кислоты
- •Классификация кислот
- •Химические свойства кислот
- •Получение кислот
- •Средние соли
- •Химические свойства солей
- •Кислые соли
- •Графическое изображение формул
- •Энергетика химических реакций
- •Химическое равновесие. Константа химического равновесия
- •Энтропия
- •Энергия Гиббса направленность химических процессов
- •Примеры термодинамических расчетов
- •Полученные значения h и s характеризуют процесс испарения SnBr2. Процесс эндотермический, испарение требует нагревания. При испарении энтропия увеличивается.
- •Химическая кинетика. Скорость химической реакции
- •Молекулярность элементарных реакций
- •Уравнение Аррениуса
- •Катализ
- •Смещение химического равновесия
- •3 Влияние температуры на положение равновесия
- •Фазовые равновесия
- •Основные характеристики растворов
- •Растворимость газов в газах
- •Растворимость газов в жидкостях
- •Взаимная растворимость жидкостей
- •Растворимость твердых веществ в жидкостях
- •Растворы неэлектролитов
- •1. Давление насыщенного пара разбавленных растворов
- •2. Давление пара идеальных и реальных растворов
- •3. Температура кристаллизации разбавленных растворов
- •4. Температура кипения разбавленных растворов
- •5. Осмотическое давление разбавленных растворов
- •6. Понятие активности растворенного вещества
- •Слабые электролиты. Константа диссоциации
- •Сильные электролиты
- •PН растворов
- •Произведение растворимости
- •Гидролиз солей
- •Количественные характеристики процесса гидролиза соли.
- •Комплексные соединения
- •Направленность реакций в растворах электролитов
- •Протонная теория Брёнстеда-Лоури
- •В случае взаимодействия нейтральных молекулпродукт реакции (например bf3∙nh3) часто называют аддуктом.
- •Теория сольвосистем
- •Металлы, как типичные восстановители, окисляются до соединений, содержащих атомы металлов в более высоких степенях окисления, в зависимости от природы металла и характера среды:
- •Электродные потенциалы
- •Гальванические элементы
- •Электролиз
- •Законы электролиза
- •Примеры электролиза Расплавы
- •Растворы
- •Хими́ческие исто́чники то́ка
- •Коррозия металлов и методы защиты металлов от коррозии
- •Электрохимическая коррозия
- •Защита металлов от коррозии
- •Строение атома
- •Волновое уравнение. Квантовомеханическое объяснение строения атома
- •Электронная структура атомов и периодическая система элементов
- •Структура периодической системы элементов д.И. Менделеева.
- •Периодичность свойств химических элементов и их соединений
- •Ковалентная связь. Метод валентных связей
- •Способы образования ковалентной связи
- •Гибридизация атомных орбиталей
- •Метод молекулярных орбиталей
- •Ионная связь
- •Водородная связь
- •Квантовомеханические теории строения комплексных соединений
- •1. Теория валентных связей
- •2. Гибридизация орбиталей и структура комплексов
- •3. Теория кристаллического поля.
- •4. Цветность комплексных соединений
Метод молекулярных орбиталей
Теория молекулярных орбиталей (МО) дает представление о распределении электронной плотности и объясняет свойства молекул. В этой теории квантовомеханические зависимости дляатомараспространены на более сложную систему — молекулу. Молекула рассматривается как целое, а не как совокупность сохранивших индивидуальность атомов. В молекуле (как и в атоме) имеются дискретные энергетические состояния отдельныхэлектронов(молекулярные орбитали) с их самосогласованным движением в поле друг друга и всех ядер молекулы.
Предполагается, что все электроны данной молекулы (как и в атоме) распределяются по соответствующим орбиталям. Состояние электрона в атоме описывается одноэлектроннойволновой функциейψ, являющейся решениемуравнения Шрёдингера. Волновая функция ψ, зависящая от четырёх квантовых чисел, имеющая конкретный математический вид и удовлетворяющая условию нормировки и однозначности называется молекулярной орбиталью (МО) (по аналогии с атомной). Каждая орбиталь характеризуется своим наборомквантовых чисел, отражающих свойства электронов в данном энергетическом состоянии. В отличие от одноцентровых орбиталей атомов, орбитали молекул многоцентровые, то есть молекулы имеют общие орбитали для двух или более атомных ядер. Каждая молекулярная орбиталь обладает определённой энергией, приближённо характеризующейся соответствующим потенциалом ионизации.
По аналогии с атомными s-, p-, d-, f- орбиталями молекулярные орбитали обозначают греческими буквами σ-, π-, δ-, -. МО образуются при комбинировании атомных орбиталей при достаточном сближении. Совокупность МО молекулы с указанием её типа и количеством электронов на ней даёт электронную конфигурацию молекулы. Существуют 3 типа молекулярных орбиталей: связывающие, разрыхляющие и несвязывающие. Заполнение молекулярных орбиталей происходит так же, как и атомных, с соблюдением принципа Паули, принципа наименьшей энергии и правила Хунда; на каждой МО может находиться не более двух электронов.Электроны на связывающих молекулярных орбиталях упрочняют связь, на разрыхляющих как бы дестабилизируют (расшатывают). Молекула является устойчивой лишь в том случае, если число электронов на связывающих орбиталях превышает число электронов на разрыхляющих. Электроны, находящиеся на несвязывающих молекулярных орбиталях, участие в образовании химической связи не принимают. Из исходных атомных орбиталей возникает n МО. Так, при образовании двухатомной молекулы H2 из атомов Н из s-орбиталей двух атомов Н возникают две двухцентровые МО — одна энергетически более выгодная (связывающая σsсв), другая менее выгодная (разрыхляющая σsразр), чем исходные атомные орбитали. На связывающей МО электрон большую часть времени пребывает между ядрами (повышается электронная плотность), способствуя их химическому связыванию. Нa разрыхляющей же МО электрон большую часть времени находится за ядрами, вызывая отталкивание ядер друг от друга.
Основные положения метода:
1. Число образующихся МО должно быть равно числу исходных АО.
2. АО, образующие МО, должны иметь близкие или одинаковые значения энергий.
3. Взаимодействующие АО должны иметь одинаковую симметрию относительно линии связи в молекуле.
4. АО должны в достаточной степени перекрываться при образовании МО. Поэтому орбитали внутренних слоев атомов практически не участвуют в образовании связи и в методе МО обычно не рассматриваются.
В методе МО образование молекулярных орбиталей рассматривается как результат сложения и вычитания комбинируемых АО. Молекулярная орбиталь, возникающая в результате сложения АО, отвечает более низкому значению энергий, чем исходные АО. Такая МО имеет повышенную электронную плотность в пространстве между ядрами и способствует образованию химической связи, она называется связывающей (св.).
Молекулярная орбиталь, возникающая в результате вычитания АО, отвечает более высокому значению энергий, чем исходные АО. Электронная плотность в этом случае сконцентрирована за ядрами атомов, а между ними равна нулю. Подобные МО энергетически менее устойчивы, они приводят к ослаблению химической связи и называются разрыхляющими (разр. или *).
Образование молекулярных орбиталей из атомных орбиталей изображают схематически в виде энергетических диаграмм, на которых молекулярные и атомные орбитали обозначаются либо в виде клеточек , либо в виде кружочков О, а электроны на них – стрелками, направленными вверх (↑) или вниз (↓). Орбитали на диаграммах размещают в соответствии с их энергией.
Рассмотрим построение такой энергетической диаграммы на примере молекулы водорода Н2 :

НА(1s1) + НВ(1s1) → H2(1s)2
Электроны, занимающие связывающие и разрыхляющие МО, называются соответственно связывающими и разрыхляющими. Устойчивая молекула образуется в случае, если сумма электронов, расположенных на связывающих МО, превышает сумму электронов на разрыхляющих МО.
Кратность (порядок) связи равна половине разности числа электронов на связывающих Nсв и разрыхляющих Nразр МО:
К.
с. =
 .
.
Чем выше кратность связи, тем прочнее молекула.
Рассмотрим использование метода МО на примере двухатомных гомоядерных молекул элементов II периода периодической системы. Согласно спектроскопическим данным, молекулярные орбитали двухатомных гомоядерных молекул элементов II периода по энергии располагаются следующим образом:
а)
для молекул Li2,
Be2,
B2,
C2,
N2
этот порядок 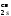

 =
=
=
=


 =
= 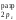
 представлен энергетической диаграммой:
представлен энергетической диаграммой:
АО МО АО




б)
для молекул О2,
F2,
Ne2
этот порядок 


 = =
= = 
 =
= 
 представлен энергетической диаграммой,
изображенной на рис.:
представлен энергетической диаграммой,
изображенной на рис.:
АО МО АО




К.
Записав электронную конфигурацию молекулы, можно сделать вывод о прочности и длине связи в молекуле, а также определить ее магнитные свойства.

Метод
МО позволяет характеризовать не только
молекулы, но и молекулярные
ионы. Рассмотрим строение О2 и
 .
Изобразим
заполненную электронами энергетическую
диаграмму каждой из этих частиц. в
соответствии с принципом наименьшей
энергии, принципом Паули и правилом
Хунда:
.
Изобразим
заполненную электронами энергетическую
диаграмму каждой из этих частиц. в
соответствии с принципом наименьшей
энергии, принципом Паули и правилом
Хунда:

МО
(О2)
КК( )2(
)2( )2(
)2( )2
(
)2
( )2(
)2(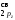 )2(
)2( )1(
)1( )1,
)1,
где К – электронная конфигурация К-слоя атомов кислорода, которые практически не участвуют в образовании связи.
Порядок
связи (О2)
=
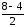 = 2.
= 2.
МО
 КК(
КК( )2(
)2( )2(
)2( )2
(
)2
( )2(
)2(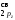 )2(
)2( )1
)1
Порядок
связи
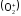 =
= = 2,5.
= 2,5.
Так
как порядок связи иона
 выше, чем молекулы О2,
то ион
выше, чем молекулы О2,
то ион
 более устойчив, чем молекула О2,
длина связи в ионе
более устойчив, чем молекула О2,
длина связи в ионе
 меньше,
чем в молекуле О2.
Наличие неспаренных электронов в МО О2
и ионе
меньше,
чем в молекуле О2.
Наличие неспаренных электронов в МО О2
и ионе
 определяет ихпарамагнитные
свойства.
В случае отсутствия неспаренных
электронов в МО проявляются диамагнитные
свойства
молекул.
определяет ихпарамагнитные
свойства.
В случае отсутствия неспаренных
электронов в МО проявляются диамагнитные
свойства
молекул.
Гетероядерные двухатомные молекулы метод МО описывает так же, как и гомоядерные двухатомные молекулы. В этом случае энергии атомных орбиталей разных атомов различаются. В связывающую орбиталь большой вклад вносит орбиталь более электроотрицательного атома, а в разрыхляющую – орбиталь менее электроотрицательного атома. Энергетические диаграммы молекул типа АВ, где атом В более электроотрицателен, чем атом А, имеют следующий вид :
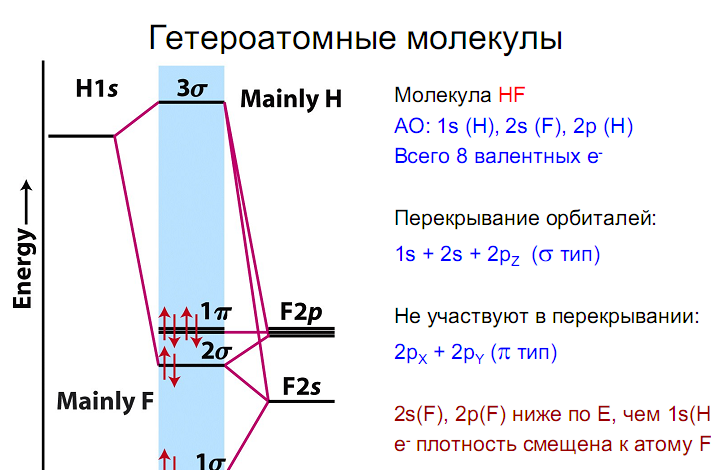
![]()

 х
х

В случае молекул, имеющих три и более атома, энергетические диаграммы все более усложняются. Поэтому описание многоатомных молекул с позиций метода МО становится менее наглядным, а следовательно, и менее удобным.
