
- •Теоретические основы химии
- •Основные понятия и законы химии Атомно - молекулярное учение.
- •Закон сохранения массы веществ
- •Составление химических уравнений
- •Расчеты по химическим уравнениям
- •Закон постоянства состава
- •Закон кратных отношений
- •Закон объемных отношений
- •Закон Авогадро и молярный объем газа
- •Следствия.
- •Закон эквивалентов
- •Основные классы неорганических
- •2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
- •Основания
- •Получение оснований
- •Химические свойства оснований
- •Кислоты
- •Классификация кислот
- •Химические свойства кислот
- •Получение кислот
- •Средние соли
- •Химические свойства солей
- •Кислые соли
- •Графическое изображение формул
- •Энергетика химических реакций
- •Химическое равновесие. Константа химического равновесия
- •Энтропия
- •Энергия Гиббса направленность химических процессов
- •Примеры термодинамических расчетов
- •Полученные значения h и s характеризуют процесс испарения SnBr2. Процесс эндотермический, испарение требует нагревания. При испарении энтропия увеличивается.
- •Химическая кинетика. Скорость химической реакции
- •Молекулярность элементарных реакций
- •Уравнение Аррениуса
- •Катализ
- •Смещение химического равновесия
- •3 Влияние температуры на положение равновесия
- •Фазовые равновесия
- •Основные характеристики растворов
- •Растворимость газов в газах
- •Растворимость газов в жидкостях
- •Взаимная растворимость жидкостей
- •Растворимость твердых веществ в жидкостях
- •Растворы неэлектролитов
- •1. Давление насыщенного пара разбавленных растворов
- •2. Давление пара идеальных и реальных растворов
- •3. Температура кристаллизации разбавленных растворов
- •4. Температура кипения разбавленных растворов
- •5. Осмотическое давление разбавленных растворов
- •6. Понятие активности растворенного вещества
- •Слабые электролиты. Константа диссоциации
- •Сильные электролиты
- •PН растворов
- •Произведение растворимости
- •Гидролиз солей
- •Количественные характеристики процесса гидролиза соли.
- •Комплексные соединения
- •Направленность реакций в растворах электролитов
- •Протонная теория Брёнстеда-Лоури
- •В случае взаимодействия нейтральных молекулпродукт реакции (например bf3∙nh3) часто называют аддуктом.
- •Теория сольвосистем
- •Металлы, как типичные восстановители, окисляются до соединений, содержащих атомы металлов в более высоких степенях окисления, в зависимости от природы металла и характера среды:
- •Электродные потенциалы
- •Гальванические элементы
- •Электролиз
- •Законы электролиза
- •Примеры электролиза Расплавы
- •Растворы
- •Хими́ческие исто́чники то́ка
- •Коррозия металлов и методы защиты металлов от коррозии
- •Электрохимическая коррозия
- •Защита металлов от коррозии
- •Строение атома
- •Волновое уравнение. Квантовомеханическое объяснение строения атома
- •Электронная структура атомов и периодическая система элементов
- •Структура периодической системы элементов д.И. Менделеева.
- •Периодичность свойств химических элементов и их соединений
- •Ковалентная связь. Метод валентных связей
- •Способы образования ковалентной связи
- •Гибридизация атомных орбиталей
- •Метод молекулярных орбиталей
- •Ионная связь
- •Водородная связь
- •Квантовомеханические теории строения комплексных соединений
- •1. Теория валентных связей
- •2. Гибридизация орбиталей и структура комплексов
- •3. Теория кристаллического поля.
- •4. Цветность комплексных соединений
Уравнение Аррениуса
Очевидно, что взаимодействие частиц осуществляется при их столкновениях; однако число столкновений молекул очень велико и, если бы каждое столкновение приводило к химическому взаимодействию частиц, все реакции протекали бы практически мгновенно. С. Аррениуспостулировал, что столкновения молекул будут эффективны (т.е. будут приводить к реакции) только в том случае, если сталкивающиеся молекулы обладают некоторым запасом энергии – энергией активации.
Энергия активации есть минимальная энергия, которой должны обладать молекулы, чтобы их столкновение могло привести к химическому взаимодействию.
Опытным путем установлены примерные границы энергий активации для реакций, идущих с соизмеримыми скоростями: если Еа< 50 кДж, то реакция идет с неизмеримо большой скоростью, если же Еа > 100 кДж, то скорость реакции неизмеримо мала.
Рассмотрим путь некоторой элементарной реакции
А + В ––> С
Поскольку химическое взаимодействие частиц связано с разрывом старых химических связей и образованием новых, считается, что всякая элементарная реакция проходит через образование некоторого неустойчивого промежуточного соединения (переходного состояния), называемого активированным комплексом А…В:
А ––> А…В ––> B
Образование активированного комплекса всегда требует затраты некоторого количества энергии, что вызвано, во-первых, отталкиванием электронных оболочек и атомных ядер при сближении частиц и, во-вторых, необходимостью построения определенной пространственной конфигурации атомов в активированном комплексе и перераспределения электронной плотности. Таким образом, по пути из начального состояния в конечное система должна преодолеть своего рода энергетический барьер. Энергия активации реакции приближённо равна превышению средней энергии активированного комплекса над средним уровнем энергии реагентов. Очевидно, что если прямая реакция является экзотермической, то энергия активации обратной реакции Е'А выше, чем энергия активации прямой реакции EA. Энергии активации прямой и обратной реакции связаны друг с другом через изменение внутренней энергии в ходе реакции. Вышесказанное можно проиллюстрировать с помощью энергетической диаграммы химической реакции:

Рис. 1. Энергетическая диаграмма для эндотермической реакции образования продукта АВ из исходных веществ А и В.
Если энергия столкновения молекул А и В больше или равна энергии активации Еа, то энергетический барьер преодолевается, и происходит перемещение вдоль координаты реакцииr от исходных веществ к продукту. Иначе имеет место упругое столкновение молекул А и В. Вершина энергетического барьера соответствуетпереходному состоянию(активированному комплексу), в котором связь А–В образовалась частично.
Поскольку температура есть мера средней кинетической энергии частиц, повышение температуры приводит к увеличению доли частиц, энергия которых равна или больше энергии активации, что приводит к увеличению константы скорости реакции (рис.2.):

Рис. 2.Распределение частиц по энергии Здесь nЕ/N – доля частиц, обладающих энергией E; Ei- средняя энергия частиц при температуре Ti(T1< T2< T3)
Зависимость константы скорости реакции от температуры и величины энергии активации описывается – уравнением Аррениуса:
k= A e-Ea / RT,
где А – предэкспоненциальный множитель, не зависящий от температурыиконцентрации и равный числу «удачных» столкновений в единицу времени (т.е. молекулы в момент столкновения должны ориентированы друг относительно друга подходящим образом). Физический смысл предэкспоненциального множителя A, который равен константе скорости реакции при температуре, стремящейся к бесконечности. Как видно из выражения, логарифм константы скорости линейно зависит от обратной температуры: Зная энергию активации реакции и константу скорости при какой-либо температуре T1, по уравнению Аррениуса можно рассчитать величину константы скорости при любой температуре T2:
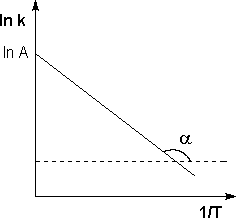
Рис. Зависимость логарифма константы скорости химической реакции от обратной температуры.
Величину энергии активации EA и логарифм предэкспоненциального множителя A можно определить графически (тангенс угла наклона прямой к оси абсцисс и отрезок, отсекаемый прямой на оси ординат).
![]()
При известных значениях константы скорости реакции при разных температурах:

Уравнение позволяет рассчитать энергию активации процесса по известным константам скорости при разных температурах.
