
- •Теоретические основы химии
- •Основные понятия и законы химии Атомно - молекулярное учение.
- •Закон сохранения массы веществ
- •Составление химических уравнений
- •Расчеты по химическим уравнениям
- •Закон постоянства состава
- •Закон кратных отношений
- •Закон объемных отношений
- •Закон Авогадро и молярный объем газа
- •Следствия.
- •Закон эквивалентов
- •Основные классы неорганических
- •2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
- •Основания
- •Получение оснований
- •Химические свойства оснований
- •Кислоты
- •Классификация кислот
- •Химические свойства кислот
- •Получение кислот
- •Средние соли
- •Химические свойства солей
- •Кислые соли
- •Графическое изображение формул
- •Энергетика химических реакций
- •Химическое равновесие. Константа химического равновесия
- •Энтропия
- •Энергия Гиббса направленность химических процессов
- •Примеры термодинамических расчетов
- •Полученные значения h и s характеризуют процесс испарения SnBr2. Процесс эндотермический, испарение требует нагревания. При испарении энтропия увеличивается.
- •Химическая кинетика. Скорость химической реакции
- •Молекулярность элементарных реакций
- •Уравнение Аррениуса
- •Катализ
- •Смещение химического равновесия
- •3 Влияние температуры на положение равновесия
- •Фазовые равновесия
- •Основные характеристики растворов
- •Растворимость газов в газах
- •Растворимость газов в жидкостях
- •Взаимная растворимость жидкостей
- •Растворимость твердых веществ в жидкостях
- •Растворы неэлектролитов
- •1. Давление насыщенного пара разбавленных растворов
- •2. Давление пара идеальных и реальных растворов
- •3. Температура кристаллизации разбавленных растворов
- •4. Температура кипения разбавленных растворов
- •5. Осмотическое давление разбавленных растворов
- •6. Понятие активности растворенного вещества
- •Слабые электролиты. Константа диссоциации
- •Сильные электролиты
- •PН растворов
- •Произведение растворимости
- •Гидролиз солей
- •Количественные характеристики процесса гидролиза соли.
- •Комплексные соединения
- •Направленность реакций в растворах электролитов
- •Протонная теория Брёнстеда-Лоури
- •В случае взаимодействия нейтральных молекулпродукт реакции (например bf3∙nh3) часто называют аддуктом.
- •Теория сольвосистем
- •Металлы, как типичные восстановители, окисляются до соединений, содержащих атомы металлов в более высоких степенях окисления, в зависимости от природы металла и характера среды:
- •Электродные потенциалы
- •Гальванические элементы
- •Электролиз
- •Законы электролиза
- •Примеры электролиза Расплавы
- •Растворы
- •Хими́ческие исто́чники то́ка
- •Коррозия металлов и методы защиты металлов от коррозии
- •Электрохимическая коррозия
- •Защита металлов от коррозии
- •Строение атома
- •Волновое уравнение. Квантовомеханическое объяснение строения атома
- •Электронная структура атомов и периодическая система элементов
- •Структура периодической системы элементов д.И. Менделеева.
- •Периодичность свойств химических элементов и их соединений
- •Ковалентная связь. Метод валентных связей
- •Способы образования ковалентной связи
- •Гибридизация атомных орбиталей
- •Метод молекулярных орбиталей
- •Ионная связь
- •Водородная связь
- •Квантовомеханические теории строения комплексных соединений
- •1. Теория валентных связей
- •2. Гибридизация орбиталей и структура комплексов
- •3. Теория кристаллического поля.
- •4. Цветность комплексных соединений
Полученные значения h и s характеризуют процесс испарения SnBr2. Процесс эндотермический, испарение требует нагревания. При испарении энтропия увеличивается.
Пример 4. Диссоциация нитрозилхлорида происходит по схеме 2(NOCl) = 2(NO) + (Cl2). Определить, при какой температуре Kр этой реакции равна 1. Чему равно парциальное давление Cl2, если общее давление в системе при равновесии составляет 2 атм?
Решение.
Запишем
уравнение реакции. Для каждого вещества,
участвующего в ней, выпишем из справочника
значения H и S
и S
2(NOCl) = 2(NO) + (Cl2)
H ,
кДж/моль 52,5 90,25 0
,
кДж/моль 52,5 90,25 0
S , Дж/(моль
К) 261,5 210,62 222,9.
, Дж/(моль
К) 261,5 210,62 222,9.
Рассчитаем
Н и S
и S :
:
Н = 2
90,25 + 0 – 2
52,25 = 75,5 кДж = 75 500 Дж;
= 2
90,25 + 0 – 2
52,25 = 75,5 кДж = 75 500 Дж;
S = 2
210,62 + 222,9 – 2
261,5 = 121,14 Дж/К.
= 2
210,62 + 222,9 – 2
261,5 = 121,14 Дж/К.
Из
равенства Н – 298
S
– 298
S = –R
298
lnKp
= 0 с учетом допущения о независимости
значений Н
= –R
298
lnKp
= 0 с учетом допущения о независимости
значений Н и S
и S от температуры
от температуры
рассчитаем искомую температуру, при которой Kp = 1 (ln1 = 0):
Т
=
 =
= = 623,2 К.
= 623,2 К.
Для
расчета парциального давления хлора
(pCl )
нужно использовать константу равновесия
указанного процесса Кр
и закон Дальтона.
)
нужно использовать константу равновесия
указанного процесса Кр
и закон Дальтона.
Кр
процесса имеет вид: Кр
=
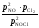 .
На основании закона ДальтонаРобщ
= рNOCl
+ pNO
+ pCl
.
На основании закона ДальтонаРобщ
= рNOCl
+ pNO
+ pCl .
.
Если
парциальное давление хлора принять за
х,
то парциальное давление NO
составит 2х,
так как из уравнения реакции следует,
что в состоянии равновесия на 1 моль
хлора образуется 2 моля NO,
поэтому парциальные давления компонентов
Cl2
и NO
тоже будут относиться как 1:2 (pNO
= 2pCl = 2х).
= 2х).
Парциальное
давление рNOCl
можно выразить через парциальные
давления pCl и pNO:
и pNO:
рNOCl
= Робщ
– (pNO
+ pCl )
= 2 – 3х.
)
= 2 – 3х.
Выражение константы равновесия запишется:
Kр
=
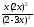 = 1; 1 =
= 1; 1 = .
.
Решая уравнение относительно х, получим х = 0,4595.
pCl = 0,4595 атм.
= 0,4595 атм.
Химическая кинетика. Скорость химической реакции
Методы и приемы химической термодинамики позволяют выяснить лишь принципиальную возможность осуществления химической реакции, условия ее вероятного протекания, определить полноту превращения реагирующих веществ в продукты реакции. Законы химической термодинамики позволяют определить направление и предел протекания возможного при данных условиях химического процесса, а также его энергетический эффект. Однако термодинамика не может ответить на вопросы о том, как осуществляется данный процесс и с какой скоростью. Эти вопросы – механизм и скорость химической реакции – и являются предметом химической кинетики.
Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций).
Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени.
Первое определение является наиболее строгим; из него следует, что скорость химической реакции можно также выражать как изменение во времени любого параметра состояния системы, зависящего от числа частиц какого-либо реагирующего вещества, отнесенное к единице объема или поверхности – электропроводности, оптической плотности, диэлектрической проницаемости и т.п. Однако наиболее часто в химии рассматривается зависимость концентрации реагентов от времени. В случае односторонних (необратимых) химических реакций очевидно, что концентрации исходных веществ во времени постоянно уменьшаются (ΔСисх < 0), а концентрации продуктов реакции увеличиваются (ΔСпрод > 0). Скорость реакции считается положительной, поэтому математически определение средней скорости реакции в интервале времени Δt записывается следующим образом:
![]()
Единицей измерения скорости является [моль/(дм3 с)]. В различных интервалах времени средняя скорость химической реакции имеет разные значения; истинная (мгновенная) скорость реакции определяется как производная от концентрации по времени:
![]()
Графическое изображение зависимости концентрации реагентов от времени есть кинетическая кривая (рисунок 1):

Рис. 1. Кинетические кривые для исходных веществ (А) и продуктов реакции (В).
Истинную скорость реакции можно определить графически, проведя касательную к кинетической кривой; истинная скорость реакции в данный момент времени равна по абсолютной величине тангенсу угла наклона касательной:

Рис. 2Графическое определение Vист.
![]()
Необходимо отметить, что в том случае, если стехиометрические коэффициенты в уравнении химической реакции неодинаковы, величина скорости реакции будет зависеть от того, изменение концентрации какого реагента определялось. Очевидно, что в реакции
2Н2 + О2 ––> 2Н2О
концентрации водорода, кислорода и воды изменяются в различной степени: ΔС(Н2) = ΔС(Н2О) = 2 ΔС(О2).
