
- •Теоретические основы химии
- •Основные понятия и законы химии Атомно - молекулярное учение.
- •Закон сохранения массы веществ
- •Составление химических уравнений
- •Расчеты по химическим уравнениям
- •Закон постоянства состава
- •Закон кратных отношений
- •Закон объемных отношений
- •Закон Авогадро и молярный объем газа
- •Следствия.
- •Закон эквивалентов
- •Основные классы неорганических
- •2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
- •Основания
- •Получение оснований
- •Химические свойства оснований
- •Кислоты
- •Классификация кислот
- •Химические свойства кислот
- •Получение кислот
- •Средние соли
- •Химические свойства солей
- •Кислые соли
- •Графическое изображение формул
- •Энергетика химических реакций
- •Химическое равновесие. Константа химического равновесия
- •Энтропия
- •Энергия Гиббса направленность химических процессов
- •Примеры термодинамических расчетов
- •Полученные значения h и s характеризуют процесс испарения SnBr2. Процесс эндотермический, испарение требует нагревания. При испарении энтропия увеличивается.
- •Химическая кинетика. Скорость химической реакции
- •Молекулярность элементарных реакций
- •Уравнение Аррениуса
- •Катализ
- •Смещение химического равновесия
- •3 Влияние температуры на положение равновесия
- •Фазовые равновесия
- •Основные характеристики растворов
- •Растворимость газов в газах
- •Растворимость газов в жидкостях
- •Взаимная растворимость жидкостей
- •Растворимость твердых веществ в жидкостях
- •Растворы неэлектролитов
- •1. Давление насыщенного пара разбавленных растворов
- •2. Давление пара идеальных и реальных растворов
- •3. Температура кристаллизации разбавленных растворов
- •4. Температура кипения разбавленных растворов
- •5. Осмотическое давление разбавленных растворов
- •6. Понятие активности растворенного вещества
- •Слабые электролиты. Константа диссоциации
- •Сильные электролиты
- •PН растворов
- •Произведение растворимости
- •Гидролиз солей
- •Количественные характеристики процесса гидролиза соли.
- •Комплексные соединения
- •Направленность реакций в растворах электролитов
- •Протонная теория Брёнстеда-Лоури
- •В случае взаимодействия нейтральных молекулпродукт реакции (например bf3∙nh3) часто называют аддуктом.
- •Теория сольвосистем
- •Металлы, как типичные восстановители, окисляются до соединений, содержащих атомы металлов в более высоких степенях окисления, в зависимости от природы металла и характера среды:
- •Электродные потенциалы
- •Гальванические элементы
- •Электролиз
- •Законы электролиза
- •Примеры электролиза Расплавы
- •Растворы
- •Хими́ческие исто́чники то́ка
- •Коррозия металлов и методы защиты металлов от коррозии
- •Электрохимическая коррозия
- •Защита металлов от коррозии
- •Строение атома
- •Волновое уравнение. Квантовомеханическое объяснение строения атома
- •Электронная структура атомов и периодическая система элементов
- •Структура периодической системы элементов д.И. Менделеева.
- •Периодичность свойств химических элементов и их соединений
- •Ковалентная связь. Метод валентных связей
- •Способы образования ковалентной связи
- •Гибридизация атомных орбиталей
- •Метод молекулярных орбиталей
- •Ионная связь
- •Водородная связь
- •Квантовомеханические теории строения комплексных соединений
- •1. Теория валентных связей
- •2. Гибридизация орбиталей и структура комплексов
- •3. Теория кристаллического поля.
- •4. Цветность комплексных соединений
Примеры термодинамических расчетов
Задача1. Возможен ли при стандартных условиях процесс взаимодействия азота и кислорода воздуха?
Решение.
Значение G можно рассчитать двумя способами.
Записываем уравнение реакции с указанием
агрегатного состояния веществ. Подписываем
под формулой каждого вещества значения
H
можно рассчитать двумя способами.
Записываем уравнение реакции с указанием
агрегатного состояния веществ. Подписываем
под формулой каждого вещества значения
H и S
и S ,
G
,
G ,
взятые из справочника:
,
взятые из справочника:
(N2) + (O2) = 2(NO)
H ,
кДж/моль 0 0 90,37
,
кДж/моль 0 0 90,37
S ,
Дж/(моль
К) 191,5 205,03 210,62
,
Дж/(моль
К) 191,5 205,03 210,62
G ,
кДж/моль 0 0 86,58.
,
кДж/моль 0 0 86,58.
1
способ.
Рассчитываем Н и S
и S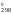 и приводим эти величины к одним единицам
измерения:
и приводим эти величины к одним единицам
измерения:
Н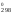 = 2H
= 2H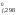 (NO)
– H
(NO)
– H (O2)
– H
(O2)
– H (N2)
= 2 90,37 – 0 – 0 = 180,74 кДж
= 180740 Дж;
(N2)
= 2 90,37 – 0 – 0 = 180,74 кДж
= 180740 Дж;
S = 2S
= 2S (NO)
– S
(NO)
– S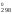 (O2)
– S
(O2)
– S (N2)
= 2
210,62 – 205,03 – 191,5 = 24,71 Дж/К.
(N2)
= 2
210,62 – 205,03 – 191,5 = 24,71 Дж/К.
G = Н
= Н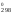 – ТS
– ТS = 180 740 – 298
24,71 = 173 376 Дж = 173,376 кДж.
= 180 740 – 298
24,71 = 173 376 Дж = 173,376 кДж.
2 способ. Изменение энергии Гиббса в ходе реакции можно также рассчитать, зная величины изменения энергии Гиббса образования веществ, участвующих в химическом процессе, по формуле
G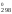 = 2G
= 2G (NO)
– G
(NO)
– G (N2)
– G
(N2)
– G (O2)
= 2 86,58 – 0 – 0 = 173,16 кДж.
(O2)
= 2 86,58 – 0 – 0 = 173,16 кДж.
Полученное значение практически совпадает с рассчитанным первым способом.
Так
как G
0, то процесс невозможен при стандартных
условиях.
0, то процесс невозможен при стандартных
условиях.
Взаимосвязь стандартной энергии Гиббса и константы равновесия выражается уравнением
G = –RTlnKp.
= –RTlnKp.
Пример 2. Определите давление разложения 3[Fe2O3] ⇄ ⇄ 2[Fe3O4] + ½(O2) при 627оС. При какой температуре давление кислорода достигнет 1 атм (101 325 Па)?
Решение.
Для определения давления разложения,
т. е. давления кислорода, который
образуется в данном процессе термического
разложения, надо вычислить Кр
= р при Т
= 627оС
= = 900 К.
при Т
= 627оС
= = 900 К.
Запишем
процесс и для всех веществ, участвующих
в реакции, выписываем из справочника
значения H и S
и S :
:
3[Fe2O3] ⇄ 2[Fe3O4] + ½(O2)
H ,кДж/моль
–821,22 –1117,71 0
,кДж/моль
–821,22 –1117,71 0
S ,
Дж/(моль
К) 89,96 151,46 205,03.
,
Дж/(моль
К) 89,96 151,46 205,03.
В соответствии со следствием из закона Гесса:
Н = 2H
= 2H [Fe3O4]
+ ½
H
[Fe3O4]
+ ½
H (O2)
– 3H
(O2)
– 3H [Fe2O3]
= = 2
(–1117,71) + ½
0 – 3(–821,22) = 228,54 кДж = 228 540 Дж;
[Fe2O3]
= = 2
(–1117,71) + ½
0 – 3(–821,22) = 228,54 кДж = 228 540 Дж;
S = 2
S
= 2
S [Fe3O4]
+ ½
S
[Fe3O4]
+ ½
S (O2)
– 3S
(O2)
– 3S [Fe2O3]
= 2
151,46 + + ½
205,03 – 3
89,96 = 135,555 Дж/К.
[Fe2O3]
= 2
151,46 + + ½
205,03 – 3
89,96 = 135,555 Дж/К.
Изменение стандартной энергии Гиббса при 900 К находим из соотношения:
Н – ТS
– ТS ,
(Н
,
(Н
Н
Н ,
S
,
S
S
S ).
).
G = Н
= Н – 900S
– 900S = 228 540 – 900
135,555 = 106 540,5 Дж.
= 228 540 – 900
135,555 = 106 540,5 Дж.
lgKp
=
 =
= = –6,1816;Kp
=
6,583
10–7.
= –6,1816;Kp
=
6,583
10–7.
Для
данного гетерогенного процесса Кр
= р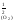 ,
отсюда
,
отсюда
Р(О )
= (Kp)2
= 4,334
10–13
атм.
)
= (Kp)2
= 4,334
10–13
атм.
Если давление кислорода равно 1 атм то
lgKp
= lg1 =lg1
= 0 и G
=lg1
= 0 и G = –19,15
Т
lgКp
= 0.
= –19,15
Т
lgКp
= 0.
Найдем
температуру, при которой G = 0:
= 0:
G = Н
= Н – ТS
– ТS = 0, отсюда
= 0, отсюда
Т
=
 =
= = 1686 К.
= 1686 К.
Следовательно, при температуре 1686 К, когда давление кислорода равно внешнему (1 атм), начнется разложение Fe2O3.
Пример
3.
Определить термодинамические
характеристики H и S
и S процесса испарения бромида олова (II).
Давление насыщенного пара SnBr2
при температуре 516оС
составляет 0,13 атм, а при 636оС
– 1 атм.
процесса испарения бромида олова (II).
Давление насыщенного пара SnBr2
при температуре 516оС
составляет 0,13 атм, а при 636оС
– 1 атм.
Решение.
Для процесса {SnBr2}
⇄ (SnBr2)
Kр
= РSnBr .
Константы равновесия связаны с
термодинамическими характеристиками
при разных температурах соотношениями:
.
Константы равновесия связаны с
термодинамическими характеристиками
при разных температурах соотношениями:

Kp = Р1
SnBr
= Р1
SnBr = 0,13 атм, Kp
= 0,13 атм, Kp = Р2
SnBr
= Р2
SnBr = 1 атм.
= 1 атм.
T1
= 516 + 273 = 789 К, T2
= 909 К. Так как ln1
= 0, то из второго уравнения можно выразить
H через S
через S (H
(H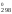 = 909S
= 909S )
и подставить в первое уравнение:
)
и подставить в первое уравнение:
–8,314
789
ln0,13 = 909S – 789S
– 789S = 120S
= 120S ;
;
S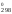 =
=
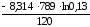 = 111,55 Дж/К.
= 111,55 Дж/К.
Тогда
H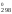 = 909S
= 909S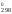 = 909
111,55 = 101 400 Дж
= 101,4 кДж.
= 909
111,55 = 101 400 Дж
= 101,4 кДж.
