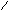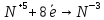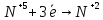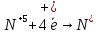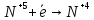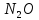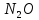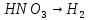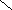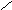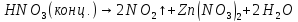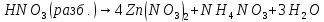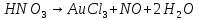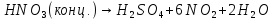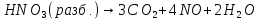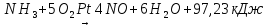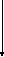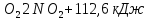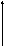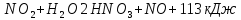- •Неорганическая химия наука о природе
- •Природные явления
- •Чистые вещества и смеси
- •Химический элемент
- •Химический символ обозначает
- •Химический состав
- •Химическая формула и расчет по формулам
- •Схемы строения атомов химических элементов побочных подгрупп
- •Периодичность изменения химических и физических свойств элементов главных подгрупп
- •Валентность
- •Составление химических формул по валентности
- •Электроотрицательность
- •Относительная электроотрицательность химических элементов
- •Степень окисления
- •Химическая связь
- •Типы кристаллических решеток
- •Взаимосвязь основных химических понятий
- •Свойства и применение кислорода
- •Классификация сложных неорганических веществ
- •Генетические связи между классами неорганических веществ
- •Классификация кислот
- •Номенклатура кислот и средних солей
- •Химические свойства сложных неорганичеких веществ
- •Примеры уравнений химических реакций
- •Химические свойства воды ()
- •Очистка воды
- •Растворы
- •Растворимость веществ
- •Количество растворенного вещества
- •Концентрации растворов
- •Химические реакции классификация химических реакций
- •Окислительно-восстановительные реакции
- •Составление уравнений окислительно-восстановительных реакций методом электронного баланса
- •Форма записи о.В.Р.
- •Гидролиз солей количественные соотношения при химических реакциях
- •2. Кислоты, основания, амфотерные
- •3. Реакции ионного обмена
- •Металлы
- •1. Ме — химический элемент
- •2. Ме — простое вещество
- •3. Химические свойства металлов
- •Промышленные способы получения металлов
- •Электрохимический ряд напряжений металлов
- •Электролиз
- •Применение электролиза
- •Металлы I группы главной подгруппы (щелочные) Сравнительная характеристика химических элементов
- •Сравнительная характеристика физических свойств простых веществ
- •Металлы II группы главной подгруппы (щелочно-земельные) Сравнительная характеристика химических элементов
- •Сравнительная характеристика физических свойств простых веществ
- •Характер соединений оксидов ме
- •II группы главной подгруппы
- •Жесткость воды
- •Элементы III группы главной подгруппы Сравнительная характеристика химических элементов
- •Сравнительная характеристика физических свойств простых веществ
- •Неметаллы
- •1. НеМе—химический элемент
- •2. НеМе — простое вещество
- •Углерод (с). Аллотропия углерода (с)
- •Угольная кислота
- •Соли угольной кислоты
- •Аллотропия кремния
- •Соединения кремния (si)
- •Силикатная промышленность
- •Простые вещества, образованные элементами
- •V группы главной подгруппы
- •Азот — простое вещество
- •Получение азота (n2)
- •Синтез аммиака в промышленности
- •Получение аммиака в лаборатории
- •Химические свойства
- •Оксиды азота (n)
- •Азотная кислота
- •Нитраты
- •Аллотропия форфора (р)
- •Химические свойства фосфора (р)
- •Соединения фосфора (р)
- •Фосфорная кислота
- •Элементы VI группы главной подгруппы
- •Простые вещества элементов VI группы главной подгруппы
- •Аллотропия кислорода ("о")
- •Аллотропия серы (s)
- •Соединения серы (s)
- •Кислоты серы (s)
- •Производство
- •Элементы VII группы главной подгруппы (галогены) Сравнительная характеристика химических элементов
- •Простые вещества элементов VII группы главной подгруппы
- •Химические свойства простых веществ на примере
- •Соляная кислота (hCl)
- •Химические свойства соляной кислоты
- •Медь (Cu) — представитель химических элементов побочных подгрупп
- •Железо (Fe) — представитель химических элементов побочных подгрупп
- •Железо (Fe) — простое вещество
- •Химические свойтсва () — восстановитель
- •Соединения железа в степени окисления
- •Производство чугуна
- •Производство стали
- •Способы получения стали
- •Реакции, лежащие в основе производства стали кислородно-конвертерным и мартеновским способами
- •Хром (Cr) — представитель химических элементов побочных подгрупп
- •Хром (Cr) — простое вещество
- •Химические свойства Cro
- •Соединения хрома (Cr)
Оксиды азота (n)
|
|
+
|
+2 NO |
+2
|
+4
|
+5
| ||||
|
Агрегатное состояние |
Несолеобразующие |
Солеобразующие | |||||||
|
газ |
газ |
газ → жидкость |
газ |
твердый | |||||
|
Молекула |
–1 +3 –2 N=N=O малополярна |
|
стабильная ONONO — менее устойчивая ———————— очень неустойчива |
+4
O ∙N O O
+5
+3
N—O—N=O O
|
————————— неустойчива | ||||
|
Получение |
|
3000
при грозовом разряде
|
охл.
|
(в лаборатории) |
| ||||
|
Физические свойства |
Бесцветный, с приятным запахом, хорошо растворим в воде toпл.=–91 toкип.=–89 |
Бесцветный, не летуч, маллорастворим в воде, не поддерживает горение toпл.=–163,6 toкип.=–151,7 |
Бесцветный
(в жидком состоянии — синий,
в твердом — белые кристаллы).
Растворяется в воде — является
ангидридом азотистой кислоты ( toкип.=+3,5 |
Бурый, растворяется в воде и является смешанным ангидридом: азотной и азотистой кислот toкип.=+21 toпл.=–11 |
Растворяется
в воде, является ангидридом азотной
кислоты ( toпл.=32,3 | ||||
|
|
2 2
взрывается |
NO — окислитель 2NO+2 NO+2 NO — восстановитель 2NO+ 2NO+ NO+2 |
восстановитель |
–11
сгущается тв в красную жидкость
окислитель 2
|
надазотная кислота 2 не уст. | ||||
|
Применение |
В медицине — как болеутоляющее, наркотическое средство (воздух
+ 20%
|
|
красителей |
|
| ||||
Азотная кислота
|
O
N—O—N O |
Формула |
|
Безводная
при
хранении желтеет, tкип.=82,6
tпл.=–41,6 Хорошо растворяется в воде. В растворе
|
Физические свойства |
|
Общие с другими кислотами
2
2 |
Химические свойства |
|
Характерные
для
(разб.)
Li-K-Ca-Na-Mg-Al-Zn-Cr-Fe-Ni-Sn-Pb-(H2)-Cu-Hg-Ag-Pt-Au
(конц.) пассивируются
|
Продолжение
|
Ме
+
Zn
+ 4
4Zn
+ 10
Au
+ 3HCl +
(Pt) (Pt) "царская водка"
3C
+ 4 |
Химические свойства |
|
1.
4
P 4.
4 P=5МПа
Р 2.
2NO
+
(газ)
(газ) Р=1МПа
3.
3
(газ)
(ж) замкнутый цикл
|
Получение |

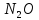
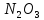
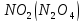
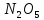
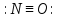
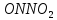 —
—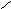

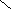
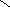




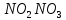 —в кристаллах
—в кристаллах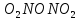 —в парах
—в парах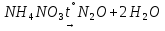

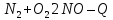 —
—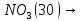
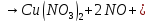
 —в лаборатории
—в лаборатории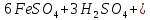
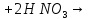
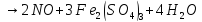 —в промышленности
—в промышленности
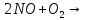
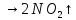 (в промышленности)
(в промышленности)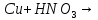
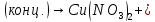
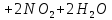

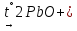
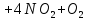
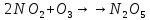 +
+
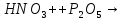
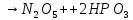 (в лаборатории)
(в лаборатории)



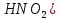



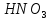 )
)
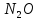 —окислитель
—окислитель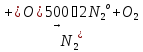
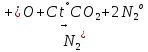
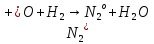



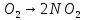
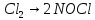
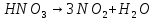
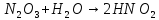 —азотистая
кислота (известна только в растворе)
—азотистая
кислота (известна только в растворе)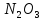
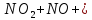
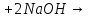
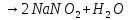
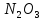 —окислитель
—окислитель

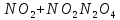
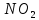 —синий
—синий
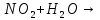
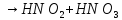
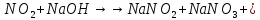
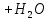
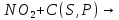 взрывчатая
смесь с парами органических веществ
взрывчатая
смесь с парами органических веществ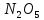 —очень
сильный окислитель
—очень
сильный окислитель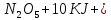
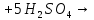
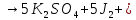
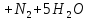
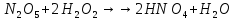
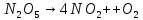
 )
)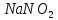 —в произодстве
—в произодстве



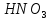 —
бесцветная жидкость,
—
бесцветная жидкость, 

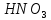 —
сильная кислота, окислитель.
—
сильная кислота, окислитель.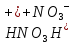
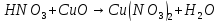
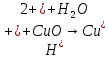
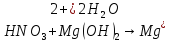
 +C
+C
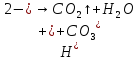
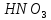
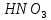
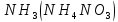 NO
NO