
- •М о д у л ь 1. Основні поняття і закони хімії т е м а 1 (вступна). Основні поняття і закони хімії.
- •1.4. Список рекомендованої літератури
- •2.1. Рекомендації до вивчення теоретичного матеріалу
- •2.4. Лабораторна робота
- •2.5. Список рекомендованої літератури
- •3.1.Рекомендації до вивчення теоретичного матеріалу
- •3.2. Приклади розвязування типових задач
- •3.3. Задачі для самостійного рішення: 182, 183, 190, 208
- •3.4. Лабораторна робота
- •3.5. Список рекомендованої літератури
- •4.1. Рекомендації до вивчення теоретичного матеріалу
- •4.2. Приклади розвязування типових задач.
- •4.3. Задачі для самостійного рішення: 720, 724, 736
- •4.4. Лабораторна робота
- •Дослід 3. Утворення сольватокомплексів
- •Дослід 6. Стійкість комплексів
- •4.5. Список рекомендованої літератури
- •М о д у л ь 2. Основні закономірності протікання хімічних реакцій т е м а 5. Енергетика хімічних процесів
- •5.1. Рекомендації до вивчення теоретичного матеріалу
- •5.2. Приклади розвязування типових задач
- •Розв’язок: Температуру початку реакції розрахуємо за формулою:
- •5.3. Задачі для самостійного рішення: № 283, 285, 303, 311
- •5.4. Лабораторна робота
- •5.5. Список рекомендованої літератури
- •Тема 6. Швидкість протікання хімічних реакцій та хімічна рівновага
- •6.2.Приклади розвязування типових задач
- •6.3. Задачі для самостійного рішення: 330, 332, 334, 352
- •6.4. Лабораторна робота
- •Загальні вказівки
- •М о д у л ь 3. Розчини т е м а 7. Розчинність. Способи вираження концентрації
- •8.1. Рекомендації до вивчення теоретичного матеріалу
- •8.3. Задачі для самостійного розвязування: 1030, 1031, 1035, 1037
- •8.4. Лабораторна робота
- •8.5. Список рекомендованої літератури
- •Т е м а 9. Властивості розчинів. Рівноваги у розчинах електролітів
- •9.1. Рекомендації до вивчення теоретичного матеріалу
- •9.2. Приклади розвязування типових задач
- •9.3. Задачі для самостійного рішення: № 516, 544, 586
- •9.4. Лабораторна робота
- •9.5. Список рекомендованої літератури
- •Тема 10. Окисно-відновні реакції
- •10.1. Рекомендації до вивчення теоретичного матеріалу
- •10.2. Приклади рішення типових задач
- •10.3. Задачі для самостійного рішення: 624, 625, 626, 640
- •10.4. Лабораторна робота
- •10.5. Список рекомендованої літератури
- •М о д у л ь 4. Електрохімічні процеси
- •Т е м а 11. Гальванічні елементи
- •11.1. Рекомендації до вивчення теоретичного матеріалу
- •11.2. Приклади розвязування типових задач
- •1.3. Задачі для самостійного рішення: 658, 660, 661
- •11.4. Лабораторна робота
- •11.5. Список рекомендованої дітератури
- •12.1. Рекомендації до вивчення теоретичного матеріалу
- •12.2. Приклади розв’язку типових задач
- •12.4. Лабораторна робота
- •12.5. Список рекомендованої літератури
- •13.1. Рекомендації до вивчення теоретичного матеріалу
- •13.2. Приклади рішення типових задач
- •13.3. Задачі для самостійного рішення 689, 690, 695, 709
- •13.4. Лабораторна робота
- •13.5. Список рекомендованої літератури
- •Тема 14. Властивості неметалів viiа групи (f, Cl, Br, I)
- •14.1. Рекомендації до вивчення теоретичного матеріалу
- •14.2. Приклади розв’язку типових задач
- •14.3. Задачі для самостійного розв’язування: 823, 824, 831.
- •14.4. Лабораторна робота
- •14.5. Список рекомендованої літератури
- •Тема 15. Властивості неметалів viа групи (o, s, Se, Te)
- •15.1 Рекомендації до вивчення теоретичного матеріалу
- •15.2. Приклади розв’язку типових задач
- •15.3. Задачі для самостійного розв’язку
- •15.4. Лабораторна робота
- •15.5. Список рекомендованої літератури
- •Тема 16. Властивості неметалів vа групи (n, p, As, Sb)
- •16.1. Рекомендації до вивчення теоретичного матеріалу
- •16.2. Приклади розв’язування типових задач
- •16.3. Задачі для самостійного розв’язку: 901, 902, 917
- •16.4. Лабораторна робота
- •Дослід 8. Гідроліз фосфатів
- •16.5. Список рекомендованої літератури
- •Тема 17. Властивості неметалів іvа групи (с, Sі)
- •17.1. Рекомендації до вивчення теоретичного матеріалу
- •17.2. Приклади розв’язування типових задач
- •17.3. Задачі для самостійного розв`язку: № 944, 949, 964.
- •17.4. Лабораторна робота
- •17.5. Список рекомендованої літератури
- •М о д у л ь 5. Властивості конструкційних і інструментальних металів і їхніх сполук. Полімерні матеріали
- •18.1. Рекомендації до вивчення теоретичного матеріалу
- •18.2. Приклади розвязування типових задач
- •18.3. Задачі для самостійного рішення: 1009, 1051, 1053
- •18.4. Лабораторна робота
- •Дослід 6. Окисно-відновні властивості сполук титана
- •Дослід 7. Електрохімічне оксидування (анодирування) алюмінію (елементи ндрс)
- •Сполуки водних розчинів для фарбування анодируваного алюмінію
- •18.5. Список рекомендованої літератури
- •Т е м а 19. Властивості заліза, кобальту, нікелю
- •19.1. Рекомендації до вивчення теоретичного матеріалу
- •19.2. Приклади розвязування типових задач
- •19.3. Задачі для самостійного рішення: 1113,1114, 1117, 1118
- •19.4. Лабораторна робота
- •19.5. Список рекомендованої літератури
- •Т е м а 20. Властивості металів підгрупи Cr і Mn і їх сполук
- •20.1. Рекомендації до вивчення теоретичного матеріалу
- •20.2. Приклади розвязування типових задач
- •20.3. Задачі для самостійного рішення: 1084, 1096, 1097
- •20.4. Лабораторна робота
- •20.5. Список рекомендованої літератури
- •21. Властивості металів vb групи (підгрупи ванадію)
- •21.1 Рекомендації до вивчення теоретичного матеріалу
- •21.2. Приклади розв’язування типових задач
- •21.3. Задачи для самостійного розв’язування : №1081, 1082
- •21.4. Лабораторна робота
- •21.5. Список рекомендованої літератури
- •22.1. Рекомендації до вивчення теоретичного матеріалу
- •22.2. Приклади розвязування типових задач
- •22.3. Задачі для самостійного рішення: 1071, 1072, 1077
- •2.4. Лабораторна робота
- •Дослід 3. Окисно-відновні властивості сполук станума і плюмбума
- •Дослід 6. Електролітичне лудіння (з елементами ндрс)
- •22.5. Список рекомендованої літератури
- •Т е м а 23. Властивості конструкційних металів ib і iib груп
- •23.1. Рекомендації до вивчення теоретичного матеріалу
- •23.2. Приклади розвязування типових задач
- •22.3. Задачі для самостійного рішення 995, 984, 1025
- •23.4. Лабораторна робота
- •23.5. Список рекомендованої літератури
- •24.1. Рекомендації до вивчення теоретичного матеріалу
- •24.2. Лабораторна робота
- •24.3. Список рекомендованої літератури
- •Питання до колоквіуму за темами «Будова атома. Періодичний закон. Властивості елементів. Хімічний зв'язок. Комплексні сполуки. Типи взаємодії молекул»
- •Тиск водяної пари при різних температурах
- •Добуток розчинності (др) важкорозчинних сполук (25оС)
- •Індивідуальні завдання до теми «Основні поняття і закони хімії»
- •Індивідуальні завдання до теми : "Електролітична дисоціація, рН, гідроліз солей"
- •Тема 1. (вступна). Основні поняття і закони хімії
- •Тема 2. Закон еквівалентів…………………………………………………………………....7
- •Тема 3. Будова атома. Періодичний закон. Властивості елементів..................................10
- •Тема 4. Хімічний зв'язок. Комплексні сполуки……………………….....................................15
- •Тема 5. Енергетика хімічних процесів………………………………….................................21
- •Тема 6. Швидкість хімічних реакцій і хімічна рівновага……................................................29
- •Тема 7. Розчинність. Способи вираження концентрації……………..................................33
- •Тема 18. Властивості легких конструкційних металів
18.3. Задачі для самостійного рішення: 1009, 1051, 1053
18.4. Лабораторна робота
Необхідні прилади, устаткування і реактиви: порошокMg, стружкаAlіTi, гранулиZn, розчини лугів, розведених і концентрованих кислот (HCl,HNO3,H2SO4), розчиниK2Cr2O7, FeCl3іKMnО4, електролізер.
Дослід 1. Відношення Mg, Al і Ti до води
а) у 3 пробірки наливають по 3 мл води, 1 краплі фенолфталеїну і вносять в одну пробірку небагато порошку магнію, в іншу – стружку алюмінію, у третю – стружку титану. На холоді жоден із зазначених металів не витісняє водень з води, тому вміст трьох пробірок нагрівають до кипіння. Відзначають появу рожевого забарвлення в одній із пробірок (який?) Складають рівняння реакції, що протікає.
У висновку вкажіть:чому з водою реагує тільки один із трьох металів?
б) Пробірки охолоджують, додають у кожну декілька крапель насиченого розчинуNaClі трохи підігрівають. Що відбувається в пробірці з алюмінієм? Яку роль виконують хлорид-іони?
Дослід 2. Відношення Mg, Al і Ti до лугів
У три пробірки поміщають відповідні метали і доливають у кожну близько 2 мл 2н. розчину NaOH чи KOH. Відзначають виділення водню тільки в пробірці з алюмінієм. Пробірки підігрівають. Відзначають, чи відбулися зміни. Доданий луг розчиняє оксидну плівку з утворенням гідроксоалюмінату і дає можливість взаємодіяти алюмінію з водою. Схема взаємодії:
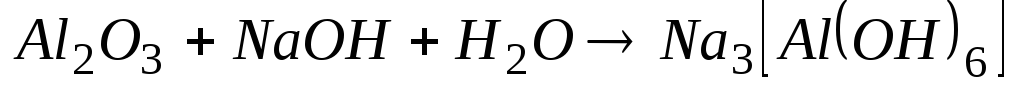 ; 2)
; 2) ;
;
3)
![]() .
.
Підберіть коефіцієнти до даних рівнянь.
Дослід 3. Відношення Mg,AlіTiдо кислот
а) взаємодія металів з розведеними кислотами.(Дослід проводять під тягою).
У чотири пробірки наливають по 1-2 мл розчинів розведених соляної, сірчаної, азотної й оцтової кислот. У кожну з них поміщають невелику кількістьпорошку магнію.
Аналогічний дослід повторюють з алюмінієм і титаном. Якщо реакції не проходять на холоді, пробірки обережно підігрівають. Відзначають виділення газоподібних продуктів у кожному з випадків. Записують рівняння реакцій, з урахуванням того, що титан окиснюється доTi(3+). Азотна кислота пасивує титан, утворюючи на його поверхні міцну оксидну плівку. При її ушкодженні титан окиснюється до метатитановой кислотиH2TiО3;
б) взаємодія металів з концентрованими кислотами.(Дослід проводять під тягою).
Виконують дослід, аналогічний досліду 3а, замінивши розведені кислоти концентрованими. Відзначають протікання реакцій на холоді і при нагріванні.
Записують рівняння реакцій, що протікають, ураховуючи, що з концентрованою сірчаною кислотою утворюється сіль Ti(4+), а алюміній пасивується концентрированою HNO3.
У висновку вкажіть:від яких факторів залежать продукти відновлення азотної і сірчаної кислот?
Дослід 4. Одержання і визначення властивостей гідроксидів Be2+, Mg2+, Al3+
У 4 пробірки доливають по 2-3 мл розчинів солей відповідних металів (Be2+,Mg2+,Al3+,Ti2+). Потім додають у кожну пробірку по краплях луг – 2н. розчин NaOH до випадіння осадів гідроксидів. Осади, що випали, поділяють на 2 частині. До першого додають по краплях 2 н. розчинHClдо другого – розчинNaOH. Відзначають розчинення осадів у випадку гідроксидів Ве (2+) іAl(3+). У випадку Ті (4+) випадає гідроксид оксотитануTiО(OH)2, що розчиняється в кислоті при нагріванні і не розчиняється у водних розчинах лугів. Записують рівняння відповідних реакцій.
У висновку вкажіть:кислотні, основні чи амфотерні властивості виявляють досліджувані гідроксиди?
Дослід 5. Відбудовні властивості Mg і Al
У дві пробірки з розчинами K2Cr2O7і КМnО4додають по 1 млH2SO4і вносять небагато стружкиMg.
Спостерігають зміну первісного
забарвлення розчинів. Складають рівняння
реакції, використовуючи електронно-іонний
метод, з урахуванням того, що
![]() відновлюється до
відновлюється до
![]() ,
а
,
а
![]() окислюється до
окислюється до
![]() .
Виконують аналогічні досліди з порошком
алюмінію. Складають рівняння реакцій.
.
Виконують аналогічні досліди з порошком
алюмінію. Складають рівняння реакцій.
