
- •М о д у л ь 1. Основні поняття і закони хімії т е м а 1 (вступна). Основні поняття і закони хімії.
- •1.4. Список рекомендованої літератури
- •2.1. Рекомендації до вивчення теоретичного матеріалу
- •2.4. Лабораторна робота
- •2.5. Список рекомендованої літератури
- •3.1.Рекомендації до вивчення теоретичного матеріалу
- •3.2. Приклади розвязування типових задач
- •3.3. Задачі для самостійного рішення: 182, 183, 190, 208
- •3.4. Лабораторна робота
- •3.5. Список рекомендованої літератури
- •4.1. Рекомендації до вивчення теоретичного матеріалу
- •4.2. Приклади розвязування типових задач.
- •4.3. Задачі для самостійного рішення: 720, 724, 736
- •4.4. Лабораторна робота
- •Дослід 3. Утворення сольватокомплексів
- •Дослід 6. Стійкість комплексів
- •4.5. Список рекомендованої літератури
- •М о д у л ь 2. Основні закономірності протікання хімічних реакцій т е м а 5. Енергетика хімічних процесів
- •5.1. Рекомендації до вивчення теоретичного матеріалу
- •5.2. Приклади розвязування типових задач
- •Розв’язок: Температуру початку реакції розрахуємо за формулою:
- •5.3. Задачі для самостійного рішення: № 283, 285, 303, 311
- •5.4. Лабораторна робота
- •5.5. Список рекомендованої літератури
- •Тема 6. Швидкість протікання хімічних реакцій та хімічна рівновага
- •6.2.Приклади розвязування типових задач
- •6.3. Задачі для самостійного рішення: 330, 332, 334, 352
- •6.4. Лабораторна робота
- •Загальні вказівки
- •М о д у л ь 3. Розчини т е м а 7. Розчинність. Способи вираження концентрації
- •8.1. Рекомендації до вивчення теоретичного матеріалу
- •8.3. Задачі для самостійного розвязування: 1030, 1031, 1035, 1037
- •8.4. Лабораторна робота
- •8.5. Список рекомендованої літератури
- •Т е м а 9. Властивості розчинів. Рівноваги у розчинах електролітів
- •9.1. Рекомендації до вивчення теоретичного матеріалу
- •9.2. Приклади розвязування типових задач
- •9.3. Задачі для самостійного рішення: № 516, 544, 586
- •9.4. Лабораторна робота
- •9.5. Список рекомендованої літератури
- •Тема 10. Окисно-відновні реакції
- •10.1. Рекомендації до вивчення теоретичного матеріалу
- •10.2. Приклади рішення типових задач
- •10.3. Задачі для самостійного рішення: 624, 625, 626, 640
- •10.4. Лабораторна робота
- •10.5. Список рекомендованої літератури
- •М о д у л ь 4. Електрохімічні процеси
- •Т е м а 11. Гальванічні елементи
- •11.1. Рекомендації до вивчення теоретичного матеріалу
- •11.2. Приклади розвязування типових задач
- •1.3. Задачі для самостійного рішення: 658, 660, 661
- •11.4. Лабораторна робота
- •11.5. Список рекомендованої дітератури
- •12.1. Рекомендації до вивчення теоретичного матеріалу
- •12.2. Приклади розв’язку типових задач
- •12.4. Лабораторна робота
- •12.5. Список рекомендованої літератури
- •13.1. Рекомендації до вивчення теоретичного матеріалу
- •13.2. Приклади рішення типових задач
- •13.3. Задачі для самостійного рішення 689, 690, 695, 709
- •13.4. Лабораторна робота
- •13.5. Список рекомендованої літератури
- •Тема 14. Властивості неметалів viiа групи (f, Cl, Br, I)
- •14.1. Рекомендації до вивчення теоретичного матеріалу
- •14.2. Приклади розв’язку типових задач
- •14.3. Задачі для самостійного розв’язування: 823, 824, 831.
- •14.4. Лабораторна робота
- •14.5. Список рекомендованої літератури
- •Тема 15. Властивості неметалів viа групи (o, s, Se, Te)
- •15.1 Рекомендації до вивчення теоретичного матеріалу
- •15.2. Приклади розв’язку типових задач
- •15.3. Задачі для самостійного розв’язку
- •15.4. Лабораторна робота
- •15.5. Список рекомендованої літератури
- •Тема 16. Властивості неметалів vа групи (n, p, As, Sb)
- •16.1. Рекомендації до вивчення теоретичного матеріалу
- •16.2. Приклади розв’язування типових задач
- •16.3. Задачі для самостійного розв’язку: 901, 902, 917
- •16.4. Лабораторна робота
- •Дослід 8. Гідроліз фосфатів
- •16.5. Список рекомендованої літератури
- •Тема 17. Властивості неметалів іvа групи (с, Sі)
- •17.1. Рекомендації до вивчення теоретичного матеріалу
- •17.2. Приклади розв’язування типових задач
- •17.3. Задачі для самостійного розв`язку: № 944, 949, 964.
- •17.4. Лабораторна робота
- •17.5. Список рекомендованої літератури
- •М о д у л ь 5. Властивості конструкційних і інструментальних металів і їхніх сполук. Полімерні матеріали
- •18.1. Рекомендації до вивчення теоретичного матеріалу
- •18.2. Приклади розвязування типових задач
- •18.3. Задачі для самостійного рішення: 1009, 1051, 1053
- •18.4. Лабораторна робота
- •Дослід 6. Окисно-відновні властивості сполук титана
- •Дослід 7. Електрохімічне оксидування (анодирування) алюмінію (елементи ндрс)
- •Сполуки водних розчинів для фарбування анодируваного алюмінію
- •18.5. Список рекомендованої літератури
- •Т е м а 19. Властивості заліза, кобальту, нікелю
- •19.1. Рекомендації до вивчення теоретичного матеріалу
- •19.2. Приклади розвязування типових задач
- •19.3. Задачі для самостійного рішення: 1113,1114, 1117, 1118
- •19.4. Лабораторна робота
- •19.5. Список рекомендованої літератури
- •Т е м а 20. Властивості металів підгрупи Cr і Mn і їх сполук
- •20.1. Рекомендації до вивчення теоретичного матеріалу
- •20.2. Приклади розвязування типових задач
- •20.3. Задачі для самостійного рішення: 1084, 1096, 1097
- •20.4. Лабораторна робота
- •20.5. Список рекомендованої літератури
- •21. Властивості металів vb групи (підгрупи ванадію)
- •21.1 Рекомендації до вивчення теоретичного матеріалу
- •21.2. Приклади розв’язування типових задач
- •21.3. Задачи для самостійного розв’язування : №1081, 1082
- •21.4. Лабораторна робота
- •21.5. Список рекомендованої літератури
- •22.1. Рекомендації до вивчення теоретичного матеріалу
- •22.2. Приклади розвязування типових задач
- •22.3. Задачі для самостійного рішення: 1071, 1072, 1077
- •2.4. Лабораторна робота
- •Дослід 3. Окисно-відновні властивості сполук станума і плюмбума
- •Дослід 6. Електролітичне лудіння (з елементами ндрс)
- •22.5. Список рекомендованої літератури
- •Т е м а 23. Властивості конструкційних металів ib і iib груп
- •23.1. Рекомендації до вивчення теоретичного матеріалу
- •23.2. Приклади розвязування типових задач
- •22.3. Задачі для самостійного рішення 995, 984, 1025
- •23.4. Лабораторна робота
- •23.5. Список рекомендованої літератури
- •24.1. Рекомендації до вивчення теоретичного матеріалу
- •24.2. Лабораторна робота
- •24.3. Список рекомендованої літератури
- •Питання до колоквіуму за темами «Будова атома. Періодичний закон. Властивості елементів. Хімічний зв'язок. Комплексні сполуки. Типи взаємодії молекул»
- •Тиск водяної пари при різних температурах
- •Добуток розчинності (др) важкорозчинних сполук (25оС)
- •Індивідуальні завдання до теми «Основні поняття і закони хімії»
- •Індивідуальні завдання до теми : "Електролітична дисоціація, рН, гідроліз солей"
- •Тема 1. (вступна). Основні поняття і закони хімії
- •Тема 2. Закон еквівалентів…………………………………………………………………....7
- •Тема 3. Будова атома. Періодичний закон. Властивості елементів..................................10
- •Тема 4. Хімічний зв'язок. Комплексні сполуки……………………….....................................15
- •Тема 5. Енергетика хімічних процесів………………………………….................................21
- •Тема 6. Швидкість хімічних реакцій і хімічна рівновага……................................................29
- •Тема 7. Розчинність. Способи вираження концентрації……………..................................33
- •Тема 18. Властивості легких конструкційних металів
10.5. Список рекомендованої літератури
Глинка Н.Л. Общая химия. – Л.: Химия, 1988. – С.255-266.
Глинка Н.Л. Задачи и упражнения по общей химии. – Л.: Химия, 1985. – С. 161-182.
Курс общей химии / Под ред. Коровина А.В. – М.: Высш. шк., 1985. – С.185-190.
Фролов В.В. Химия. – М.: Высш. шк., 1986. – С.225-229.
Ахметов Н.С. Общая и неорганическая химия. – М.: Высш. шк., 1981.-С.214-222 (2001. – С. 234 – 244).
6. Кириченко В.І. Загальна хімія: Навч. посіб.- К.: Вища шк., 2005. – С. 285-310.
М о д у л ь 4. Електрохімічні процеси
Електрохіміявивчає велику область фізико-хімічних процесів, що умовно можна розділити на дві групи:
явища, пов'язані з виникненням різниці потенціалів і одержанням електричної енергії за рахунок окисно-відновної реакції (хімічні джерела струму);
здійснення окисно-відновної реакції й одержання речовин за рахунок витрати електричної енергії (електроліз).
До першої групи явищ слід віднести й електрохімічну корозію, оскільки механізм виникнення корозійних струмів має ту ж природу, що і механізм одержання електричного струму в гальванічних елементах.
Ці теми найбільше глибоко і повно розглянуто в підручниках В.В.Фролова, Кириченко В.І., Коровіна А.В. Крім того, по окремим питанням електрохімії надрукована численна додаткова література. У курсі загальної хімії для нехімічних спеціальностей зазначені явища розглядаються при вивченні наступних тем: «Гальванічні елементи», «Корозія металів і захист від корозії», «Електроліз».
Т е м а 11. Гальванічні елементи
11.1. Рекомендації до вивчення теоретичного матеріалу
Гальванічні елементи (ГЕ) – це системи або пристрії, в яких енергія гетерогенних окисно-відновних реакцій перетворюється в енергію електричну. В основі роботи всіх ГЕ лежить явище виникнення потенціалу на межі метал – електроліт. Варто уважно вивчити по підручнику особливості процесу виникнення електродного потенціалу, звернувши увагу на фактори, що впливають на його величину (температура, концентрація розчину електроліту, матеріал електрода ін.). Цілком зрозуміло, що різні по природі метали мають різну електролітичну пружність розчинення (тобто здатність посилати свої іони в розчин). Звідси випливає, що за однакових умов величина електродних потенціалів різних металів буде різна. Вперше залежність величини електродного потенціалу (Е) від різних факторів визначено В.Нернстом (1888 р.):
Е
= ![]() ,
,
де R-
універсальна газова стала; Т - абсолютна
температура (К); n-
число електронів у реакції окиснення
металу; F – стала Фарадея; с
і сo
- концентрація іона
метала в глибині розчину і на поверхні
електроду. Концентрацію
сo
неможливо визначити точно; звідси
випливає, що абсолютне значення
електродного потенціалу визначити
неможливо. На практиці визначають
різницю потенціалів, тобто потенціал
даного електрода відносно іншого
електрода, потенціал якого прийнятий
за стандарт. Найчастіше таким стандартним
електродом виступає нормальний
(стандартний) водневий електрод, потенціал
якого прийнятий за 0 В. У цьому випадку
величину електродних потенціалів (Е)
можна обчислити по рівнянню
Нернста: Е = Е0
+
![]() або в спрощеному виді Е
= Е0
+
або в спрощеному виді Е
= Е0
+
![]() ,
(де Е0
– стандартний електродний потенціал
металу – табличні дані; R
– універсальна газова стала; Т
– абсолютна температура (К), n
– число електронів у реакції окиснення
металу, F
– стала Фарадея; а
,
(де Е0
– стандартний електродний потенціал
металу – табличні дані; R
– універсальна газова стала; Т
– абсолютна температура (К), n
– число електронів у реакції окиснення
металу, F
– стала Фарадея; а![]() -активність металу: а
-активність металу: а![]() = f
С
= f
С![]() (f – коефіцієнт
активності)).
(f – коефіцієнт
активності)).
Якщо прийняти, що температура,
при якій визначається потенціал, дорівнює
250С
(298 К), то після невеликих перетворень
маємо з невеликою погрішністю зручну
для більшості розрахунків формулу: Е
= Е0
+
![]() .
Тут Е0
– стандартний електродний потенціал
даного електрода відносно нормального
водневого електрода за умовою, що
концентрація (точніше, активність а)
іонів металу дорівнює 1 моль/л.
.
Тут Е0
– стандартний електродний потенціал
даного електрода відносно нормального
водневого електрода за умовою, що
концентрація (точніше, активність а)
іонів металу дорівнює 1 моль/л.
Гальванічні елементи прийнято позначати у виді формул. Наприклад, формула елемента Даніеля-Якобі:
-
Zn
Анод (-)
Zn2+(с)
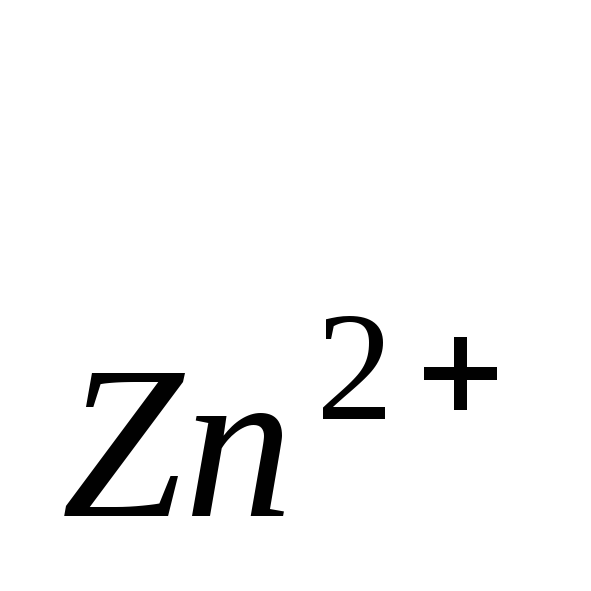
Cu2+(с)

Cu
(+) катод
На аноді протікають процеси окиснення (віддачі електронів), на катоді – відновлення (прийняття електронів). При цьому електрони переміщуються по зовнішньому ланцюгу, виконуючи корисну роботу. Таким чином, при роботі ГЕ процеси окиснення і відновлення просторово роз'єднані. Е.Р.С. гальванічного елемента розраховується як різниця потенціалу катода й анода, кожному з який відповідає конкретна напівреакція:
Е.Р.С. = Ек – Еа.
Теоретично будь-яка окисно-відновна реакція (ОВР) може служити джерелом струму, тому для будь-якої ОВР можна розрахувати Е.Р.С. за формулою: Е.Р.С. = Е = Еок-ка – Ев-ка.
Якщо, відповідно до розрахунків, Е.Р.С.>0, то ГЕ буде працювати, а окисно-відновна реакція в даних умовах можлива.
Варто ознайомитися по підручнику з різновидами ГЕ (Вольта, Даніеля-Якобі, Грене, Лекланше, концентраційними, повітряно-металевими ГЕ та ін.), а також з будовою і принципом дії акумуляторів.
Нижче наведені формули ГЕ (хімічних джерел струму), які використовуються найчастіше:
Т а б л и ц я 6
Хімічні джерела струму
|
№
1
2
3
4
5
6
7
8
9
1
2
3 |
Гальванічний елемент:
Елемент Лекланше
Елемент Грене
“Гудзикового типу”
Повітряно-металевий
Літієвий
Мангано-магнієвий
Мідно-цинковий
Свинцево-цинковий
свинцево-кадмієвий Акумулятори: Кислотний
Лужний (Cd/Ni)
Лужний (Fe/Ni) |
Формула ГЕ:
(-) Zn |NH4Cl|| MnO2 |(C) (+)
Zn|H2SO4|| K2Cr2O7| (C)
Zn|електроліт||Ag2O(або AgО)|катод
Me(Al,Zn)|електроліт||O2| катод
Li|електроліт, розчинник| катод
Mg|MgBr2||MnO2|(C)
Zn|NaOH||CuO|Cu
Zn|H2SO4||PbO2|Pb
Cd|H2SO4|| PbO2| Pb
(-) Pb| H2SO4|| PbO2 |(Pb) (+)
Cd|KOH||NiO(OH)|Ni
Fe| KOH||NiO(OH)|Ni
|
Е.Р.С., В
1,5
~2,0
1,35
~2,6-2,5
~2,5-3,5
2,0
0,6-1,0
2,5
2,2
1,95-2,15
1,30-1,34
1,37-1,41 |
Зазначимо також, що на практиці реальний електродний потенціал ΔЕ (Е.Р.С) завжди нижче, ніж розрахований згідно з теорією. Падіння потенціалу обумовлене побічними процесами, які відбуваються при роботі хімічних джерел струму: поляризацією, наявністю електроопору, втрати електрики в зоні контактів і інш.:
ΔЕпракт. = ΔЕтеор. - ІR - ΔЕполяр. - ΔЕконт.

