
- •М о д у л ь 1. Основні поняття і закони хімії т е м а 1 (вступна). Основні поняття і закони хімії.
- •1.4. Список рекомендованої літератури
- •2.1. Рекомендації до вивчення теоретичного матеріалу
- •2.4. Лабораторна робота
- •2.5. Список рекомендованої літератури
- •3.1.Рекомендації до вивчення теоретичного матеріалу
- •3.2. Приклади розвязування типових задач
- •3.3. Задачі для самостійного рішення: 182, 183, 190, 208
- •3.4. Лабораторна робота
- •3.5. Список рекомендованої літератури
- •4.1. Рекомендації до вивчення теоретичного матеріалу
- •4.2. Приклади розвязування типових задач.
- •4.3. Задачі для самостійного рішення: 720, 724, 736
- •4.4. Лабораторна робота
- •Дослід 3. Утворення сольватокомплексів
- •Дослід 6. Стійкість комплексів
- •4.5. Список рекомендованої літератури
- •М о д у л ь 2. Основні закономірності протікання хімічних реакцій т е м а 5. Енергетика хімічних процесів
- •5.1. Рекомендації до вивчення теоретичного матеріалу
- •5.2. Приклади розвязування типових задач
- •Розв’язок: Температуру початку реакції розрахуємо за формулою:
- •5.3. Задачі для самостійного рішення: № 283, 285, 303, 311
- •5.4. Лабораторна робота
- •5.5. Список рекомендованої літератури
- •Тема 6. Швидкість протікання хімічних реакцій та хімічна рівновага
- •6.2.Приклади розвязування типових задач
- •6.3. Задачі для самостійного рішення: 330, 332, 334, 352
- •6.4. Лабораторна робота
- •Загальні вказівки
- •М о д у л ь 3. Розчини т е м а 7. Розчинність. Способи вираження концентрації
- •8.1. Рекомендації до вивчення теоретичного матеріалу
- •8.3. Задачі для самостійного розвязування: 1030, 1031, 1035, 1037
- •8.4. Лабораторна робота
- •8.5. Список рекомендованої літератури
- •Т е м а 9. Властивості розчинів. Рівноваги у розчинах електролітів
- •9.1. Рекомендації до вивчення теоретичного матеріалу
- •9.2. Приклади розвязування типових задач
- •9.3. Задачі для самостійного рішення: № 516, 544, 586
- •9.4. Лабораторна робота
- •9.5. Список рекомендованої літератури
- •Тема 10. Окисно-відновні реакції
- •10.1. Рекомендації до вивчення теоретичного матеріалу
- •10.2. Приклади рішення типових задач
- •10.3. Задачі для самостійного рішення: 624, 625, 626, 640
- •10.4. Лабораторна робота
- •10.5. Список рекомендованої літератури
- •М о д у л ь 4. Електрохімічні процеси
- •Т е м а 11. Гальванічні елементи
- •11.1. Рекомендації до вивчення теоретичного матеріалу
- •11.2. Приклади розвязування типових задач
- •1.3. Задачі для самостійного рішення: 658, 660, 661
- •11.4. Лабораторна робота
- •11.5. Список рекомендованої дітератури
- •12.1. Рекомендації до вивчення теоретичного матеріалу
- •12.2. Приклади розв’язку типових задач
- •12.4. Лабораторна робота
- •12.5. Список рекомендованої літератури
- •13.1. Рекомендації до вивчення теоретичного матеріалу
- •13.2. Приклади рішення типових задач
- •13.3. Задачі для самостійного рішення 689, 690, 695, 709
- •13.4. Лабораторна робота
- •13.5. Список рекомендованої літератури
- •Тема 14. Властивості неметалів viiа групи (f, Cl, Br, I)
- •14.1. Рекомендації до вивчення теоретичного матеріалу
- •14.2. Приклади розв’язку типових задач
- •14.3. Задачі для самостійного розв’язування: 823, 824, 831.
- •14.4. Лабораторна робота
- •14.5. Список рекомендованої літератури
- •Тема 15. Властивості неметалів viа групи (o, s, Se, Te)
- •15.1 Рекомендації до вивчення теоретичного матеріалу
- •15.2. Приклади розв’язку типових задач
- •15.3. Задачі для самостійного розв’язку
- •15.4. Лабораторна робота
- •15.5. Список рекомендованої літератури
- •Тема 16. Властивості неметалів vа групи (n, p, As, Sb)
- •16.1. Рекомендації до вивчення теоретичного матеріалу
- •16.2. Приклади розв’язування типових задач
- •16.3. Задачі для самостійного розв’язку: 901, 902, 917
- •16.4. Лабораторна робота
- •Дослід 8. Гідроліз фосфатів
- •16.5. Список рекомендованої літератури
- •Тема 17. Властивості неметалів іvа групи (с, Sі)
- •17.1. Рекомендації до вивчення теоретичного матеріалу
- •17.2. Приклади розв’язування типових задач
- •17.3. Задачі для самостійного розв`язку: № 944, 949, 964.
- •17.4. Лабораторна робота
- •17.5. Список рекомендованої літератури
- •М о д у л ь 5. Властивості конструкційних і інструментальних металів і їхніх сполук. Полімерні матеріали
- •18.1. Рекомендації до вивчення теоретичного матеріалу
- •18.2. Приклади розвязування типових задач
- •18.3. Задачі для самостійного рішення: 1009, 1051, 1053
- •18.4. Лабораторна робота
- •Дослід 6. Окисно-відновні властивості сполук титана
- •Дослід 7. Електрохімічне оксидування (анодирування) алюмінію (елементи ндрс)
- •Сполуки водних розчинів для фарбування анодируваного алюмінію
- •18.5. Список рекомендованої літератури
- •Т е м а 19. Властивості заліза, кобальту, нікелю
- •19.1. Рекомендації до вивчення теоретичного матеріалу
- •19.2. Приклади розвязування типових задач
- •19.3. Задачі для самостійного рішення: 1113,1114, 1117, 1118
- •19.4. Лабораторна робота
- •19.5. Список рекомендованої літератури
- •Т е м а 20. Властивості металів підгрупи Cr і Mn і їх сполук
- •20.1. Рекомендації до вивчення теоретичного матеріалу
- •20.2. Приклади розвязування типових задач
- •20.3. Задачі для самостійного рішення: 1084, 1096, 1097
- •20.4. Лабораторна робота
- •20.5. Список рекомендованої літератури
- •21. Властивості металів vb групи (підгрупи ванадію)
- •21.1 Рекомендації до вивчення теоретичного матеріалу
- •21.2. Приклади розв’язування типових задач
- •21.3. Задачи для самостійного розв’язування : №1081, 1082
- •21.4. Лабораторна робота
- •21.5. Список рекомендованої літератури
- •22.1. Рекомендації до вивчення теоретичного матеріалу
- •22.2. Приклади розвязування типових задач
- •22.3. Задачі для самостійного рішення: 1071, 1072, 1077
- •2.4. Лабораторна робота
- •Дослід 3. Окисно-відновні властивості сполук станума і плюмбума
- •Дослід 6. Електролітичне лудіння (з елементами ндрс)
- •22.5. Список рекомендованої літератури
- •Т е м а 23. Властивості конструкційних металів ib і iib груп
- •23.1. Рекомендації до вивчення теоретичного матеріалу
- •23.2. Приклади розвязування типових задач
- •22.3. Задачі для самостійного рішення 995, 984, 1025
- •23.4. Лабораторна робота
- •23.5. Список рекомендованої літератури
- •24.1. Рекомендації до вивчення теоретичного матеріалу
- •24.2. Лабораторна робота
- •24.3. Список рекомендованої літератури
- •Питання до колоквіуму за темами «Будова атома. Періодичний закон. Властивості елементів. Хімічний зв'язок. Комплексні сполуки. Типи взаємодії молекул»
- •Тиск водяної пари при різних температурах
- •Добуток розчинності (др) важкорозчинних сполук (25оС)
- •Індивідуальні завдання до теми «Основні поняття і закони хімії»
- •Індивідуальні завдання до теми : "Електролітична дисоціація, рН, гідроліз солей"
- •Тема 1. (вступна). Основні поняття і закони хімії
- •Тема 2. Закон еквівалентів…………………………………………………………………....7
- •Тема 3. Будова атома. Періодичний закон. Властивості елементів..................................10
- •Тема 4. Хімічний зв'язок. Комплексні сполуки……………………….....................................15
- •Тема 5. Енергетика хімічних процесів………………………………….................................21
- •Тема 6. Швидкість хімічних реакцій і хімічна рівновага……................................................29
- •Тема 7. Розчинність. Способи вираження концентрації……………..................................33
- •Тема 18. Властивості легких конструкційних металів
М о д у л ь 3. Розчини т е м а 7. Розчинність. Способи вираження концентрації
Рекомендації до вивчення теоретичного матеріалу
При вивченні даної теми необхідно звернути увагу на наступні основні поняття теорії розчинів.
Розчини являють собою дисперсні системи, в яких частинки однієї речовини рівномірно розподілені в іншій. У дисперсних системах розрізняють дисперсійне середовище (розподіляюче середовище) і дисперсну фазу (подрібнену в дисперсійному середовищі речовину), які можуть існувати в трьох агрегатних станах (Г- газ, Р- рідина, Т- тверда речовина). Отже, можливі 9 типів дисперсних систем, але до розчинів найчастіше відносять системи Г + Р, Р + Р, Т + Р (перша буква – дисперсна фаза, друга – дисперсне середовище).
Залежно від розмірів частинок дисперсної фази розрізняють істинні розчини (частинки з розміром 0,1-1 нм), колоїдні системи (1-100 нм) і грубодисперсні системи (розмір частинок більше 100 нм). До грубодисперсних систем належать суспензії, емульсії, піни. Слід звернути увагу на відмінні властивості істинних розчинів від властивостей інших систем.
Істинні розчини – це гомогенні термодинамічно стійкі дисперсні системи, що складаються з двох і більше компонентів, здатних існувати незалежно один від одного, співвідношення між якими може варіювати в широких межах. Розмір частинок дисперсної фази в них дорівнює розмірам молекул або іонів.
Необхідно ознайомитися з механізмом і термодинамікою процесу розчинення, звернувши увагу, що інтегральна теплота розчинення (∆Нр.) відбиває вплив двох факторів - ∆Н фазового переходу речовини дисперсної фази (або енергію її кристалічної гратки) і ∆Н сольватації:
∆Нр. =Δ Н ф.п. + ∆Н сольв.
Отже, при розчиненні речовин завжди спостерігається виділення або поглинання теплоти. Ентропія систем Р + Р і Т + Р зростає (∆S > 0), оскільки речовини з більш впорядкованого стану переходять у менш впорядкований. При розчиненні газів ентропія системи Г + Р зменшується (∆S < 0). Але в усіх випадках ізобарно-ізотермічний потенціал завжди зменшується (∆G p. < 0), тобто, розчинення – самовільний процес.
Слід звернути увагу на розчинність органічних і неорганічних речовин у воді і інших розчинниках (спиртах, кетонах, ефірах, вуглеводнях і т. д.), користуючись відомим правилом: «подібне розчиняється в подібному». Наприклад, полярні розчинники, вода, ацетон, етанол, диметилформамід, ацетонітрил змішуються і розчиняються один в одному в необмеженому співвідношенні. Практично відсутня взаємна розчинність у системах з протилежними властивостями компонентів: вода-октан, вода-бензол. При розчиненні газів в рідині можливе утворення двох систем: з наявністю хімічної взаємодії та з її відсутністю. У випадку наявності хімічної взаємодії (наприклад, розчинення NH3, НCl, HBr у воді) розчинність газів значно вища, ніж при її відсутності (O2, N2, CO, інертні гази). В останньому випадку залежність розчинності газів від тиску виражається законом Генрі-Дальтона (1802): при сталій температурі розчинність газу в рідині (С) прямо пропорційна його парціальному тиску (Р):
С = k ·Р,
де k – коефіцієнт пропорційності.
Розчини з великою концентрацією розчиненої речовини називаються концентрованими,а з малою –розведеними. Коли розчин знаходиться в динамічній рівновазі з одним з компонентів розчину, він називаєтьсянасиченим, а його концентрація відповідає розчинності цього компонента. Підрозчинністюзвичайно розуміють масу розчиненої речовини в 100 г розчинника в насиченому розчині.
У практиці насиченими розчинами користуються рідко, характеризувати концентрацію розчину величиною розчинності незручно. У зв'язку з цим для кількісної характеристики розчинів застосовують інші способи вираження концентрації. Вони досить докладно розглянуті в задачнику М.Л. Глінки. Варто запам'ятати основні п'ять способів:
Частки – мольна (об'ємна, масова) – відношення кількості молей (обєму, маси) однієї з речовин до суми кількості молей (обємів, мас) усіх речовин суміші:
мольна - ХА=![]() ;
;
об'ємна - А=![]() ;
;
масова -
![]() .
.
Сума часток суміші дорівнює одиниці:
![]() =1.
=1.
Моляльність– число молів розчиненої речовини в 1000 г розчинника;
Сm=
![]() (моль/кг), деm1,m2– маси розчиненої речовини і розчинника,
г.
(моль/кг), деm1,m2– маси розчиненої речовини і розчинника,
г.
Молярність – число молів розчиненої речовини в 1 л розчину;
СМ=![]() (моль/л),
деV– обєм
розчину, л.
(моль/л),
деV– обєм
розчину, л.
Нормальність(молярна концентрація еквіваленту) – число молів еквівалентів розчиненої речовини в 1 л розчину;
Сн=![]() (моль екв/л);mэ1 –
еквівалентна маса розчиненої речовини.
(моль екв/л);mэ1 –
еквівалентна маса розчиненої речовини.
5. Титр– кількість грамів розчиненої
речовини, що містяться в 1 мл розчину;
Т =![]() (г/мл).
(г/мл).
При визначенні концентрації невідомого розчину методом титрування використовують закон еквівалентів, що для розчинів має вид:
Сн1V1 = Сн2 V2.
При розчиненні у воді малорозчинних неорганічних речовин ( наприклад, BaSO4, Ag2ClO4, Fe(OH)3, AgCl ) більша частина речовини залишається в осаді, між яким та насиченим розчином встановлюється рівновага:
BaSO4 = [BaSO4] =Ва2+ + SO4²ˉ,
константа якої має вираз: К = [ Ва2+] [SО42ˉ] / [ВаSО4 тв. ] Оскільки в розчин переходить незначна частина сульфату барію, то можна констатувати, що кількість твердої фази при сталій температурі практично не змінюється. Отже, [Ва2+] [SО42ˉ] = К·[ВаSО4 тв.] = const = ДР.
Добуток розчинності (ДР) – показник розчинності: чим менша величина ДР, тим менше речовина здатна переходити в розчин. Розчинність малорозчинної речовини легко знайти, якщо скористатися табличними даними добутку розчинності.
Наприклад, розчинність ВаSО4 знаходять з таких співвідношень:
[BaSO4] = [ Ва2+] = [SО42ˉ] = √ДР = √1,1·10-10 = 1,08·10-5 моль/л = 1,08·MBaSO4·10-5 ≈ 2,5·10-3 г/л . Аналогічно, розчинність Ag2CrO4 дорівнює
[Ag2CrO4] = [ CrO42ˉ] = 3√ДР/4 = 3√4.05·10-12 ≈ 1·10-4 моль/л
У насиченому розчині малорозчинної сполуки KmAm встановлюється рівновага:
KmAn = mKn+ +nAm-
тверда фаза насичений розчин
Тобто, ДР = [Kn+]m·[Am-]n. У загальному вигляді розчинність KmAn в моль/л визначають за формулою:
P KmAn = m+n√ДР(KmAn)/(mm · nn)
Додавання однойменного іону в систему «осад-розчин» буде зміщувати рівновагу в бік випадання осаду.
Приклади розвязування типових задач
Задача 1.Визначити молярну, нормальну концентрації і титр 40%-го розчину Н2SO4(1,31 г/см3).
Розв’язок.З формули![]() =
=![]() знаходимо масу розчиненої речовини
Н2SO4:m
знаходимо масу розчиненої речовини
Н2SO4:m![]() =
=![]() mр-ну.
=
mр-ну.
=![]()
![]() V=
0,401,31г/мл1000
мл = 524 (г), (деV= 1000 мл).
V=
0,401,31г/мл1000
мл = 524 (г), (деV= 1000 мл).
Знаходимо молярну концентрацію: СМ
= =
=![]() =
5,35 (моль/л).
=
5,35 (моль/л).
Знаходимо нормальну концентрацію: Сн
= =
=![]() = 10,7 (моль-екв/л).
= 10,7 (моль-екв/л).
Знаходимо титр: Т =
![]() =
=![]() =
0,524 (г/мл).
=
0,524 (г/мл).
Задача 2. Скільки грамівNa2CO3необхідно для повної взаємодії його з 100 мл 4 н. розчину НСl ?
Розв’язок.Відповідно до закону
еквівалентів: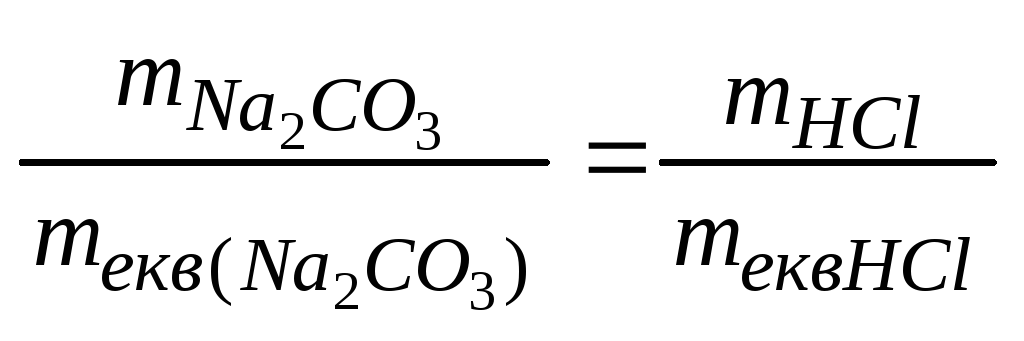 .
.
З формули Сн=![]() випливає:
випливає:![]() VHClCHКомбіноване
вираження закону еквівалентів має вид
для даного випадку:
VHClCHКомбіноване
вираження закону еквівалентів має вид
для даного випадку: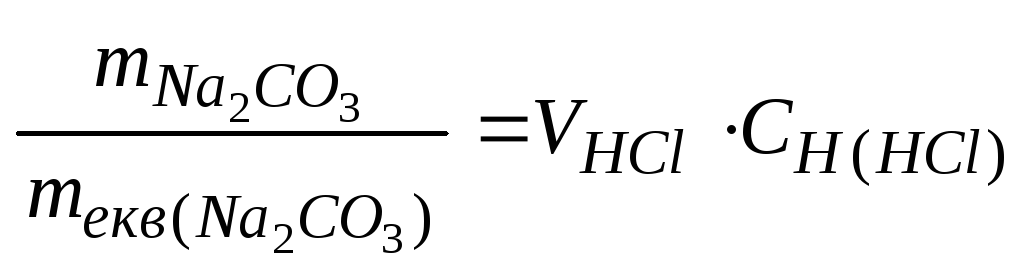 mNa
mNa![]() СО
СО![]() =mекв(Na
=mекв(Na![]() СО
СО![]() )VHClCH(HCl)=530,14
=
)VHClCH(HCl)=530,14
=
= 21,2 (г).
Задача 3.У лабораторії є розчин із процентною концентрацією натрій хлориду 20 і 10%. Визначите масу кожного з розчинів, які необхідно змішати для приготування 300 г розчину з процентною концентрацією 12%.
Розв’язок. При виконанні експериментальних робіт часто доводиться розраховувати концентрацію розчину, що утворюється при розведенні, концентруванні або змішуванні двох розчинів. У цьому випадку зручно використовувати «правило хреста»:

де С1і С2– концентрації вихідних, С3– кінцевих розчинів, причому С1>C3, а С3>C2. Для масовихзначеньвираження концентрації знаходимо:
![]() ; для об'ємних:
; для об'ємних:![]() .
У випадку розведення розчинучистим
розчинником С2приймається
рівним нулю. Цю задачу також
можна вирішити за допомогою “правила
хреста”. Складаємо діаграму:
.
У випадку розведення розчинучистим
розчинником С2приймається
рівним нулю. Цю задачу також
можна вирішити за допомогою “правила
хреста”. Складаємо діаграму:

де х1 і х2 – відповідні масові частини розчинів. Як випливає з цієї діаграми, для приготування необхідного розчина варто взяти 2 масові частини 20% і 8 масових частин 10% розчинів.
Розрахуємо маси кожного з розчинів по формулах:
m1=
![]() =
=
![]() =
60(г);m2=
=
60(г);m2=
![]() =
240 (г) абоm2= 300 –m1= 300-60 = 240 (г).
=
240 (г) абоm2= 300 –m1= 300-60 = 240 (г).
Задача 4: Визначити розчинність Ca3(PO4)2 в моль/л і в г/л.
Розв’язок: У водному розчині Ca3(PO4)2 дисоціює за рівнянням:
Ca3(PO4)2 = 3 Ca 2+ + 2PO43-
Тобто, трьом катіонам Ca 2+ відповідають два аніона PO43ˉ. Розчинність фосфату кальцію визначають з урахуванням значення добутку розчинності:
ДРCa3(PO4)2 = [Ca 2+ ]3 · [PO43-]2 = 3 ·10-33
Р Ca3(PO4)2 = 3+2√ПРCa3(PO4)2/33· 22 = 5√3 · 10-33/108 ≈ 1,2 · 10-7 моль/л
Молярна маса Ca3(PO4)2 дорівнює 310 г/моль. Отже, РCa3(PO4)2 = 1,2 · 10-7 ·310 = 3,72 · 10-5 г/л.
Задачі для самостійного рішення: 400, 414, 421, 432, 436
Лабораторна робота
Необхідні прилади, устаткування, реактиви: техно-хімичні ваги і важок, набір ареометрів для визначення густини розчинів, мірні колби на 50 і 100 мл, піпетки, гранульовані луги – КОН і NaOH, розчини кислот невідомої концентрації: соляної, сірчаної, азотної; дистильована вода.
Дослід 1. Приготування розчину лугу
а) приготування розчину лугу зазначеної процентної концентрації відповідно до варіанта завдання (табл. 5).
Розраховують, яку масу гранульованого лугу необхідно взяти для приготування 100 г розчину з зазначеною в завданні масовою часткою. Зважують розраховану кількість лугу на техно-хімічних вагах з точністю до 0,1 г і переносять у колбу на 100 мл. Відмірюють циліндром необхідну кількість води. Після охолодження розчину до кімнатної температури вимірюють його щільність ареометром і порівнюють отриману величину з табличними даними;
б) приготування розчину лугу зазначеної нормальної концентрації відповідно до варіанта завдання (табл. 5), використовуючи розчин, отриманий у досліді а.
Розраховують, який обєм вихідного розчину необхідний для приготування 50 мл розчину з концентрацією Сн:
Vр-ну
=
![]() ,
,
mр-ну
=
![]() ,
тому:Vр-ну
=
,
тому:Vр-ну
=
![]() .
Масу розчиненої речовини mлугу
знаходять : mлугу
= Снmекв(лугу)V,
відкіля випливає, що обєм
вихідного розчину складає:
.
Масу розчиненої речовини mлугу
знаходять : mлугу
= Снmекв(лугу)V,
відкіля випливає, що обєм
вихідного розчину складає:
Vр-ну
=
![]() .
.
Відбирають піпеткою розрахований обєм розчину і переносять у мірну колбу на 50 мл. За допомогою піпетки доливають дистильованої води до відповідної мітки, орієнтуючись на нижній меніск;
в) перевірка нормальності приготовленого в досліді б розчину методом прямого титрування.
Якщо точно вимірити обєми розчинів хімічних речовин, що вступили в реакцію (у даному випадку кислоти і лугу), і знати концентрацію одного розчину (кислоти), то легко обчислити концентрацію іншого (лугу). Процес поступового додавання розчину з відомою концентрацією речовини (титрованного розчину) до точно обмірюваного обєму аналізованого розчину називаєтьсятитруванням.
За допомогою піпетки відбирають 3 проби аналізованого розчину лугу по 10 мл і додають у кожну пробу 3-4 краплі фенолфталеїну.
Проводять орієнтований дослід: невеликими порціями доливають кислоту з бюретки в колбу з лугом до зникнення забарвлення фенолфталеїну. Розчин у колбі перемішують під час досліду легкими круговими рухами колби. Роблять відлік обєму витраченої кислоти з точністю до десятих часток мл. Виходячи з закону еквівалентів: Сн кVк=Cн лугуVлугу, розраховують нормальну концентрацію приготовленого розчину.
Повторюють титрування ще два рази, уточнюючи концентрацію розчину.
Дослід 2.Приготування розчину кислоти
Визначають за допомогою ареометра густину кислоти, отриманої для досліду, і по таблиці – його процентну концентрацію. Методом розведення готують розчин із заданою масовою часткою відповідно до варіанту (табл. 5). Розрахунок проводять за правилом хреста.
Визначають по таблиці густину приготовленого розчину.
Методом прямого титрування уточнюють концентрацію розчину.
Т а б л и ц я 5
Варіанти завдань до лабораторної роботи “Приготування розчинів”
|
Варіанти |
Маса розчину 100 г |
Обєм титр. розчину 50 мл |
|
1 |
15% КОН |
0,12 н |
|
2 |
12% NаОН |
0,15 н |
|
3 |
16% КОН |
0,08 н |
|
4 |
10% NаОН |
0,1 н |
|
5 |
HCl10% |
0,1 н |
|
6 |
H2SO48% |
0,08 н |
|
7 |
H2SO4 5% |
0,07 н |
|
8 |
H2SO4 10% |
0,1 н |
|
9 |
HCl8% |
0,1 н |
|
10 |
HNO310% |
0,1 н |
Список рекомендованої літератури
1. Глинка Н.Л. Общая химия. – Л.: Химия, 1988. – С.205-215
2. Глинка Н.Л.Задачи и упражнения по общей химии. – Л.: Химия, 1985. – С. 103-114.
3. Сухан В.І., Табенська Т.В., Капустян А.Й., Горлач В.Ф. Посібник для вступників до вищих навч. закладів. – Київ.: Либідь, 1996. – С.132-138.
4. Булавін В.І. Основи загальної хімії. – Харків.: ХДПУ, 1998. – С.28-42.
5. Пилипенко А.Г., Починок В.Я., Середа И.П. і ін. Довідник по елементарній хімії. – Київ.: Наук. думка, 1985. – С. 153-165.
6. Кириченко В.І. Загальна хімія: Навч. посіб. – К.: Вища шк., 2005. – С.224-244).
Т е м а 8. Твердість(жорсткість) води і методи її усунення
