
- •М о д у л ь 1. Основні поняття і закони хімії т е м а 1 (вступна). Основні поняття і закони хімії.
- •1.4. Список рекомендованої літератури
- •2.1. Рекомендації до вивчення теоретичного матеріалу
- •2.4. Лабораторна робота
- •2.5. Список рекомендованої літератури
- •3.1.Рекомендації до вивчення теоретичного матеріалу
- •3.2. Приклади розвязування типових задач
- •3.3. Задачі для самостійного рішення: 182, 183, 190, 208
- •3.4. Лабораторна робота
- •3.5. Список рекомендованої літератури
- •4.1. Рекомендації до вивчення теоретичного матеріалу
- •4.2. Приклади розвязування типових задач.
- •4.3. Задачі для самостійного рішення: 720, 724, 736
- •4.4. Лабораторна робота
- •Дослід 3. Утворення сольватокомплексів
- •Дослід 6. Стійкість комплексів
- •4.5. Список рекомендованої літератури
- •М о д у л ь 2. Основні закономірності протікання хімічних реакцій т е м а 5. Енергетика хімічних процесів
- •5.1. Рекомендації до вивчення теоретичного матеріалу
- •5.2. Приклади розвязування типових задач
- •Розв’язок: Температуру початку реакції розрахуємо за формулою:
- •5.3. Задачі для самостійного рішення: № 283, 285, 303, 311
- •5.4. Лабораторна робота
- •5.5. Список рекомендованої літератури
- •Тема 6. Швидкість протікання хімічних реакцій та хімічна рівновага
- •6.2.Приклади розвязування типових задач
- •6.3. Задачі для самостійного рішення: 330, 332, 334, 352
- •6.4. Лабораторна робота
- •Загальні вказівки
- •М о д у л ь 3. Розчини т е м а 7. Розчинність. Способи вираження концентрації
- •8.1. Рекомендації до вивчення теоретичного матеріалу
- •8.3. Задачі для самостійного розвязування: 1030, 1031, 1035, 1037
- •8.4. Лабораторна робота
- •8.5. Список рекомендованої літератури
- •Т е м а 9. Властивості розчинів. Рівноваги у розчинах електролітів
- •9.1. Рекомендації до вивчення теоретичного матеріалу
- •9.2. Приклади розвязування типових задач
- •9.3. Задачі для самостійного рішення: № 516, 544, 586
- •9.4. Лабораторна робота
- •9.5. Список рекомендованої літератури
- •Тема 10. Окисно-відновні реакції
- •10.1. Рекомендації до вивчення теоретичного матеріалу
- •10.2. Приклади рішення типових задач
- •10.3. Задачі для самостійного рішення: 624, 625, 626, 640
- •10.4. Лабораторна робота
- •10.5. Список рекомендованої літератури
- •М о д у л ь 4. Електрохімічні процеси
- •Т е м а 11. Гальванічні елементи
- •11.1. Рекомендації до вивчення теоретичного матеріалу
- •11.2. Приклади розвязування типових задач
- •1.3. Задачі для самостійного рішення: 658, 660, 661
- •11.4. Лабораторна робота
- •11.5. Список рекомендованої дітератури
- •12.1. Рекомендації до вивчення теоретичного матеріалу
- •12.2. Приклади розв’язку типових задач
- •12.4. Лабораторна робота
- •12.5. Список рекомендованої літератури
- •13.1. Рекомендації до вивчення теоретичного матеріалу
- •13.2. Приклади рішення типових задач
- •13.3. Задачі для самостійного рішення 689, 690, 695, 709
- •13.4. Лабораторна робота
- •13.5. Список рекомендованої літератури
- •Тема 14. Властивості неметалів viiа групи (f, Cl, Br, I)
- •14.1. Рекомендації до вивчення теоретичного матеріалу
- •14.2. Приклади розв’язку типових задач
- •14.3. Задачі для самостійного розв’язування: 823, 824, 831.
- •14.4. Лабораторна робота
- •14.5. Список рекомендованої літератури
- •Тема 15. Властивості неметалів viа групи (o, s, Se, Te)
- •15.1 Рекомендації до вивчення теоретичного матеріалу
- •15.2. Приклади розв’язку типових задач
- •15.3. Задачі для самостійного розв’язку
- •15.4. Лабораторна робота
- •15.5. Список рекомендованої літератури
- •Тема 16. Властивості неметалів vа групи (n, p, As, Sb)
- •16.1. Рекомендації до вивчення теоретичного матеріалу
- •16.2. Приклади розв’язування типових задач
- •16.3. Задачі для самостійного розв’язку: 901, 902, 917
- •16.4. Лабораторна робота
- •Дослід 8. Гідроліз фосфатів
- •16.5. Список рекомендованої літератури
- •Тема 17. Властивості неметалів іvа групи (с, Sі)
- •17.1. Рекомендації до вивчення теоретичного матеріалу
- •17.2. Приклади розв’язування типових задач
- •17.3. Задачі для самостійного розв`язку: № 944, 949, 964.
- •17.4. Лабораторна робота
- •17.5. Список рекомендованої літератури
- •М о д у л ь 5. Властивості конструкційних і інструментальних металів і їхніх сполук. Полімерні матеріали
- •18.1. Рекомендації до вивчення теоретичного матеріалу
- •18.2. Приклади розвязування типових задач
- •18.3. Задачі для самостійного рішення: 1009, 1051, 1053
- •18.4. Лабораторна робота
- •Дослід 6. Окисно-відновні властивості сполук титана
- •Дослід 7. Електрохімічне оксидування (анодирування) алюмінію (елементи ндрс)
- •Сполуки водних розчинів для фарбування анодируваного алюмінію
- •18.5. Список рекомендованої літератури
- •Т е м а 19. Властивості заліза, кобальту, нікелю
- •19.1. Рекомендації до вивчення теоретичного матеріалу
- •19.2. Приклади розвязування типових задач
- •19.3. Задачі для самостійного рішення: 1113,1114, 1117, 1118
- •19.4. Лабораторна робота
- •19.5. Список рекомендованої літератури
- •Т е м а 20. Властивості металів підгрупи Cr і Mn і їх сполук
- •20.1. Рекомендації до вивчення теоретичного матеріалу
- •20.2. Приклади розвязування типових задач
- •20.3. Задачі для самостійного рішення: 1084, 1096, 1097
- •20.4. Лабораторна робота
- •20.5. Список рекомендованої літератури
- •21. Властивості металів vb групи (підгрупи ванадію)
- •21.1 Рекомендації до вивчення теоретичного матеріалу
- •21.2. Приклади розв’язування типових задач
- •21.3. Задачи для самостійного розв’язування : №1081, 1082
- •21.4. Лабораторна робота
- •21.5. Список рекомендованої літератури
- •22.1. Рекомендації до вивчення теоретичного матеріалу
- •22.2. Приклади розвязування типових задач
- •22.3. Задачі для самостійного рішення: 1071, 1072, 1077
- •2.4. Лабораторна робота
- •Дослід 3. Окисно-відновні властивості сполук станума і плюмбума
- •Дослід 6. Електролітичне лудіння (з елементами ндрс)
- •22.5. Список рекомендованої літератури
- •Т е м а 23. Властивості конструкційних металів ib і iib груп
- •23.1. Рекомендації до вивчення теоретичного матеріалу
- •23.2. Приклади розвязування типових задач
- •22.3. Задачі для самостійного рішення 995, 984, 1025
- •23.4. Лабораторна робота
- •23.5. Список рекомендованої літератури
- •24.1. Рекомендації до вивчення теоретичного матеріалу
- •24.2. Лабораторна робота
- •24.3. Список рекомендованої літератури
- •Питання до колоквіуму за темами «Будова атома. Періодичний закон. Властивості елементів. Хімічний зв'язок. Комплексні сполуки. Типи взаємодії молекул»
- •Тиск водяної пари при різних температурах
- •Добуток розчинності (др) важкорозчинних сполук (25оС)
- •Індивідуальні завдання до теми «Основні поняття і закони хімії»
- •Індивідуальні завдання до теми : "Електролітична дисоціація, рН, гідроліз солей"
- •Тема 1. (вступна). Основні поняття і закони хімії
- •Тема 2. Закон еквівалентів…………………………………………………………………....7
- •Тема 3. Будова атома. Періодичний закон. Властивості елементів..................................10
- •Тема 4. Хімічний зв'язок. Комплексні сполуки……………………….....................................15
- •Тема 5. Енергетика хімічних процесів………………………………….................................21
- •Тема 6. Швидкість хімічних реакцій і хімічна рівновага……................................................29
- •Тема 7. Розчинність. Способи вираження концентрації……………..................................33
- •Тема 18. Властивості легких конструкційних металів
6.2.Приклади розвязування типових задач
Задача 1.Як зміниться швидкість прямої реакції 2NO+Br22NOBr, якщо тиск у системі збільшити в 3 рази?
Розв’язок.Позначимо вихідні
тискиNOчерез Р1, аBr2через Р2,
тодішвидкість реакції
дорівнює:
![]() 1=kpP21P2.
При збільшенні загального тиску в три
рази парціальні тиски теж збільшаться
в три разиNO= 3P1,Br2= 3P2,
а швидкість реакції
1=kpP21P2.
При збільшенні загального тиску в три
рази парціальні тиски теж збільшаться
в три разиNO= 3P1,Br2= 3P2,
а швидкість реакції
![]() 2=kp(3P1)2(3P2).
2=kp(3P1)2(3P2).
![]() =
27. Таким чином,
швидкість зростає
в 27 разів.
=
27. Таким чином,
швидкість зростає
в 27 разів.
Задача 2. Як зросте швидкість реакції при підвищенні температури з 10 до 1000С, якщо температурний коефіцієнт швидкості дорівнює 2?
Розв’язок.Використовуємо правило Вант-Гоффа
 ;
;![]() =
29= 512.
=
29= 512.
Швидкість зросте в 512 разів.
Задача 3.Для рівноважної системи СО + Н2О ↔СО2+ Н2; К = 1. Визначитиконцентрації всіх речовин у стані рівноваги, якщо початкові концентрації [CO] = 2 і [ H2O] = 3 моль/л.
Розв’язок.Для даної рівноважної системи вираження константи рівноваги має вид:
К=![]() . Позначимо [СО2]р= [Н2]р= [СО]витр.=
[Н2О]витр.=х, де [СО2]р,
[Н2]р– відповідні рівноважні
концентрації, а [СО]витр., [Н2О]витр.-
витрачені концентрації.
. Позначимо [СО2]р= [Н2]р= [СО]витр.=
[Н2О]витр.=х, де [СО2]р,
[Н2]р– відповідні рівноважні
концентрації, а [СО]витр., [Н2О]витр.-
витрачені концентрації.
Оскільки СОр=СОпоч.– СОвитр., то [СО]р= (2-х), [Н2О]р= (3-х).
Тобто,
![]() ,
звідки х= 1,2
моль/л.
,
звідки х= 1,2
моль/л.
Отже, [СО]р= 2 - 1,2=0,8(моль/л); [Н2О]р= 3 - 1,2=1,8 (моль/л), [СО2]р= [Н2]р= 1,2 (моль/л).
6.3. Задачі для самостійного рішення: 330, 332, 334, 352
6.4. Лабораторна робота
Необхідні прилади, посуд і реактиви:секундомір, термостат, термометр, штативи з пробірками, скляні палички, розчини тіосульфату натрію, сірчаної кислоти, роданіду калію, хлориду заліза (3+), сульфату міді.
Дослід 1.Вплив концентрації реагуючих речовин на швидкість реакції в гомогенній системі
Загальні вказівки
Цю залежність можна виявити на прикладі реакції взаємодії водного розчину тіосульфату натрію з сірчаною кислотою, що протікає за рівнянням:
Na2S2O3 + H2SO4 Na2SO4 + Н2О + SO2 + S.
Досліджувана реакція протікає в кілька стадій:
Na2S2O3 + H2SO4 Na2SO4 + H2S2O3;
H2S2O3 H2SO3 + S; 3) H2SO3 Н2О + SO2.
Реакції 1,3 протікають
миттєво. Найбільш
повільною є
реакція 2, що
і визначає
загальну швидкість
реакції. Ця
реакція є
реакцією першого
порядку. Нерозчинна
сірка виділяється
у виді
блакитнувато-білої
опалесценції (каламуть).
Час від початку реакції до появи
перших слідів каламуті залежить від
концентрації реагуючих речовин і
температури. Для реакції першого порядку
швидкість хімічних реакцій можна знайти
по формулі:V=
![]() ,
де
,
де![]() -
час протікання реакції.
-
час протікання реакції.
Хід роботи:
Проводять контрольний дослід: наливають у пробірку 1 мл розчинуH2SO4, в іншу пробірку – 5 мл розчинуNa2S2O3. Доливають у пробірку з кислотою розчин тіосульфату натрію і добре струшують. Спостерігають початок реакції по появі блакитнувато-білої опалесценції.
Проводять ще п'ять аналогічних дослідів, змінюючи концентрацію розчинуNa2S2O3 шляхом розведення його водою відповідно до даних таблиці 3. Зливають попарно приготовлені розчини (розчин 1 вливають у розчин 2) і відраховують час по секундоміру з моменту зливання розчинів до початку появи каламуті. Дані досліду заносять у таблицю 3.
Т а б л и ц я 3
Експериментальні дані залежності υ = f(c)
|
№п/п |
Розчин 1 |
Розчин 2 VH2SO4 мл |
Vзаг |
С Na2S2O3 10-2 моль/л |
|
10-2, c-1 |
| |
|
V Na2S2O3 Мл |
V H2O мл | |||||||
|
1 |
1 |
4 |
1 |
6 |
|
|
|
|
|
2 |
2 |
3 |
1 |
6 |
|
|
|
|
|
3 |
3 |
2 |
1 |
6 |
|
|
|
|
|
4 |
4 |
1 |
1 |
6 |
|
|
|
|
|
5 |
5 |
- |
1 |
6 |
|
|
|
|
Розраховують концентрації С(Na2S2O3)за формулою:
С(
Na2S2O3)
=
![]() моль/л, де С0(Na2S2O3)
= 0,1 моль/л,
моль/л, де С0(Na2S2O3)
= 0,1 моль/л,
С0(H2SO4) = 0,5 моль/л .
Розраховують
![]() – швидкість реакції. Розраховують k –
константу швидкості. Будують графік
залежності швидкості реакції від
концентрації реагуючих речовин. На осі
абсцис відкладають у визначеному
масштабі відносні концентрації
тіосульфату натрію, на осі ординат –
відповідні їм швидкості.
– швидкість реакції. Розраховують k –
константу швидкості. Будують графік
залежності швидкості реакції від
концентрації реагуючих речовин. На осі
абсцис відкладають у визначеному
масштабі відносні концентрації
тіосульфату натрію, на осі ординат –
відповідні їм швидкості.
Дослід 2. Вплив температури на швидкість реакції в гомогенній системі
Готують розчини другого досліду відповідно до таблиці 4.
Т а б л и ц я 4
Експериментальні дані залежності υ = f (t)
|
№ п/п |
Розчин 1 |
Розчин2 VH2SO4 мл |
Vзаг. |
t, 0C |
|
|
10-2, c-1 |
| |
|
V Na2S2O3 мл |
V H2O мл | ||||||||
|
1 |
2 |
3 |
1 |
6 |
20 |
|
|
|
|
|
2 |
2 |
3 |
1 |
6 |
30 |
|
|
|
|
|
3 |
2 |
3 |
1 |
6 |
40 |
|
|
|
|
|
4 |
2 |
3 |
1 |
6 |
50 |
|
|
|
|
|
5 |
2 |
3 |
1 |
6 |
60 |
|
|
|
|
Готують п'ять пробірок з розчином 1 і п'ять пробірок з розчином 2.
Кожну пару пробірок (розчинів 1 і 2)
термостатують у хімічній склянці з
водою, температура якої зазначена в
таблиці. Воду в хімічній склянці
нагрівають на електроплитці (на 2-3
градуса вище температури, зазначеної
в таблиці). Температуру контролюють по
термометру, зануреному в склянку з
водою, що нагрівається. Довівши температуру
до необхідного значення, зливають вміст
пробірок (розчин 1 доливають до розчину
2) і визначають час до появи каламуті.
Дані досліду заносять у таблицю і
розраховують
![]() – швидкість реакції,k–
константу швидкості і температурний
коефіцієнт
– швидкість реакції,k–
константу швидкості і температурний
коефіцієнт![]() із
формули:
із
формули: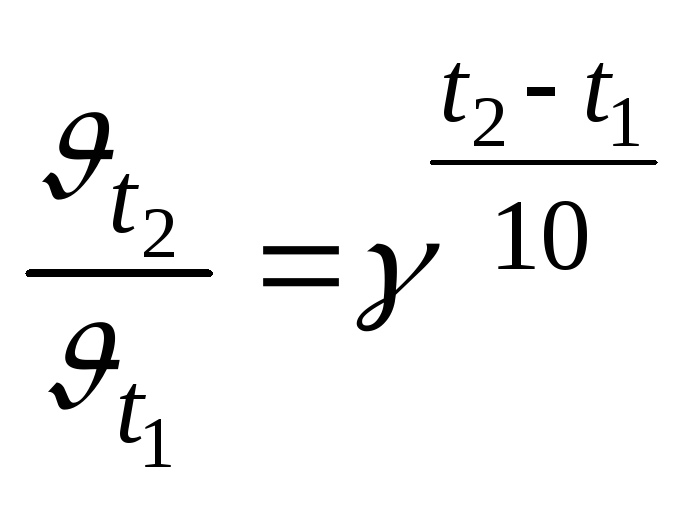 ;
;
Будують графік залежності швидкості реакції від температури. На осі абсцис відкладають значення температури, на осі ординат – відповідні їм швидкості.
У висновках укажіть:
- Як змінювалася швидкість реакції зі зміною концентрації тіосульфату натрію?
- Чи залежить константа швидкості від концентрації і температури?
- Як впливає температура на швидкість реакції?
- Яке значення має температурний коефіцієнт однієї і тієї ж реакції?
Дослід 3. Вплив каталізатора на швидкість реакції
У дві пробірки вносять по 1 - 2 мл 0,5 н. розчину калій роданідуKSCNі по 2 - 3 краплі 0,5 н. розчинуферум (3+) хлориду. Що спостерігаєте?
В одну з пробірок додають 2 – 3 краплі 1 н. розчину купрум сульфатуCuSO4. В обидві пробірки вносять невелику кількість тіосульфату натрію. Спостерігають різну швидкість знебарвлення розчинів, що відбувається унаслідок відновлення ферум (3+) до ферум (2+):
2Fe(SCN)3 + 2Na2S2O3 Na2S4O6 + 2Fe(SCN)2 +2NaSCN.
Відзначають усі спостереження і записують рівняння реакцій:
взаємодії ферум (3+)хлориду з роданідом калію з утвореннямFe(SCN)2;
відновлення ферум(3+) уферум(2+)натрій тіосульфатом. Яке забарвлення маєFe(SCN)2?
У висновку вкажіть: що з'явилося каталізатором у даному досліді?
Список рекомендованої літератури
Фролов В.В. Химия. – М.: Высш. шк., 1986. – С.114-135.
Курс общей химии/Под ред. Коровина А.В. – М.: Высш. шк., 1985. – С.107-144.
Глинка Н.Л. Общая химия. – Л.: Химия, 1988. – С.162-181.
Глинка Н.Л. Задачи и упражнения по общей химии. – Л.: Химия, 1985. – С.86-102.
Ахметов Н.С. Общая и неорганическая химия. – М.: Высш. шк., 1981.-С. 191 – 224 (2001. – С. 212-226).
6. Слободяник М.С., Улько Н.В., Бойко К.М., Самойленко В.М. Загальна та неорганічна хімія: Практикум . – К.: Либідь, 2004. – 336 с.
