
- •Государственное бюджетное образовательное учреждение высшего
- •Влияние температуры на скорость химической реакции
- •Теоретические представления о механизме химических реакций. Понятие о теории активных соударений.
- •Понятие о теории активированного комплекса (переходного состояния)
- •Катализ
- •Гомогенный катализ
- •Гетерогенный катализ
- •Ферментативный катализ
![]()
Министерство здравоохранения и социального развития Российской Федерации
Государственное бюджетное образовательное учреждение высшего
профессионального образования
«Саратовский государственный медицинский университет
имени В.И. Разумовского» Министерства здравоохранения и социального
развития Российской Федерации
(ГБОУ ВПО Саратовский ГМУ им. В.И. Разумовского
Минздравсоцразвития России)
Методические указания к лабораторно – практическому занятию
для студентов медицинских специальностей
Кинетика и катализ
Дисциплина: общая химия.
I курс.
Очная форма обучения.
Длительность занятия: 90 минут.
Разработка составлена асс. Куликовой Л.Н.
2011 г
Вопросы для подготовки к занятию
Предмет химической кинетики.
Скорость реакции, средняя скорость реакции в интервале, истинная скорость.
Классификации реакций, применяющиеся в кинетике: реакции, гомогенные, гетерогенные и микрогетерогенные; реакции простые и сложные (параллельные, последовательные, сопряженные, цепные).
Молекулярность элементарного акта реакции.
Порядок реакции.
Период полупревращения.
Зависимость скорости реакции от концентрации. Закон действующих масс.
Константа скорости химической реакции.
Кинетические уравнения реакций нулевого, первого, второго порядков.
Экспериментальные методы определения скорости и константы скорости реакций.
Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Температурный коэффициент скорости реакции и его особенности для биохимических процессов.
Уравнение Аррениуса. Энергетический профиль реакции; энергия активации.
Понятие о теории активных соударений.
Роль стерического фактора.
Понятие о теории переходного состояния.
Катализ. Гомогенный и гетерогенный катализ. Энергетический профиль каталитической реакции.
Особенности каталитической активности ферментов. Уравнение Михаэлиса - Ментен и его анализ.
Приложение 2: Краткий теоретический материал
Химическая кинетика изучает закономерности протекания химических процессов во времени.
Основные понятия кинетики:
Скорость реакции – это изменение концентрации реагирующих веществ в единицу времени:
![]() .
.
Поскольку скорость реакции - величина положительная, то “+” ставится, если используется концентрация продуктов реакции, и “-” - для исходных веществ.
Например, для реакции 3H2+N2 = 2NH3.
![]() .
.
Общая скорость реакции равна скорости реакции по отдельному веществу, деленная на стехиометрический коэффициент, стоящий перед этим веществом в уравнении химической реакции.
Существует понятие средней и истинной скорости реакции.
Средняя скорость в интервале – изменение концентрации реагирующих веществ за некоторый промежуток времени:
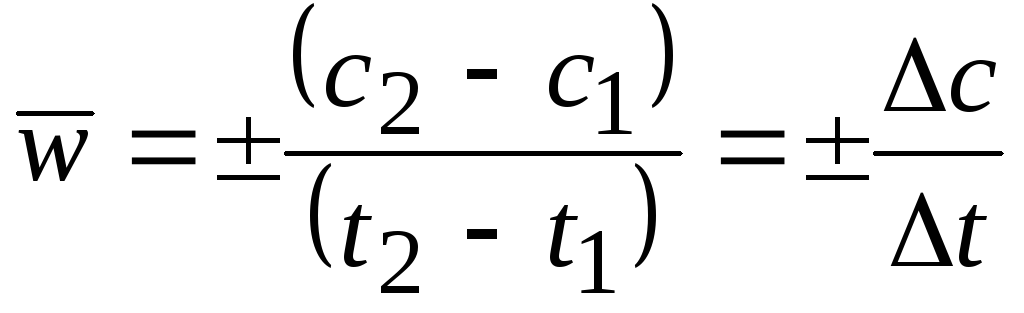 ,
,
Средняя
скорость относится к средней концентрации
![]()
Истинная скорость – изменение концентрации реагирующих веществ в конкретный момент времени и представляет собой предел средней скорости при Dt®0
![]() ,
,
Различают простые и сложные реакции.
Простыми называют реакции, протекающие в одну стадию.
Сложными называют реакции, протекающие в несколько стадий.
Выделяют следующие виды сложных реакций:
параллельные;
последовательные,
сопряженные;
цепные.
Основной постулат химической кинетики – закон действующих масс
w=![]()
Скорость реакции пропорциональна произведению концентрации реагирующих веществ, взятых в некоторых степенях. Эти степени называются частными порядками реакции:
p - частный порядок реакции по веществу А,
q - частный порядок реакции по веществу В.
Сумма частных порядков дает полный порядок реакции n: n=p+q.
k - константа скорости реакции, это скорость реакции при концентрации реагирующих веществ, равных единице (удельная скорость).
Молекулярность реакции - число молекул, реагирующих в одном элементарном акте реакции.
Для реакций различных порядков зависимость скорости от концентрации реагирующих веществ выражается индивидуальным кинетическим уравнением.
1) Реакции нулевого порядка (n=0).
Вид реакции: A®продукт; в этом случае скорость реакции не зависит от концентрации исходного вещества, т.е. концентрация вещества А поддерживается на одном уровне.
Кинетическое
уравнение:
![]() .
или
.
или
![]() ,
,
где k0 – константа скорости реакции нулевого порядка;
t – время от начала реакции до достижения концентрации с;
а - концентрация вещества А при t=0,
с - концентрация вещества А в момент времени t .
Размерность
k0
определяется выражением k0=w,
поэтому
![]() .
.
Время полупревращения t1/2 - время, за которое концентрация исходного вещества уменьшается в 2 раза.
 .
.
2) Реакции первого порядка ( n=1).
Вид реакции: A®продукт;
Кинетическое
уравнение:
![]() или
или![]() ,
,
Размерность константы скорости: k1, [t-1].
Время
полупревращения t1/2:
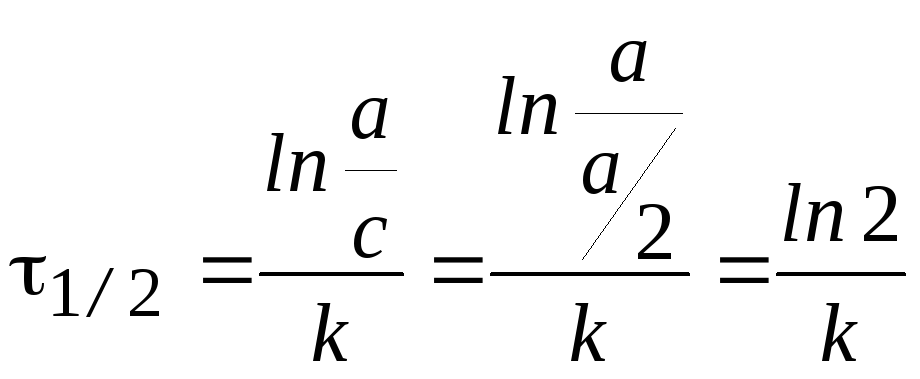 .
.
3) Реакции второго порядка ( n=2).
Вид реакции: A+В®продукт или 2A ®продукт.
Пусть
к началу реакциии концентрации исходных
веществ равны
![]() .
.
Кинетическое
уравнение:
![]() или
или
![]() .
.
Размерность константы скорости: k2, [конц.-1× t-1].
Время
полупревращения
t1/2:
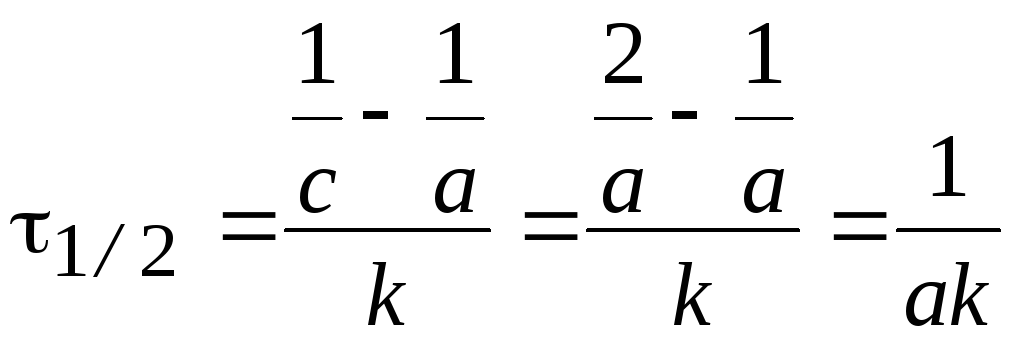 .
.
Размерность константы скорости: k3, [конц.-2× t-1].
В
общем случае
![]() .
.
Экспериментально скорость реакции определяют измерением концентрации реагирующих веществ за определенный промежуток времени с последующим расчетом по формулам средней или истинной скорости реакции.
Константу скорости реакции можно определить представив экспериментальные данные в линейных координатах кинетического уравнения соответствующего порядка.
