
Химическая кинетика изучает закономерности протекания химических процессов во времени.
Основные понятия кинетики:
Скорость реакции – это изменение концентрации реагирующих веществ в единицу времени:
![]() .
.
Поскольку скорость реакции - величина положительная, то “+” ставится, если используется концентрация продуктов реакции, и “-” - для исходных веществ.
Например, для реакции 3H2+N2 = 2NH3.
![]() .
.
Общая скорость реакции равна скорости реакции по отдельному веществу, деленная на стехиометрический коэффициент, стоящий перед этим веществом в уравнении химической реакции.
Существует понятие средней и истинной скорости реакции.
Средняя скорость в интервале – изменение концентрации реагирующих веществ за некоторый промежуток времени:
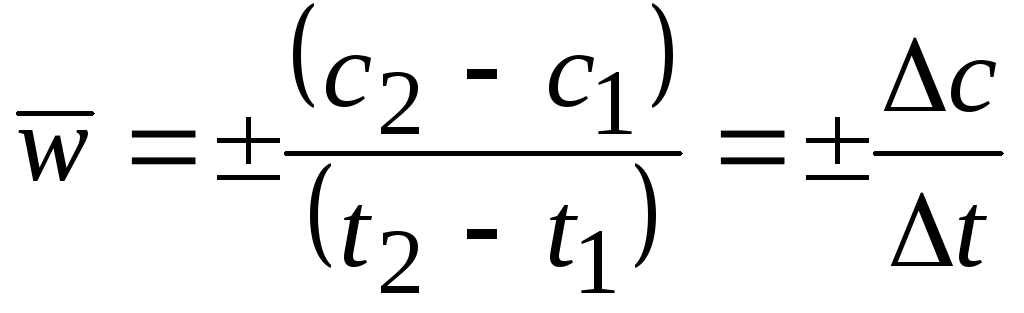 ,
,
Средняя
скорость относится к средней концентрации
![]()
Истинная скорость – изменение концентрации реагирующих веществ в конкретный момент времени и представляет собой предел средней скорости при Dt®0
![]() ,
,
Различают простые и сложные реакции.
Простыми называют реакции, протекающие в одну стадию.
Сложными называют реакции, протекающие в несколько стадий.
Выделяют следующие виды сложных реакций:
параллельные; Реакции, в которых исходные вещества способны образовывать разные продукты реакции или одно вещество одновременно способно реагировать с несколькими веществами, называются параллельными
последовательные, Последовательными называют реакции с промежуточными стадиями, когда продукт предыдущей стадии служит исходным веществом для последующей
сопряженные; Сопряжённые реакции, такие реакции химические, которые протекают только совместно и при наличии хотя бы одного общего реагента
цепные. К цепным реакциям относят реакции, протекающие с образованием свободных радикалов, способных превращать реагенты в конечные продукты, поддерживая постоянство свободных радикалов или даже увеличивая их
Основной постулат химической кинетики – закон действующих масс
w=![]()
Скорость реакции пропорциональна произведению концентрации реагирующих веществ, взятых в некоторых степенях. Эти степени называются частными порядками реакции:
p - частный порядок реакции по веществу А,
q - частный порядок реакции по веществу В.
Сумма частных порядков дает полный порядок реакции n: n=p+q.
k - константа скорости реакции, это скорость реакции при концентрации реагирующих веществ, равных единице (удельная скорость).
Молекулярность реакции - число молекул, реагирующих в одном элементарном акте реакции.
Для реакций различных порядков зависимость скорости от концентрации реагирующих веществ выражается индивидуальным кинетическим уравнением.
1) Реакции нулевого порядка (n=0).
Вид реакции: A®продукт; в этом случае скорость реакции не зависит от концентрации исходного вещества, т.е. концентрация вещества А поддерживается на одном уровне.
Кинетическое
уравнение
![]() ,
,
где k0 – константа скорости реакции нулевого порядка;
t – время от начала реакции до достижения концентрации с;
а - концентрация вещества А при t=0,
2) Реакции первого порядка ( n=1).
Вид реакции: A®продукт;
Кинетическое
уравнение:
![]() ,
,
3) Реакции второго порядка ( n=2).
Вид реакции: A+В®продукт или 2A ®продукт.
Пусть
к началу реакциии концентрации исходных
веществ равны
![]() .
.
Кинетическое
уравнение:
![]() .
.
Экспериментально скорость реакции определяют измерением концентрации реагирующих веществ за определенный промежуток времени с последующим расчетом по формулам средней или истинной скорости реакции.
Константу скорости реакции можно определить представив экспериментальные данные в линейных координатах кинетического уравнения соответствующего порядка.
Влияние температуры на скорость химической реакции
Скорость химической реакции увеличивается с повышением температуры. Приблизительно оценить влияние температуры на скорость реакции можно по правилу Вант-Гоффа:
при повышении температуры на каждые 10 градусов скорость реакции увеличивается в 24 раза.
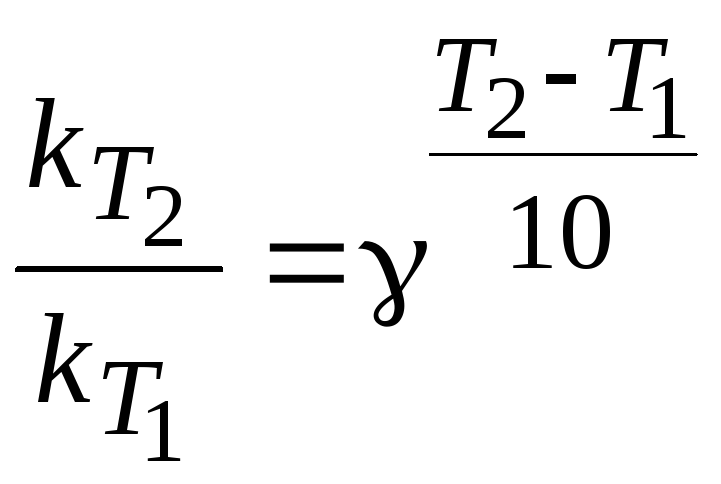 ,
,
где - температурный коэффициент Вант-Гоффа.
k (T1) и k (T2) – константы скорости реакции при температурах Т1 и Т2 .
Для биологических процессов важен определенный температурный интервал, вне которого процесс прекращается. В этом интервале увеличение температуры активизирует протекание жизненно важных процессов до оптимального, а последующее повышение температуры быстро снижает скорость процесса вплоть до прекращения жизнедеятельности организма. Это связано с необратимой тепловой денатурацией белков биологических тканей, а также с инактивацией ферментов (биологических катализаторов).
Более точно зависимость скорости реакции от температуры выражается уравнением Аррениуса. Уравнение Аррениуса в дифференциальной форме:
![]()
где kск константа скорости реакции
Т- температура
R – универсальная газовая постоянная: R=8,314 Дж/моль∙К
Е а
- энергия активации.
а
- энергия активации.
Энергия активации - та избыточная энергия (по сравнению со средней энергией молекул), которой должны обладать сталкивающиеся молекулы, чтобы быть способными к химической реакции (рис.)
Рис.
Энергетический профиль реакции. Е1
и Е2
энергии активации прямой и обратной
реакций.
ΔU=U2
– U1
- тепловой эффект реакции.
Активация вызывается повышением температуры, действием электрического поля, действием квантов света и т.д. Энергия активации Еа постоянна в данном температурном интервале и определяется механизмом реакции.
 .
.
Теоретические представления о механизме химических реакций. Понятие о теории активных соударений.
Для того чтобы произошла химическая реакция, необходимо, чтобы частицы столкнулись. Скорость реакции пропорциональна общему числу двойных столкновений в единицу времени в единице объема
w=qzобщ,
где q – коэффициент пропорциональности.
В теории соударений используются следующие допущения:
Частицы бесструктурны – это шары с радиусом r;
В момент соударения молекулы ведут себя как упругие шары. Т.е. суммарная энергия молекул до и после соударения остается постоянной, но может перераспределяться между молекулами.
Реагируют только молекулы, которые обладают энергией активации.
Число двойных активных столкновений определяется соотношением:
![]() ,
,
где zобщ – общее число столкновений,
zакт – число активных столкновений,
![]() -
доля активных столкновений, равная
множителю Больцмана
-
доля активных столкновений, равная
множителю Больцмана
![]() .
Он тем меньше, чем больше энергия
активации.
.
Он тем меньше, чем больше энергия
активации.
Процесс превращения исходных веществ в продукты происходит мгновенно в момент соударения активных молекул.
Скорость реакции А+В=С
Роль стерического фактора:
Стерический
фактор характеризует вероятность
реакции между молекулами, энергия
которых
![]() и
учитывает необходимость определенной
ориентации реакционноспособных молекул
в момент столкновения.
и
учитывает необходимость определенной
ориентации реакционноспособных молекул
в момент столкновения.
![]() ,
,
откуда предэкспоненциальный множитель А=Рz0.
Недостатки теории активных соударений.
бесструктурность частиц – они рассматриваются как шары
элементарный акт рассматривается как мгновенный, в действительности это сложный процесс перераспределения связей, требующий определенного времени.
Теория активных соударений объясняет много разнообразных факторов, но не объясняет влияния на скорость реакции растворителя, давления, добавок инертных газов, не позволяет сделать теоретическую оценку стерического фактора.
