
ВЫСОКОМОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯ
ВВЕДЕНИЕ
Высокомолекулярные соединения (ВМС) – это химические соединения, молекулы которых имеют высокие молекулярные массы (от нескольких тысяч до многих миллионов). Поэтому такие молекулы называют макромолекулами. Молекулярная масса ВМС составляет 104 – 106 (сравним с молекулярной массой воды, которая равна 18).
Макромолекулы имеют цепное строение; состоят из одинаковых или различных структурных единиц – составных звеньев, представляющих собой атомы или группы атомов, соединённые друг с другом ковалентными связями в линейные последовательности. Последовательность соединённых друг с другом атомов, образующих собственно цепь, называют хребтом цепи, а заместители у этих атомов – боковыми группами. Макромолекулы могут иметь линейное или разветвлённое строение. В разветвлённых макромолекулах различают основную и боковые цепи.
Общая характеристика растворов вмс
Высокомолекулярные вещества (или полимеры) растворяются в различных низкомолекулярных жидкостях, образуя устойчивые равновесные системы с молекулярной дисперсностью компонентов. Таким образом, растворы полимеров являются гомогенными системами, истинными растворами. Являясь истинными растворами, растворы ВМС всё же отличаются от растворов низкомолекулярных веществ, что связано с огромными размерами макромолекул. Однако, несмотря на огромные размеры молекул ВМС в растворах отсутствует граница раздела фаз, так как в одном направлении макромолекула имеет достаточно большую длину, а толщина макромолекулы имеет молекулярные размеры.
Кроме того, на поведение растворов полимеров сильное влияние оказывают форма и отдельные фрагменты строения макромолекул.
Растворение ВМС осуществляется с образованием менее упорядоченной системы из более упорядоченной и, значит, этот процесс протекает с увеличением энтропии (∆S > 0). Растворение ВМС – процесс самопроизвольный, следовательно, при растворении полимеров уменьшается свободная энергия: ∆G = ∆H - T∆S < 0.
Изменение энтальпии (знак ∆Н) при растворении может быть положительным (эндотермический процесс), отрицательным (экзотермический процесс) или равным нулю.
Так как растворы полимеров образуются самопроизвольно с уменьшением свободной энергии, они являются термодинамически устойчивыми системами, которые могут существовать без стабилизаторов неограниченное время. В этом заключается их основное отличие от лиофобных коллоидных систем. В отличие от лиофобных коллоидных систем растворы ВМС являются равновеснымим системами.
Растворы ВМС, подобно растворам низкомолекулярных соединений, могут быть и молекулярными, и ионными, причём в последнем случае природа зарядов связана с наличием функциональных групп.
Взаимодействие вмс с растворителем
При взаимодействии ВМС с растворителем происходит их набухание.
Набуханием полимера называется увеличение его объёма и массы во времени при контакте с растворителем.
При набухании объём и масса полимера могут увеличиться в 10 – 15 раз.
Количественной мерой набухания является степень набухания α:
α = ![]() ∙ 100% или α =
∙ 100% или α = ![]() ∙ 100%
∙ 100%
где m0 и V0 – масса и объём сухого полимера; m и V – масса и объём набухшего полимера.
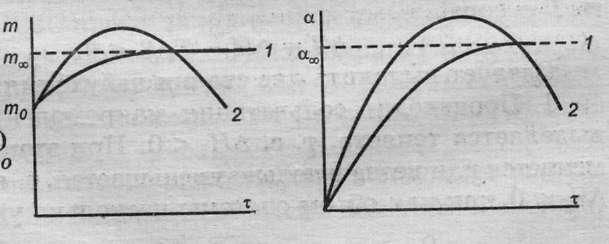 Набухание
может быть ограниченным и неограниченным.
В случае ограниченного набухания
m и α достигают постоянных
при данной температуре и концентрации
предельных значений m∞
и α∞ (кривая 1) и далее не
изменяются. При неограниченном набухании
(кривая 2) эти параметры достигают
максимальных значений, которые затем
уменьшаются за счёт растворения полимера.
В этом случае набухание – первая стадия
растворения полимера.
Набухание
может быть ограниченным и неограниченным.
В случае ограниченного набухания
m и α достигают постоянных
при данной температуре и концентрации
предельных значений m∞
и α∞ (кривая 1) и далее не
изменяются. При неограниченном набухании
(кривая 2) эти параметры достигают
максимальных значений, которые затем
уменьшаются за счёт растворения полимера.
В этом случае набухание – первая стадия
растворения полимера.
Р
Причина набухания состоит в различии свойств ВМС и низкомолекулярных соединений (НМС).
ВЯЗКОСТЬ РАСТВОРОВ ПОЛИМЕРОВ
Вязкость жидкостей можно для простоты определить как сопротивление жидкости передвижению одного её слоя относителоьно другого при сдвиге, растяжении и других видах деформации.
Вязкость характеризуют интенсивностью работы, затрачиваемой на осуществление течения газа или жидкости с определённой скоростью.
Вязкость золей (η) описывается уравнением Эйнштейна:
η = η0(1 + 2,5φ)
где η0 – вязкость дисперсионной среды; φ – объёмная концентрация дисперсной фазы.
Вязкость растворов, содержащих макромолекулы, обычно выше вязкости растворов низкомолекулярных веществ и вязкости коллоидных систем при одной и той же концентрации.
Вязкость растворов ВМС не является постоянной величиной; она зависит от условий измерения, в первую очередь от скорости движения раствора в вискозиметре.
В растворах полимеров происходит образование пространственных структур, образуемых сцеплением макромолекул, что и вызывает резкое повышение вязкости.
По этой причине вязкость концентрированных растворов ВМС может быть неодинаковой (анизотропной) в различных направлениях. Вязкость макромолекул с выпрямленными и ориетированными хаотично по отношению к направлению движения звеньями выше, чем вязкость макромолекул, которые имеют форму клубка или глобул.
Если вязкий раствор ВМС продавливать под давлением через капилляр, то макромолекулы будут ориентироваться и вытягиваться в капилляре, а поэтому наблюдаемая вязкость раствора снижается.
Вязкость растворов ВМС в значительной степени зависит от температуры и свойств растворителя. Растворители способны влиять на конформационную форму макромолекул и за счёт этого изменять вязкость одного и того полимера в разных растворителях. Таким образом, вязкость растворов ВМС определяется природой полимера и природой растворителя.
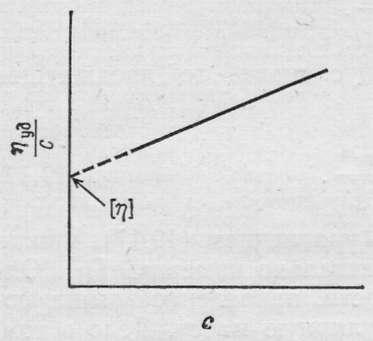
Величину [η] называют характеристической вязкостью или предельным числом вязкости.
[η] = lim ηуд / с
C → 0
Характеристическую вязкость определяют на основании вискозиметрических измерений, используя значения относительной, удельной и приведённой вязкости в качестве вспомогательных величин.
В настоящее время оно известно, как уравнение Марка-Куна-Хаувинка и имеет следующий вид:
[η] = KM α,
где К – постоянная величина, экспериментально определяемая для данных макромолекул и растворителя. Показатель степени α зависит от формы макромолекул. Молекулярная масса, определяемая по уравнению Марка-Куна-Хаувинка, называется средневязкостной молекулярной массой Мη.
Величина характеристической вязкости позволяет определить как относительную молекулярную массу полимера, так и размеры и форму его макромолекул.
БЕЛКИ КАК ПОЛИЭЛЕКТРОЛИТЫ
Полиэлектролиты это полимеры, в макромолекулах которых содержатся ионогенные группы. В растворе макромолекула полиэлектролита представляет собой полиион, окруженный эквивалентным количеством противоионов, малых по размеру с зарядами противоположного знака.
Белки и аминокислоты в водных растворах находятся преимущественно в форме биполярных ионов:
H2N – R – COOH ↔ H3N+ – R - COO‾
БИПОЛЯРНЫЙ ИОН
(ЦВИТТЕР-ИОН)
В кислой среде, когда в растворе имеется избыток ионов водорода, подавляется ионизация карбоксильных групп, молекула белка ведёт себя как основание:
H3N+ – R - COO‾ + Н+ → H3N+ – R – COOН
Молекула присоединяет протон и становится положительно заряженным поликатионом.
В щелочной среде, в которой много гидроксид ионов, будет подавляться диссоциация аминогрупп:
H3N+ – R - COO‾ + ОН ‾ → H2N – R – COO‾ + Н2О
и молекула превращается в отрицательно заряженный полианион, т.е. молекула ведёт себя как кислота.
Меняя рН среды, можно изменять ионизирующую способность макромолекул белков. Константы диссоциации кислотных и основных групп белков не совпадают. По этой причине число диссоциированных основных и кислотных групп макромолекул белка может быть одним и тем же только при определённом значении рН среды. Такое состояние соответствует изоэлектрической точке (ИЭТ), т.е. значению рН среды, при котором число ионизированных основных групп равно числу ионизированных кислотных групп.
Изоэлектрическим состоянием белка называется состояние белковой молекулы, при котором её положительные и отрицательные заряды взаимно скомпенсированы.
Молекулу белка в изоэлектрическом состоянии можно считать нейтральной, хотя в ней имеются ионизированные группы.
Условно молекулу белка в изоэлектрическом состоянии можно изобразить так:
+NH3 –R – COO ‾
Изоэлектрическая точка белка (ИТБ) – это значение рН, при котором белок переходит в изоэлектрическое состояние.
ИЭТ белков лежит в пределах рН от 2 (у пепсина) до 10,6 (у цитохрома С), но преимущественно ИЭТ белков соответствует рН < 7. ИЭТ некоторых белков достигается при следующих значениях рНИЭТ: пепсина (фермент желудочного сока) – 2,0; казеина (белок, образующийся при свёртывании молока) – 4,6; альбумина яйца – 4,8; карбоксигемоглобина – 6,87; химотрипсина (фермент сока поджелудочной железы) – 8,6.
СТУДНИ И ПРОЦЕСС СТУДНЕОБРАЗОВАНИЯ
Студни – это структурированные системы, образующиеся при отвердевании жидких растворов полимеров или при набухании твёрдых полимеров.
Ограниченное набухание полимеров приводит к образованию студней. Примером могут служить такие системы как набухший в органическом растворителе каучук или застывший при охлаждении раствор желатины.
Студни получаются из растворов ВМС, а гели из золей. Студень представляет собой пространственную сетку из макромолекул полимера, заполненную молекулами растворителя. Студень система гомогенная.
Студни могут образовываться не только в результате набухания, но и из твёрдых полимеров, а также из их растворов. Схематически процесс студнеобразования можно представить следующей схемой:
Ограниченное набухание Застудневание
Твёрдые ВМС -----------------→ Студни ←-------------------- Растворы ВМС
Застудневание (желатинирование) – процесс фазового перехода из жидкого состояния в твёрдое состояние. Образование студня происходит в результате взаимодействия между макромолекулами ВМС.
Застудневание (или желатинирование) может происходить самопроизвольно под действием электролитов и при изменении температуры.
На способность к застудневанию водных растворов белков (амфотерные полиэлектролиты) сильно влияет рН среды. Процесс образования студня лучше всего идёт при значении рН, отвечающем изоэлектрической точке, так как при этом по всей длине молекулярной цепи расположено одинаковое число противоположно заряженных ионизированных групп, что способствует установлению связи между отдельными макромолекулами.
Повышение температуры, если только в системе не происходит необратимых химических изменений, обычно препятствуют застудневанию. Наоборот, понижение температуры, как правило, способствует застудневанию.
На процесс застудневания влияют размеры макромолекул и их разветвлённость. Особенно легко образуют студни ВМС, у которых длина макромолекул достигает нескольких тысяч ангстрем и в тысячи раз превышает их поперечные размеры.
Застудневанию растворов ВМС всегда способствует повышение концентрации, так как при этом возрастает частота столкновений между макромолекулами или их участками и увеличивается число связей, образующихся в единице объёма студня.
Чем выше концентрация полимера в растворе, тем выше температура, при которой растворы ВМС переходят в студни.
