
Zanyatie_1_Mod2_termodin
.docПриложение 1: Краткий теоретический материал
Химическая термодинамика – это раздел физической химии, изучающий взаимопревращение теплоты и энергии при протекании химической реакции.
Термодинамика основана на ряде понятий: система, состояние системы, параметры состояния системы, функции состояния системы, внутренняя энергия системы и т. д.
Термодинамическая система – это тело или группа тел, взаимодействующих между собой, и отделённых от окружающей среды реальной или воображаемой поверхностью раздела.
Изолированная система – это система, которая не обменивается с окружающей средой ни веществом, ни энергией.
Закрытая система – это система, которая не обменивается со средой веществом, но обменивается энергией.
Открытая система – это система, которая обменивается со средой и веществом, и энергией. Примером открытой системы является живая клетка.
Состояние системы – это набор свойств системы, позволяющих описать систему с точки зрения термодинамики.
Физические свойства, характеризующие состояние системы, называют параметрами состояния системы.
Экстенсивные параметры – это параметры, которые зависят от количества вещества системы и суммируются при объединении систем (объём, масса, энергия, площадь и т.д.).
Интенсивные параметры – это параметры, которые не зависят от количества вещества и выравниваются при объединении систем (температура, давление, концентрация, плотность, поверхностное натяжение).
Переход системы из одного состояния в другое с изменением хотя бы одного параметра называется термодинамическим процессом.
Если процесс идет при постоянном давлении, он называется изобарным процессом. При постоянном объёме - изохорным, при постоянной температуре - изотермическим.
Функция состояния - это характеристика системы, которая не поддается прямому измерению, а рассчитывается через параметры состояния.
Значение функции состояния не зависит от способа его достижения, а только от начального и конечного состояния системы. Внутренняя энергия является функцие состояния:
Внутренняя энергия - сумма всех видов энергий движения и взаимодействия частиц, составляющих систему.
Теплота - форма передачи энергии путем хаотического движения микрочастиц.
Работа - форма передачи энергии путём направленного движения макросистемы как целого.
Первый закон термодинамики (первое начало термодинамики): энергия не возникает из ничего и не исчезает бесследно, а переходит из одного вида энергии в другой или приращение внутренней энергии системы в некотором процессе равно теплоте, полученной системой, плюс работа, совершенная над системой.
∆U=Q+A
∆U - внутренняя энергия(Дж)
Q – теплота(Дж)
A – работа(Дж)
На основе 1 закона термодинамики, являющегося фундаментальным законом природы, простыми расчетами получают ценные сведения о процессах обмена веществ и энергии в организме.
Термохимия – это раздел термодинамики, изучающий теплоты протекания химических реакций.
Закон Гесса: теплота химической реакции, протекающей при постоянном давлении или объёме, не зависит от пути процесса, а только от начального и конечного состояний системы.
Если из одних веществ можно получить другие разными путями, то суммарный тепловой эффект по первому пути равен суммарному тепловому эффекту по второму пути. Закон Гесса позволяет на практике рассчитывать тепловые эффекты реакций
Энтальпия-это функция состояния, приращение которой равно тепловому эффекту процесса, протекающего при постоянном давлении.
Способы расчета стандартной энтальпии химической реакции
-
По стандартным энтальпиям (теплотам) образования веществ
Стандартная энтальпия (теплота) образования вещества – это тепловой эффект реакции образования 1 моль химического соединения из простых веществ в стандартных условиях: Т=289 К, Р=1 атм=101325 Па.
![]()
Теплоты образования простых веществ равны нулю.
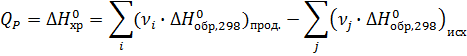
νi , νj – стехиометрические коэффициенты перед соответствующими веществами в уравнении реакции.
-
По стандартным энтальпиям (теплотам) сгорания веществ
Стандартная энтальпия (теплота) сгорания вещества – это тепловой эффект реакции полного сгорания 1 моль химического соединения в стандартных условиях.
![]()
Теплоты сгорания высших оксидов (в том числе СО2 и Н2О) приняты равными нулю.
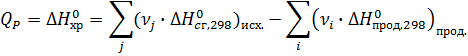
Второй закон термодинамики устанавливает возможность, направление и глубину протекания самопроизвольного процесса.
Самопроизвольный процесс - процесс, протекающий без каких-либо воздействий извне, и приближающий систему к состоянию равновесия.
Термодинамически обратимый процесс– процесс, протекающий в прямом и в обратном направлении без изменений в системе и в окружающей среде, т.е. при переходе из начального состояния в конечное все промежуточные состояния являются равновесными.
При наличии неравновесных промежуточных состояний процесс считают термодинамически необратимым.
Энтропия - мера энергетического беспорядка в системе, мера хаоса, мера той энергии, которая рассеивается в виде тепла и не превращается в работу.
Второй закон термодинамики (второе начало термодинамики): Самопроизвольно протекают процессы, приводящие к увеличению общей энтропии системы и окружающей среды
ΔSсист + ΔSсреды ≥ 0 или ΔS ≥ 0
Физический смысл энтропии: энтропия – это количество энергии, рассеянной 1 моль вещества, отнесенное к 1 градусу.
S
![]()
Энтропия – экстенсивная функция.
Энтропия
является функцией состояния системы.
Это значит, что
![]() характеризует
систему, а
не процесс. Её изменение зависит только
от начального и конечного состояния
системы и не зависит от пути перехода:
характеризует
систему, а
не процесс. Её изменение зависит только
от начального и конечного состояния
системы и не зависит от пути перехода:
![]() .
.
Для
химической реакции изменение энтропии:
![]() прод
-
прод
-![]() исх
исх
Вероятностный смысл энтропии
Для любой термодинамической системы различают макросостояние и микросостояние. Макросостояние системы характеризуется макропараметрами (Т, Р, V, U и т.д.). В то же время система состоит из бесконечно большого количества микрочастиц. Микросостояние – это расположение и энергия отдельных молекул в данный момент времени.
Одно макроскопическое состояние системы может реализоваться несколькими разными микросостояниями. Для каждого микросостояния существует вероятность (Р) того, что система находится именно в этом микросостоянии. Поэтому все процессы в термодинамике носят вероятностный или статистический характер, определяющий переход системы из менее вероятного в более вероятное состояние.
Больцман в 1896 г. постулировал, что энтропия связана с термодинамической вероятностью логарифмической зависимостью
S
= k
ln
W
 уравнение
Больцмана
уравнение
Больцмана
k
– константа Больцмана: k
=![]() =
1,38∙10-23
Дж/градус;
=
1,38∙10-23
Дж/градус;
W – число микросостояний, с помощью которых можно реализовать данное макросостояние: W=1/Р;
Р – вероятность того, что система находится именно в этом микросостоянии.
С увеличением порядка в системе уменьшается число микросостояний, с помощью которых можно реализовать это состояние, и уменьшается энтропия.
При переходе вещества из газообразного состояния в жидкое и далее в кристаллическое энтропия уменьшается. Согласно уравнению Больцмана энтропия может быть равна нулю только в одном единственном состоянии.
В 1911 г. Планк сформулировал постулат, известный как третий закон термодинамики:
энтропия идеально построенного кристалла чистого вещества (без дефектов и примесей) при абсолютном нуле равна нулю.
Этот закон устанавливает нуль отсчета для энтропии, что позволяет рассчитывать её абсолютное значение, т.к.
![]()
В изолированной системе (U, V=const) в самопроизвольном процессе возрастает энтропия. В состоянии равновесия энтропия максимальна и постоянна.
В закрытой и открытой системе критерием самопроизвольного протекания процесса является уменьшение энергии Гиббса (G).
G=H-TS
H – энтальпия
T – температура
S – энтропия
Используя энергию Гиббса, второй закон термодинамики можно выразить так:
При постоянстве температуры и давления в системе самопроизвольно протекают только процессы, ведущие к уменьшению энергии Гиббса. В состоянии равновесия энергия Гиббса равна нулю.
∆G ≤0 (р, Т=const)
При ∆G<0 реакция самопроизвольно протекает в прямом направлении;
∆G>0 в обратном направлении
∆G=0 реакция находится в состоянии равновесия.
Изменение энергии Гиббса определяется формулой
![]()
Первое слагаемое называют энтальпийным фактором, второе – энтропийным фактором. Уменьшению энергии Гиббса, а значит и самопроизвольному протеканию процесса, способствует уменьшение ∆Н (процессы с выделением тепла) и рост энтропии (процессы с ростом разупорядоченности в системе).
Стандартная энергия Гиббса химической реакции рассчитывается по формуле с использованием табличных данных:
![]()
или
![]() ,
,
где
![]()
Экзергонические процессы – химические реакции, в результате которых уменьшается энергия Гиббса и система совершает работу.
Эндергонические процессы – химические реакции, в результате которых возрастает энергия Гиббса и над системой совершается работа.
Например, окисление глюкозы в крови процесс экзергонический, поскольку, сопровождается уменьшением энергии Гиббса, а в результате этой реакции возможно осуществлять различные виды работ в организме.
