
- •Методическая разработка по аналитическим методам полярографии и вольтамперометрии для студентов, которые еще не проходили курс физической химии.
- •Принцип метода.
- •Как зависит вольтамперограмма от состава раствора. Форма полярографической кривой.
- •Какие существуют способы усиления сигнала в полярографии?
- •В чем сущность метода инверсионной вольтамперометрии? Из каких стадий он состоит?
- •В чем сущность каталитического метода усиления сигнала в аналитической вольтамперометрии?
- •Каким образом организуется вольтамперометрический эксперимент?
- •Какие бывают методы получения количественных данных в аналитической вольтамперометрии?
В чем сущность метода инверсионной вольтамперометрии? Из каких стадий он состоит?
Еще более высокие чувствительности были достигнуты при появлении инверсионных, или накопительных, методов анализа в вольтамперометрии. Метод инверсионной вольтамперометрии (ИВА) заключается в том, что определяемое вещество первоначально в какой-то форме накапливают на поверхности электрода, а затем проводят развертку напряжения, сопровождающуюся появлением измеряемого сигнала. Опишем, например, как используется этот прием при определении меди, свинца, кадмия и цинка методом ИВА (самый распространенный вид анализа в этой области, тем более, что перечисленные элементы можно определять одновременно).
Первоначально на электрод подается сильное отрицательное напряжение (скажем, -1400 мВ, и все перечисленные металлы начинают выделяться в свободном виде на поверхности электрода по реакции типа (3), как в гальванике. Для того, чтобы реакция шла с постоянной скоростью, раствор либо перемешивают, либо стабилизируют гидродинамические условия каким-то другим способом. Этот процесс проводят в диффузионной области полярографических кривых для всех определяемых ионов. Через фиксированное время, которое выбирается в зависимости от того, какую чувствительность мы хотим получить, накопление прекращают, и начинают развертку потенциала в положительную (окислительную) область. Металлы один за другим, в строгом соответствии с электрохимическим рядом напряжений, растворяются с поверхности электрода в сответствии с реакцией
Cu = Cu+2 + 2e (10)
Растворение каждого металла сопровождается появлением пика на вольтамперной кривой.
После окончания развертки (измерения) электрод держат при положительном потенциале, чтобы удалить остатки металлов (очистка). Поскольку этот прием включает стадию накопления чувствительность очень высока, и составляет до 0,01 мкг/л. Для более эффективного накопления и получения металлов в более однородном состоянии, а также для того, чтобы уменьшить взаимодействие накопленных на электроде металлов между собой, в раствор обычно добавляют небольшое количество ртутной соли, которая при электролизе дает на поверхности электрода ртутную пленку (ртутно-пленочный электрод).
Несмотря на видимые преимущества инверсионно-вольтамперометрического метода анализа, его не всегда удается применить, так как не всегда удается найти такую удачную реакцию, как для случая меди, свинца, кадмия и цинка. Возможность включить в этот список каждый новый элемент воспринимается как большая удача. В некоторых случаях элемент не выделяется в свободном виде, а только меняет свою валентность. Это дает характерный аналитический сигнал, но чувствительность обычно невелика. Чтобы усилить такой сигнал, применяется каталитический метод усиления сигнала в аналитической вольтамперометрии.
В чем сущность каталитического метода усиления сигнала в аналитической вольтамперометрии?
Сущность каталитического метода усиления сигнала в аналитической вольтамперометрии заключается в том, что фоновый электролит выбирается таким образом, что он способен взаимодействовать с продуктами превращения определяемого вещества на электроде с регенерацией исходного определяемого вещества. Фоновый электролит регенерирует исходное определяемое вещество за счет быстрой реакции в объеме раствора, так что вблизи электрода каждая молекула (или иона) определяемого вещества многократно реагирует с поверхностью электрода, что приводит к резкому увеличению тока. Таким образом, суммарная реакция сводится к превращению компонентов фонового электролита, а определяемый компонент служит только катализатором процесса.
В качестве примера рассмотрим метод определения хрома в присутствии избытка нитрата в качестве фонового электролита (рис.4). При потенциале около -1000 мВ трехвалентный хром восстанавливается на электроде с образованием двухвалентного иона хрома, который представляет собой метастабильное состояние. В избытке нитрата двухвалентный хром быстро реагирует с нитратом, превращаясь обратно в трехвалентное состояние, так что каждый ион трехвалентного хрома «просигналит» много раз. Предел обнаружения составляет 1 мкг/л. Аналогичным образом определяются ион уранила на фоне нитрата и анион молибдата на фоне бромата калия.
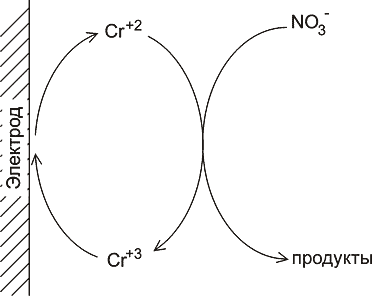
Рис. 4. Схема процесса каталитического опрееления ионов хрома в присутствии избытка нитрат-ионов (см. текст).
