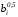24-02-2015_23-17-53 / 1-Задачи-термодинамика
.docx
ЗАДАЧИ ПО РАЗДЕЛАМ ТЕРМОДИНАМИКИ
Уравнения состояния идеального и реального газа
-
Определить плотность и удельный объем метана при нормальных и стандартных физических условиях, а также при давлении
 и температуре
и температуре

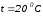 ,
используя уравнения состояния идеального
и реального газа. Сопоставить и
проанализировать полученные результаты
(ПРИЛОЖЕНИЕ).
,
используя уравнения состояния идеального
и реального газа. Сопоставить и
проанализировать полученные результаты
(ПРИЛОЖЕНИЕ).
-
В баллоне объемом 40 л находится азот под давлением 75 бар и имеет температуру 20 0С. Пользуясь уравнениями состояния идеального и реального газа, определить плотность газа и сравнить полученные результаты (ПРИЛОЖЕНИЕ).
-
Определить массовый и объемный расход природного газа при давлении
 и температуре
и температуре
 ,
если его коммерческий расход составляет
,
если его коммерческий расход составляет
 .
Молярная масса газа равна
.
Молярная масса газа равна
 ,
а значение его коэффициента сжимаемости
составляет
,
а значение его коэффициента сжимаемости
составляет
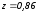 .
.
Газовые смеси
-
Газовая смесь имеет следующий массовый состав:
-
метан
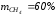 ;
; -
азот
 ;
; -
углекислый газ
 ;
; -
этилен
 ;
; -
водород
 ;
; -
этан
 .
.
Определить молярную
массу, газовую постоянную и плотность
смеси, а также молярные концентрации и
парциальные давления компонентов смеси,
если давление смеси равно
 ,
а температура –
,
а температура –
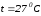 .
.
-
При давлении 820 мм рт. ст. и температуре 37 0С плотность смеси кислорода О2 и углекислого газа СО2 составляет
 .
Определить массовые и молярные
концентрации компонентов смеси, а также
газовую постоянную смеси.
.
Определить массовые и молярные
концентрации компонентов смеси, а также
газовую постоянную смеси.
-
В камеру предварительного смешения камеры сгорания ГТД подается в секунду 1 кг природного газа и 16 кг воздуха. Температура воздуха перед смешением равна
 ,
температура природного газа
,
температура природного газа
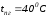 .
Определить коммерческий и объемный
расход газовоздушной смеси на входе в
камеру сгорания, если давление в камере
смешения составляет
.
Определить коммерческий и объемный
расход газовоздушной смеси на входе в
камеру сгорания, если давление в камере
смешения составляет
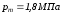 .
Определить также температуру
.
Определить также температуру
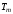 и изобарную теплоемкость смеси
и изобарную теплоемкость смеси
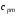 ,
если молярная масса природного газа
равна
,
если молярная масса природного газа
равна
 (
(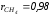 ),
а его теплоемкость имеет значение
cpm(пг)
= 2,33 кДж/(кг·К).
),
а его теплоемкость имеет значение
cpm(пг)
= 2,33 кДж/(кг·К).
Таблица 1
Удельные изобарные теплоемкости идеальных газов cpm, кДж/(кг·К)
|
Газ |
Температура, К |
|||||
|
250 |
300 |
350 |
400 |
450 |
500 |
|
|
Азот N2 Аммиак NH3 Водород H2 Водяной пар H2О Воздух Кислород O2 Окись углерода CO Углекислый газ CO2 Метан CH4 Этан C2H6 Пропан C3H8 Бутан н-C4H10 Пентан н-C5H12 |
1,042 - 13,98 1,856 1,006 0,915 1,043 0,800 2,143 1,588 1,460 1,478 1,468 |
1,041 2,158 14,31 1,862 1,007 0,920 1,043 0,851 2,240 1,775 1,680 1,686 1,675 |
1,042 2,207 14,43 1,870 1,009 0,929 1,045 0,900 2,379 1,978 1,910 - - |
1,045 2,287 14,48 1,877 1,014 0,942 1,049 0,942 2,535 2,188 2,130 2,132 2,120 |
1,050 2,375 14,50 1,888 1,021 0,956 1,055 0,981 2,704 2,396 2,370 - - |
1,056 2,467 14,52 1,900 1,030 0,972 1,065 1,020 2,884 2,597 2,580 2,546 2,529 |
4. Аэростат заполнен смесью, в которой по массе 40 % водорода и 60 % азота. Объем аэростата равен 6000 м3. Определить подъемную силу аэростата, если температура газовой смеси равна -3 0С, а температура и давление воздуха равны соответственно -23 0С, 400 мм рт. ст. Масса оболочки аэростата составляет 1,2 т.
Первое начало термодинамики
-
При испытании двигателей для определения мощности используется тормоз. При этом работа расходуется на преодоление сил трения и превращается в теплоту, 20 % которой рассеивается в пространстве, а 80 % отводится охлаждаемой тормоз водой.
Какой часовой
расход охлаждающей воды, подводимой к
тормозу, обеспечит его охлаждение, если
крутящий момент на валу равен
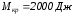 ,
частота оборотов вала двигателя
составляет
,
частота оборотов вала двигателя
составляет
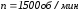 ,
а допустимое повышение температуры
воды –
,
а допустимое повышение температуры
воды –
 .
Теплоемкость воды принять равной
.
Теплоемкость воды принять равной
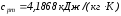 .
(Мощность двигателя
.
(Мощность двигателя
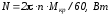 ).
).
-
Определить КПД двигателя мощностью
 при расходе топлива
при расходе топлива
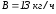 .
Низшую теплоту сгорания топлива принять
равной
Qнр
= 40
МДж/кг.
.
Низшую теплоту сгорания топлива принять
равной
Qнр
= 40
МДж/кг.
-
Газ переводится из состояния 1 в состояние 2 в первом случае по пути 1-а-2, а во втором по пути 1-б-2 (рис. 1). Известно, что давление в точках 1 и 2 равны соответственно
 ,
,
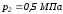 ,
а изменение объема
,
а изменение объема
 .
.
Определить, будет ли отличаться подведенное и отведенное количество теплоты, и если да, то насколько.
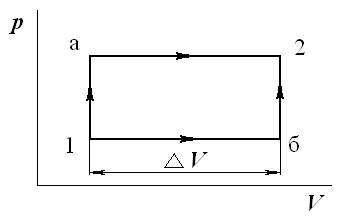
Рис. 1
-
В канале произвольной формы течет природный газ, массовый расход которого составляет
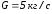 (рис. 2). На входе в канал удельная
энтальпия газа, его скорость и высота
входного сечения равны соответственно:
(рис. 2). На входе в канал удельная
энтальпия газа, его скорость и высота
входного сечения равны соответственно:
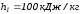 ,
,
 ,
,
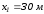 ,
а на выходе из канала эти характеристики
потока имеют следующие значения:
,
а на выходе из канала эти характеристики
потока имеют следующие значения:
 ,
,
 ,
,
 .
Протекая в канале, газ отдает в окружающую
среду 20 кДж/с
теплоты. В канале установлена турбина.
Определить, какую работу совершил бы
природный газ
.
Протекая в канале, газ отдает в окружающую
среду 20 кДж/с
теплоты. В канале установлена турбина.
Определить, какую работу совершил бы
природный газ
 в случае обратимого процесса.
в случае обратимого процесса.

Рис. 2
Процессы
1.
1 кг
метана политропно расширяется от p1
= 0,2
МПа до p2
= 0,1
МПа, причем
объем его увеличился в 4 раза; начальная
температура метана равна
20
0С.
Определить показатель политропы,
начальный и конечный объем, конечную
температуру, термодинамическую и
потенциальную работу. Изобарная
теплоемкость равна
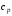 = 2,24 кДж/(кг·К).
Изобразить процесс в координатах
= 2,24 кДж/(кг·К).
Изобразить процесс в координатах
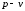 и
и
 .
.
2.
5 кг
метана сжимается политропно с показателем
n
= 2 от p1
= 0,1
МПа до p2
= 0,6
МПа. Начальная
температура метана равна t1
= 15 0С.
Определить работу и конечные параметры
метана. Изобарная теплоемкость равна
 = 2,24 кДж/(кг·К).
Изобразить процесс в координатах
= 2,24 кДж/(кг·К).
Изобразить процесс в координатах
 и
и
 .
.
3.
При политропном сжатии 1
кг воздуха
до объема v2
= 0,1
v1
температура
возросла с 10
0С
до 90 0С;
начальное давление воздуха равно 0,08
МПа. Определить
конечные параметры газа, показатель
политропы, термодинамическую и
потенциальную работу, работу и количество
теплоты. Изобарная теплоемкость равна
ср
= 1,005 кДж/(кг·К).
Изобразить процесс в координатах
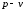 и
и
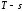 .
.
4.
В цилиндре дизеля воздух с начальными
параметрами: давление –
0,1
МПа и
температура – 20
0С
сжимается в процессе с показателем
политропы n
=1,36. Сжатие идет до достижения воздухом
температуры 700
0С.
Определить конечное давление, степень
сжатия v1/v2,
термодинамическую и потенциальную
работу. Изобразить процесс в координатах
 и
и
 .
.
5.
Воздух расширяется политропически,
совершая термодинамическую работу,
равную 270
кДж. Определить
показатель политропы, если от воздуха
отводится 92
кДж теплоты.
Изобарная теплоемкость воздуха равна
cр
= 1,005 кДж/(кгК).
Изобразить процесс в координатах
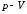 .
.
6.
0,8 м3
метана, имеющего температуру 20
0С
и давление 0,7
МПа, адиабатно
расширяется до трехкратного объема.
Определить конечные параметры метана,
термодинамическую работу, количество
теплоты, изменение внутренней энергии
и энтальпии. Изобарная теплоемкость
равна cр
= 2,25 кДж/(кгК).
Изобразить процесс в координатах
 и
и
 .
.
7.
К 10 кг
метана в изохорном процессе подведено
1885 кДж
теплоты, а затем в изобарном процессе
объем метана уменьшается в 2,5 раза.
Начальная температура метана равна 17
0С,
а давление – 0,8
МПа. Определить
конечные параметры метана, работу,
количество теплоты, изменение внутренней
энергии. Изобарная теплоемкость метана
принять равной
cр
= 2,25 кДж/(кгК).
Изобразить процесс в координатах
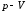 и
и
 .
.
ПРИЛОЖЕНИЕ
Таблица П 1
Характеристики компонентов, входящих в состав природных газов
|
Газ |
Хими-ческая формула |
Молярная
масса
|
Крити-ческая температура Tкр, К |
Крити-ческое давление pкр, МПа |
Температура кипения при p = pc, Tкп, К |
Фактор
|
|
Метан |
CH4 |
16,043 |
190,555 |
4,5988 |
111,65 |
0,0436 |
|
Этан |
C2H6 |
30,070 |
305,83 |
4,880 |
184,55 |
0,0894 |
|
Пропан |
C3H8 |
44,097 |
369,82 |
4,250 |
231,05 |
0,1288 |
|
н-Бутан |
н-C4H10 |
58,123 |
425,14 |
3,784 |
272,67 |
0,1783 |
|
и-Бутан |
и- C4H10 |
58,123 |
408,13 |
3,648 |
261,42 |
0,1703 |
|
н-Пентан |
н-C5H12 |
72,150 |
469,69 |
3,364 |
309,19 |
0,2345 |
|
и-Пентан |
и- C5H12 |
72,150 |
460,39 |
3,381 |
301,02 |
0,2168 |
|
н-Гексан |
н-C6H14 |
86,177 |
506,4 |
3,030 |
341,89 |
0,2846 |
|
н-Гептан |
н-C7H16 |
100,204 |
539,2 |
2,740 |
371,58 |
0,3521 |
|
н-Октан |
н-C8H18 |
114,231 |
568,4 |
2,490 |
398,83 |
0,4278 |
|
Ацетилен |
C2H2 |
26,038 |
308,33 |
6,139 |
189,15 |
0,0837 |
|
Этилен |
C2H4 |
28,054 |
282,35 |
5,042 |
169,44 |
0,0775 |
|
Пропилен |
C3H6 |
42,081 |
364,85 |
4,601 |
225,45 |
0,1225 |
|
Бензол |
C6H6 |
78,114 |
562,16 |
4,898 |
353,25 |
0,2530 |
|
Толуол |
C7H8 |
92,141 |
591,80 |
4,106 |
383,78 |
0,3286 |
|
Водород |
H2 |
2,0159 |
33,2 |
1,297 |
20,35 |
-0,0051 |
|
Водяной пар |
H2O |
18,0153 |
647,14 |
22,064 |
373,15 |
0,2191 |
|
Аммиак |
H3N |
17,0306 |
405,5 |
11,350 |
239,75 |
0,1049 |
|
Метанол |
CH4O |
34,042 |
512,64 |
8,092 |
337,85 |
0,3286 |
|
Сероводород |
H2S |
34,082 |
373,2 |
8,940 |
212,85 |
0,1000 |
|
Метилмер-каптан |
CH4S |
48,109 |
470,0 |
7,230 |
279,10 |
0,1483 |
|
Диоксид серы |
SO2 |
64,065 |
430,8 |
7,884 |
263,15 |
0,1414 |
|
Гелий |
He |
4,0026 |
5,19 |
0,227 |
4,21 |
0 |
|
Неон |
Ne |
20,1797 |
44,40 |
2,760 |
27,09 |
0 |
|
Аргон |
Ar |
39,948 |
150,65 |
4,866 |
87,29 |
0,0265 |
|
Монооксид углерода |
CO |
28,010 |
132,85 |
3,494 |
81,65 |
0,0200 |
|
Азот |
N2 |
28,135 |
126,2 |
3,390 |
77,35 |
0,0173 |
|
Воздух |
- |
28,9626 |
- |
- |
- |
- |
|
Кислород |
O2 |
31,9988 |
154,58 |
5,043 |
90,19 |
0,0265 |
|
Диоксид углерода |
CO2 |
44,010 |
304,20 |
7,386 |
194,65 |
0,0728 |

Рис. П 1. Зависимость коэффициента сжимаемости углеводородных газов
от приведенных параметров

 ,
кг/кмоль
,
кг/кмоль