
- •1 Классификация природных газов
- •2 Физико-химические свойства углеводородных газов
- •2.1 Состав газовой смеси
- •2.2 Критические и приведённые параметры газа
- •2.3 Коэффициент сверхсжимаемости
- •2.4 Плотность газа
- •2.5 Вязкость газа
- •2.6 Влагосодержание газа
- •3 Определение забойного давления
- •4 Уравнение притока газа к забою скважины
- •5 Исследование газовых скважин
- •5.1 Газогидродинамические исследование газовых скважин на стационарных режимах фильтрации
- •5.2 Газогидродинамические исследование газовых скважин на нестационарных режимах фильтрации
- •6 Обработка результатов гидродинамических исследований
- •7 Режимы разработки газовых и газоконденсатных месторождений
- •7.1 Материальный баланс газовой залежи
- •7.2 Методы определения запасов газа
- •8 Разработка месторождений природного газа
- •9 Технологические режимы эксплуатации скважин при разработке месторождений газа
- •9.1 Режим постоянной депрессии
- •9.2 Режим постоянного градиента давления на стенке скважины
- •9.3 Режим постоянного забойного давления
- •9.4 Режим постоянного устьевого давления
- •9.5 Режим постоянного дебита скважин
- •9.6 Режим постоянной скорости движения газа по НКТ
- •11 Разработка газоконденсатных месторождений
Created by SuhOFFF
определяются по составу газа. Существует несколько способов определения критических параметров газа в зависимости от его состава и точности определения этих параметров.
При известном составе газа, если содержимое метана составляет 95% и более,
псевдокритические параметры pпкр и Tпкр рекомендуется определять по правилам адди-
тивности:
N
pпкр = åpкрxi (2.5)
i=1 i
N
Tпкр = åTкрxi (2.6)
i=1 i
Здесь pкр и Tкр - критические давление и температура i-того компонента смеси.
i i
Приведёнными параметрами называются отношения соответствующих параметров
к их критическим значениям, они определяются формулами: |
|
||||||||||||||
p |
пр |
= |
p |
, T = |
T |
, V = |
V |
, ρ |
пр |
= |
ρ |
(2.7) |
|||
|
|
|
|
|
|
||||||||||
|
|
p |
|
пр |
T |
пр |
V |
|
ρ |
|
|
||||
|
|
|
кр |
|
|
|
кр |
|
|||||||
|
|
|
|
кр |
|
кр |
|
|
|
|
|||||
2.3 Коэффициент сверхсжимаемости
Идеальный газ – математическая модель газа, в которой предполагается, что по- тенциальной энергией молекул можно пренебречь по сравнению с их кинетической энер- гией, т.е. между молекулами не действуют силы притяжения или отталкивания, соударе- ния частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столк- новениями.
Уравнение состояния идеального газа, полученное из условия отсутствия межмо- лекулярного взаимодействия и без учёта объёма самих молекул, имеет вид:
Vид |
= nRT |
(2.8) |
|
p |
|
Здесь n - число молей газа; R - универсальная газовая постоянная.
Реальный газ – газ, который не описывается уравнением состояния идеального газа Менделеева-Клапейрона. Зависимости между его параметрами показывают, что молекулы реальных газов имеют конечные размеры и форму, оказывают значительное взаимное влияние и занимают определённый объём. Поэтому для их характеристики необходимо учесть параметры, связанные с молекулярным взаимодействием.
30.10.2010 |
- 7 - |

Created by SuhOFFF
Молекулы простых газов имеют сферическую форму, для них силы притяжения, которые действуют по линии, соединяющей их центры, пропорциональны расстоянию в шестой степени. Для газов с несферической формой молекул силы притяжения или оттал- кивания состоят не только из сил между центрами молекул, но и из дополнительных не- центричных сил. Для их учёта введён дополнительный параметр, называемый ацентрич- ным фактором.
Приближённо ацентричный фактор компонентов может быть определён по форму-
ле:
|
æ pкр ö |
|
|||
|
ln ç |
i |
÷ |
|
|
|
|
|
|||
|
ç pат ÷ |
|
|||
ωi = 0,4286 |
è |
|
ø |
-1 |
(2.9) |
Tкр |
|
||||
|
|
|
|
||
i
Tкип -1
i
Здесь Tкип - табличное значение температуры кипения i-го компонента.
i
Коэффициент сверхсжимаемости газов – отношение объёма газа при заданных тер- мобарических условиях к объёму этого газа, определённому при идентичных термобари- ческих условиях по законам идеального газа. Другими словами, коэффициент сверхсжи- маемости характеризует отклонение объёма реального газа от объёма идеального газа.
Из определения коэффициента сверхсжимаемости следует, что:
z = |
V |
|
(2.10) |
|
Vид |
||||
|
|
|||
Тогда: |
|
|
|
|
V = znRT |
(2.11) |
|||
|
p |
|
||
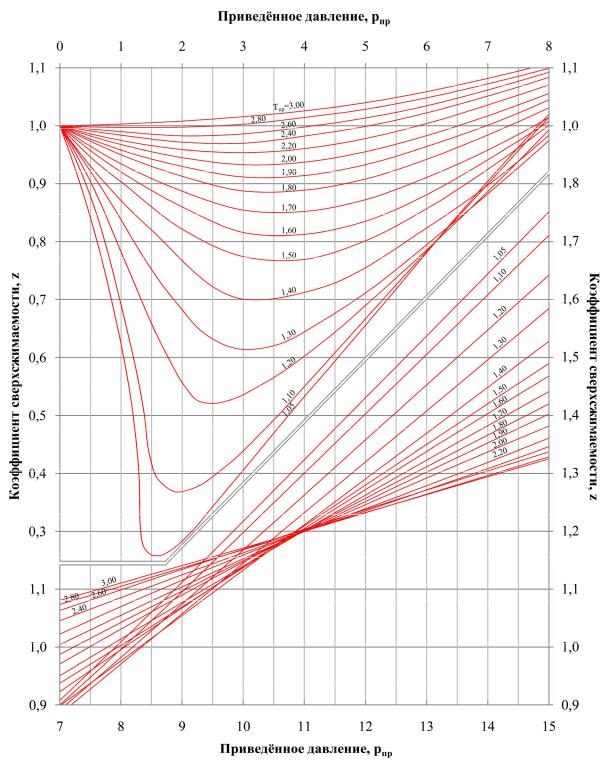
Коэффициент сверхсжимаемости газа зависит от состава газа, давления и темпера- туры. Значение коэффициента может быть определено графическими и аналитическими способами. Способ определения следует выбирать, исходя из требуемой точности. Для определения коэффициента сжимаемости природных газов, содержащих не более 2%
мольных высококипящих углеводородов C5+ , 2% ароматических углеводородов и около
5% полярных и кислых компонентов, используется графическая зависимость z от pпр и
Tпр (рис. 4).
30.10.2010 |
- 8 - |
Created by SuhOFFF
Рис. 4. Зависимость коэффициента сверхсжимаемости от приведённых давления и температуры
Для смесей с содержанием метана более 96% при 0 < pпр < 8 коэффициент сверх-
сжимаемости может быть определён аналитически: |
|
z = (0,4lg (Tпр ) + 0,73)pпр + 0,1pпр |
(2.12) |
30.10.2010 |
- 9 - |

Created by SuhOFFF
При более высоком содержании в газе высококипящих углеводородов C5+ и поляр-
ных компонентов коэффициент сверхсжимаемости z следует определять с учётом ацен- трического фактора.
z = z(0) + ωсмz(1) |
(2.13) |
Здесь z(0) , z(1) - коэффициенты сверхсжимаемости простых веществ и веществ, со-
N
держащих несферические молекулы; ωсм = åωi xi - фактор ацентричности смеси.
i=1
Для более точных расчётов коэффициент сверхсжимаемости природных газов дол- жен быть определён по кубическим уравнениям состояния газов.
2.4 Плотность газа
Плотность – отношение массы газа к единице его объёма. Плотность газа зависит от его состава, давления и температуры.
Плотность газовой смеси при стандартных условиях определяется с помощью мо- лекулярной массы смеси и молярного объёма:
ρст |
= |
Mсм |
(2.14) |
Vмол |
ст
Плотность газа при заданных давлении и температуре определяется по известной плотности в стандартных условиях по формуле:
ρ = ρст pTст
pстzT
Здесь z - коэффициент сверхжимаемости.
Часто для характеристики природного газа применяется относительная ность по воздуху3:
ρ= ρ(p,T)
ρвозд (p,T)
(2.15)
его плот-
(2.16)
Если состав газа неизвестен, но известна его относительная плотность, псевдокри- тические параметры смеси могут быть определены по следующим формулам:
3 Плотность воздуха в стандартных условиях ρвозд |
= 1,204 |
кг |
|||
3 |
|||||
|
ст |
|
|
м |
|
Плотность воздуха в нормальных условиях ρвозд = 1,293 |
кг |
|
|||
3 |
|||||
|
н |
|
м |
|
|
30.10.2010 |
- 10 - |
|
|
|
|
