
- •Л.И. Андрианова, а.П. Пнева, е.В. Рогалева общая химия
- •Глава 1. Основные понятия. Классы неорганических соединений…......5
- •Глава 1. Основные понятия химии
- •Важнейшие классы неорганических соединений
- •1.1. Оксиды
- •Классификация оксидов
- •Способы получения оксидов
- •1.2. Основания
- •1.3. Кислоты
- •1.4. Соли
- •Глава 2. Строение вещества
- •2.1. Строение атома
- •Квантово – механическая модель атома
- •Квантовые числа
- •Распределение электронов по уровням, подуровням и орбиталям во многоэлектронном атоме
- •Электронные формулы
- •2.2. Периодический закон и система д.И. Менделеева
- •Электронные аналоги
- •Свойства элементов
- •2.3. Химическая связь. Строение молекулы
- •Основные параметры химических связей
- •Метод валентных связей. Ковалентная связь
- •Гибридизация электронных облаков
- •Поляризуемость ковалентной связи Полярные и неполярные молекулы. Дипольный момент
- •Ионная связь
- •Металлическая связь
- •2.4. Агрегатное состояние вещества
- •Глава 3. Основные закономерности протекания химических процессов
- •Термодинамика химических процессов
- •Единицей измерения внутренней энергии является джоуль /Дж/.
- •3.2. Кинетика химических процессов
- •3.3. Химическое равновесие
- •Глава 4. Растворы
- •Истинные растворы
- •Способы выражения состава растворов
- •4.2. Жидкие растворы (на примере водных растворов)
- •Тепловой эффект растворения (энтальпия растворения)
- •4.3. Общие свойства растворов
- •Неэлектролиты и электролиты
- •Диссоциация кислот, оснований, солей
- •Сильные и слабые электролиты
- •4.6. Электролитическая диссоциация молекул воды. Ионное произведение воды
- •Глава 5. Реакции в растворах
- •5.1. Реакции ионного обмена
- •Гидролиз солей
- •5.3. Окислительно-восстановительные процессы Cтепень окисления. Окисление и восстановление
- •Составление уравнений окислительно-восстановительных реакций (овр)
- •1) В кислой среде:
- •2) В нейтральной среде:
- •Нейтральная срела
- •3) В щелочной среде:
- •Глава 5. Электрохимические процессы
- •6.1. Двойной электрический слой. Электродный потенциал
- •6.2. Химические источники электрической энергии
- •Концентрационные гальванические элементы
- •6.3. Аккумуляторы
- •6.4. Электролиз
- •Электролиз расплавов солей
- •Электролиз растворов солей
- •Процессы на катоде
- •Процессы на аноде
- •Глава 7. Cвойства металлов Общая характеристика металлов
- •7.1. Физические свойства металлов
- •7.2. Химические свойства металлов
- •Взаимодействие с простыми веществами
- •Взаимодействие металлов с водой
- •Взаимодействие металлов с кислотами
- •Взаимодействие металлов с раствором щелочи
- •Взаимодействие металлов с растворами солей
- •Глава 8. Коррозия металлов. Методы защиты металлов от коррозии
- •8.1. Виды коррозионных процессов
- •8.2. Методы защиты металлов от коррозии
- •Защита поверхности металла
- •Глава 9. Высокомолекулярные соединения (вмс)
- •9.1. Классификация полимеров
- •9.2. Методы получения полимеров
- •9.3. Физико – химические свойства полимеров
- •9.4. Материалы, получаемые на основе полимеров
- •9.5. Применение некоторых полимеров
- •Глава10. Краткие сведения по аналитической химии и методам физико-химического анализа Идентификация
- •10.1. Качественный анализ
- •10.2. Количественный анализ
- •625000Г. Тюмень, ул. Володарского, 38
- •625039 Г. Тюмень, ул. Киевская, 52
Гибридизация электронных облаков
Часто атомы формируют свои связи за счет электронов различных подуровней. Рассмотрим пример образования молекулы BeCl2 .
В нормальном состоянии бериллий не может принимать участие в образовании химических связей в связи с отсутствием неспаренных электронов. Но так как у бериллия есть свободный p-подуровень, возможен переход атома в возбужденное состояние, которое характеризуется распариванием электронов и переходом одного их них с s- на p-подуровень.
|
|
|
|
|
|
|
|
s |
|
p |
|
| |
|
↓↑ |
Имея два неспаренных электрона, атом бериллия способен к образованию двух связей по обменному механизму.
Образующиеся связи должны быть разными по энергии, так как электроны находятся на разных подуровнях. Однако экспериментально доказано, что обе связи совершенно одинаковы. Следовательно, при образовании химических связей происходит выравнивание атомных орбиталей по энергии и форме. Этот процесс получил название – гибридизация, а «выровненные» орбитали называют гибридными.
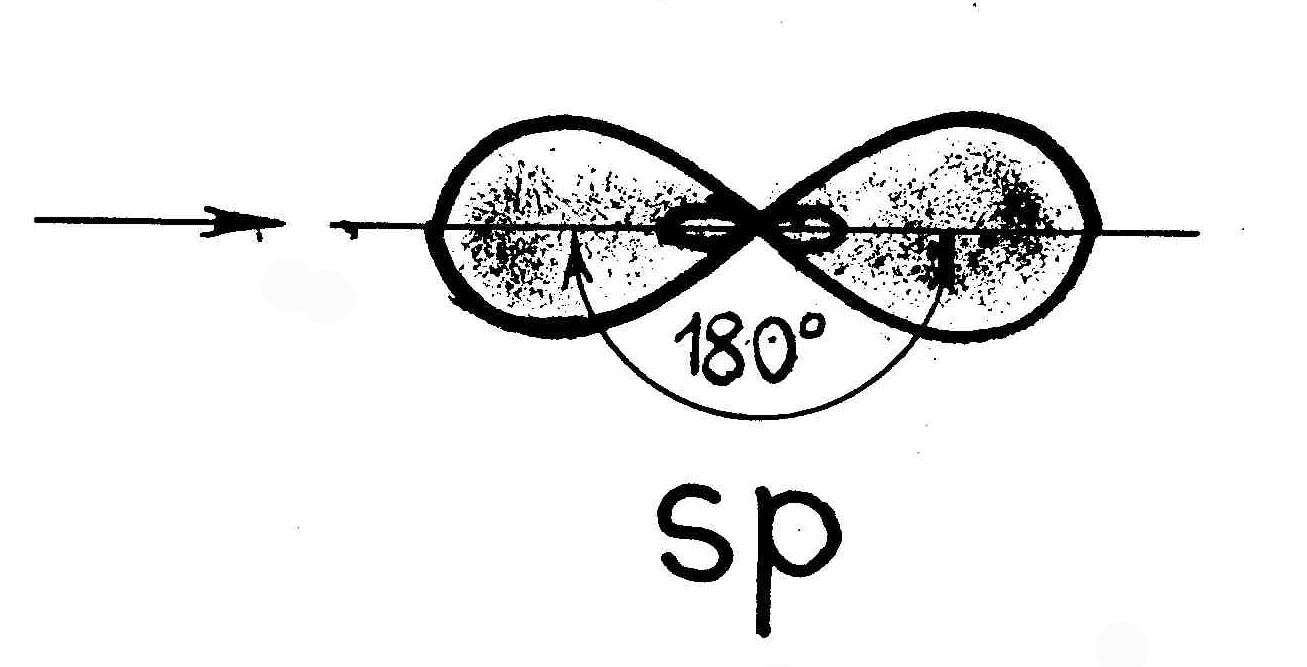
Случай гибридизации одной s- и одной p- орбитали называется sp-гибридизацией.
Для sp-гибридизации характерна линейная структура молекулы, валентный угол 180°.Такой вид гибридизации наблюдается у элементов II группы.
Например: молекула хлорида бериллия BeCl2 - атом бериллия для образования двух связей с атомами хлора переходит в возбужденное состояние (как показано выше). В результате электронные облака одного s-(сферической формы) и одного р-электрона (имеющего форму объемной восьмерки) подвергаются sр-гибридизации, в результате которой образуются два гибридных облака, располагающихся в пространстве под углом 1800:


У каждого из двух атомов хлора не происходит гибридизации, так как имеется по одному необходимому неспаренному электрону (так как электрон находится на р-подуровне, форма его электронного облака - объемная восьмерка) для образования связи с бериллием:
|
↑↓ |
↑↓ |
↑↓ |
↓ |

При гибридизации одной s- и двух p- орбиталей (sp2-гибридизация) образуются три равноценные гибридные орбитали, которые располагаются под углом 1200 в одной плоскости. Такая гибридизация характерна для элементов III группы.
Например:
молекула хлорида бораBCl3
5B→2s2
2p1 5B*→2s12p2
|
|
|
|
|
|
|
|
s |
|
p |
|
| |
|
|
|
|
|
↑ |
|
|
s |
|
p |
|
| |



В sp3-гибридизация участвуют одна s- и три p- орбитали, в результате образуются четыре гибридные орбитали. Данный тип гибридизации характерен для элементов IV группы.
Например: молекула метана CH4 6C : 2s2 2p2 → С*:2s12p3
ковалентность = 2 ковалентность = 4
|
|
|
|
|
↑ |
|
|
s |
|
p |
|
|
|
|
|
|
|
↑ |
↑ |
|
s |
|
p |
|
|
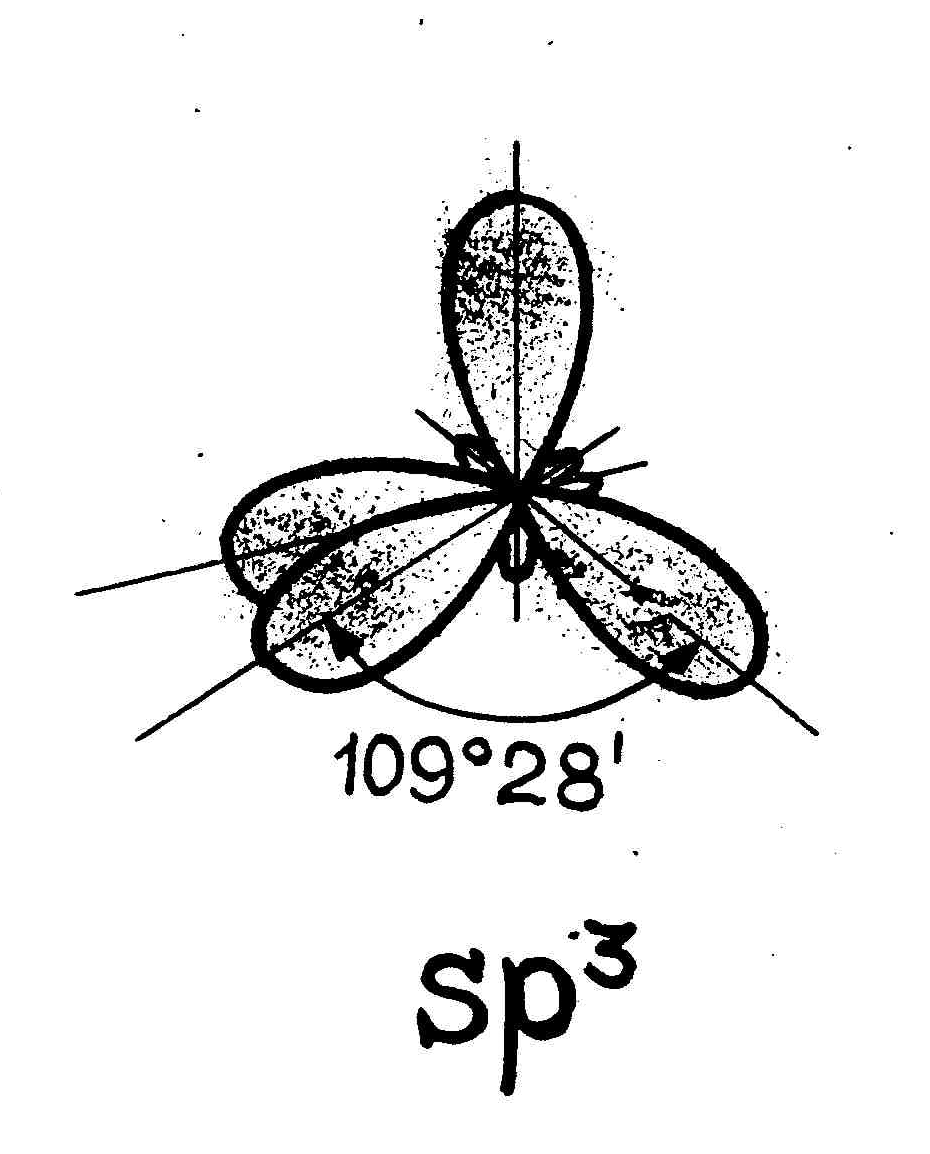

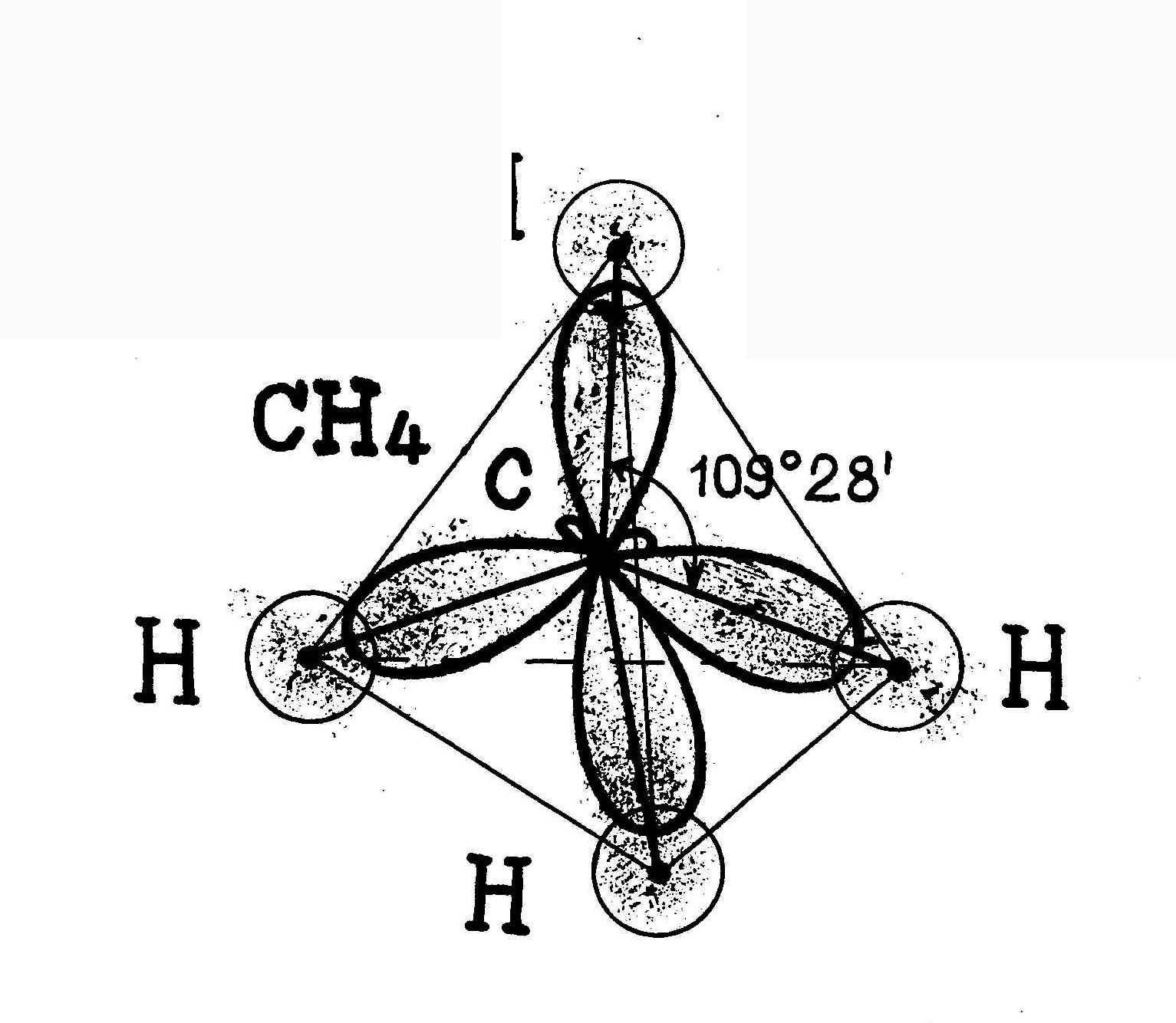
Таким образом, основные положения теории гибридизации:
В гибридизации участвуют орбитали разных подуровней одного уровня.
Число гибридных орбиталей равно числу чистых орбиталей, участвующих в гибридизации.
Гибридные орбитали более вытянуты в направлении образования химических связей и поэтому обеспечивают лучшее перекрывание электронных облаков.
