
Лекция 4: ПОТЕНЦИОМЕТРИЯ
Аннотация. В лекции рассматриваются теоретические основы потенциометрических методов исследования и анализа, устройство и принцип действия приборов для потенциометрии, возможности метода потенциометрии для исследования сельскохозяйственных объектов.
Ключевые слова: потенциометрические методы анализа, полуэлемент, уравнение Нернста, гальвани-потенциал, индикаторный электрод, электрод сравнения.
Рассматриваемые вопросы:
1 вопрос. Теоретические основы потенциометрических методов исследования и анализа.
2 вопрос. Оборудование для потенциометрии.
3 вопрос. Возможности потенциометрических методов исследования и анализа.
Модульная единица 23. Потенциометрия
Цели и задачи изучения модульной единицы. В результате изучения данной модульной единицы студенты должны освоить теоретические основы потенциометрических методов исследования и анализа, познакомиться с устройством и принципом действия приборов для потенциометрии, знать возможности метода по определению содержания элементов в сельскохозяйственных объектах и объектах окружающей среды.
12.1.Теоретические основы потенциометрических методов исследования и анализа.
12.1.1. Классификация электрохимических методов анализа.
Измерение электрических величин для определения состава веществ является одним из важнейших приемов аналитической химии. Все электрохимические измерения проводятся с использованием электрохимической ячейки – сосуда с раствором, в который погружены по меньшей мере два электрода. На электродах происходят различные физические и химические процессы, о степени протекания которых можно судить путем измерения напряжения, силы тока, электрического сопротивления, электрического заряда или подвижности заряженных частиц в электрическом поле. Определяемое вещество при этом, как правило, находится в растворе электролита.
С методической точки зрения электрохимические методы анализа можно разделить на прямые и косвенные. Последние представляют собой методы титрования, в которых конечную точку определяют электрохимическим способом.
Другой вид классификации электрохимических методов (число которых очень велико) основан на том, протекает ли в ходе анализа через ячейку электрический ток или нет. Потенциометрические методы основаны на измерении напряжения на электродах ячейки в отсутствие тока. Как и любые другие электрохимические методы, они делятся на прямые (например, рН-метрия) и косвенные (потенциометрическое титрование). Если же через ячейку протекает электрический ток (происходит процесс электролиза), то для химического анализа можно использовать зависимость силы тока от напряжения. Соответствующие методы называются волътамперометрическими (в частном случае, при использовании ртутного капающего электрода — полярографическими. Методы, основанные на измерении напряжения при постоянной силе тока, называются вольтаметрическими, а на измерении силы тока при постоянном напряжении - амперометрическими. В любом варианте вольтамперометрический анализ проводят в условиях, когда степень электрохимического превращения определяемого вещества вследствие электролиза пренебрежимо мала. Однако электролиз можно проводить и до полного превращения определяемого вещества. На этом основаны методы электрогравиметрии и кулонометрии. В электрогравиметрии для определения содержания вещества применяют взвешивание продукта электролиза, а в кулонометрии - измерение количества электричества, затраченного на электролиз. Электрогравиметрические и прямые кулонометрические определения обычно проводят при постоянном потенциале рабочего электрода (в потенциостатическом режиме). Косвенный кулонометрический анализ (кулонометрическое титрование), как правило, ведут при постоянной силе тока (в гальваностатическом режиме). Здесь электролизу подвергают вспомогательный реагент, продукт электрохимического превращения которого служит титрантом для определяемого вещества.
7.1.2. Электроды и электрохимическая ячейка
Все электрохимические равновесия основаны на превращениях веществ в гетерогенных системах с участием частиц — носителей заряда. Отметим, что в состоянии электрохимического равновесия как электрические потенциалы фаз, так и химические потенциалы участников процесса в разных фазах различаются.
В качестве классического примера рассмотрим цинк-серебряную электрохимическую ячейку. Она состоит из растворов, содержащих ионы Аg+ и Zn2+ , которые разделены диафрагмой для того, чтобы обеспечить возможность протекания тока без смешения растворов. В каждый из растворов погружен электрод, изготовленный из соответствующего металла (серебра, цинка). Схематическое устройство такой ячейки изображено на рис. 7.1.
На границах раздела фаз металл- раствор протекают следующие процессы:
Ag - e ⇄ Ag+(p)
Zn – 2e ⇄ Zn2+ (p)
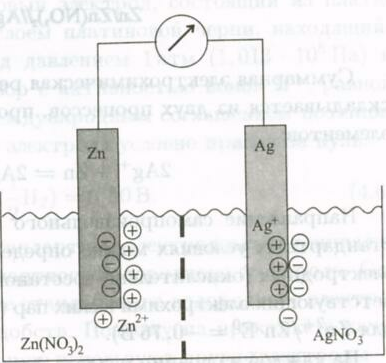
Рис. 7.1. Цинк-серебряная электрохимическая ячейка.
Между соответствующими ионами в фазах металла и раствора устанавливается равновесие. Каждая из двух систем, включающих металл и раствор соответствующего иона, называется полуэлементом. Каждый полуэломент включает в себя две фазы, одна из которых характеризуется электронной, а другая ионной проводимостью.
На границе раздела фаз полуэлемента происходит электродная реакция — процесс с участием компонентов обеих фаз, в результате которого осуществляется перенос ионов или электронов через границу раздела и. вследствие этого, протекание электрического тока.
Электрохимической ячейкой называется многофазная система, состоящая по меньшей мере из двух полуэлементов, в которых жидкие фазы находятся между собой в электролитическом контакте. Границу раздела твердой и жидкой фаз обычно обозначают символом / или |, а электролитический контакт двух жидких фаз — символом // или ||. Таким образом, схему рассматриваемой ячейки можно представить в следующем виде:
ZnZn(NO3)2ǁAgNO3Ag
Суммарная электрохимическая реакция, протекающая в ячейке, складывается из двух процессов, происходящих в каждом из полу элементов:
2Ag+ + Zn ⇄2Ag + Zn2+
Направление самопроизвольного протекания этого процесса в стандартных условиях можно определить из величин стандартных электродных (окислительно-восстановительных) потенциалов соответствующих электрохимических пар (для пары Аg+/Аg Е° = 0,81 В, для Zn2+/Zn E= 0,76 В).
На каждой из границ раздела фаз — Аg+/Аg и Zn2+/Zn — образуется двойной электрический слой. Обусловленная им разность потенциалов называется галъвани-потенциалом. Величину гальвани-потенциала одного отдельного электрода измерить невозможно. Можно измерить только разность двух гальвани-потенциалов, т. е. общее напряжение на электродах ячейки. При отсутствии тока эта разность потенциалов называется равновесной. Она равна электродвижущей силе ЭДС, создаваемой ячейкой. Связь между ЭДС и активностями ионов в обоих полуэлементах I и II описывается уравнением Нернста:
ЭДС = Е(I) – Е(II)
ЭДС
= Е(I)
– Е(II)
+
![]() lna
lna![]() -
-
![]() lna
lna![]()
где а — активности соответствующих ионов в растворах,
При этом все индексы I относятся к правому, а II — к левому полуэлементу.
Величина гальвани-потенциала (или, в общем случае, электродного потенциала) одного отдельно взятого электрода (называемого индикаторным), представляла бы для аналитической химии несомненный интерес. Но, поскольку его измерить невозможно, измерения производят относительно некоторого электрода, потенциал которого остается постоянным. Такой электрод называют электродом сравнения.
Стандартным электродом сравнения служит стандартный водородный электрод. Это газовый электрод, состоящий из платиновой пластинки, покрытой слоем платиновой черни, находящийся в атмосфере водорода под давлением 1атм (1,013105 Па) и погруженный в водный раствор с активностью ионов Н+, равной 1 моль/л. В соответствии с международным соглашением потенциал стандартного водородного электрода условно принят за нуль.
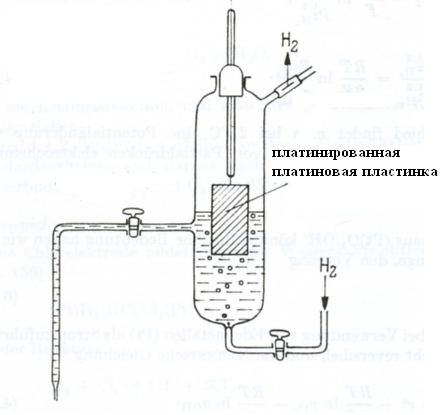
Рис. 3.2. Водородный электрод.
Все табличные значения стандартных электродных потенциалов измерены относительно стандартного водородного электрода. Однако практическое применение стандартного водородного электрода имеет ряд очевидных неудобств. Поэтому на практике в качестве электродов сравнения обычно используют другие электроды — например, каломельный или хлоридcеребряный электроды. Их электродные потенциалы Е(В) постоянны и точно известны. Поэтому при необходимости из величины потенциала Eв, измеренной относительно электрода сравнения, можно всегда рассчитать соответствующую величину потенциала (Е) относительно стандартного водородного электрода как
E = EB + E(B)
