
kinetics_problem
.pdfРешение. В общем виде весь процесс можно представить схемой:
Cu(т) + (NH4 )2S2O8 (р-р) CuSO4 (р-р) + (NH4 )2SO4 (р-р)
если t = 0, |
c0 |
0 |
0 |
если t 0, |
c0 – x |
x |
x |
Для определения порядка реакции используем дифференциальный метод Вант-Гоффа, который позволяет определить порядок реакции по уравнению (3.12):
n ln( c1 / t1) ln( c2 / t2 ) . ln c1 ln c2
1. Рассчитаем концентрацию исходного реагента(NH4 )2S2O8 через 5, 10 и 25 мин от начала реакции. Так как из каждого моля (NH4 )2S2O8 образуется один моль CuSO4 , то количество израсходованного (NH4 )2S2O8 равно количеству полученного CuSO4 :
c1 c0 x 0,219 0,010 0,209 моль/дм3; c2 0,219 0,020 0,199 моль/дм3;
c3 0,219 0,048 0,171 моль/дм3.
2. Рассчитаем значения изменения концентраций исходного вещества для различных моментов времени:
c1 / t1 (0,199 0,209)/5 0,020 моль/(дм3 мин).c2 / t2 (0,171 0,199)/15 0,0187 моль/(дм3 мин).
3. Среднее значение концентрации на интервалах времени:
от t1 до t2
c1 0,209 0,199 0,204 моль/дм3; 2
от t2 до t3
c2 0,199 0,187 0,193моль/дм3. 2
71
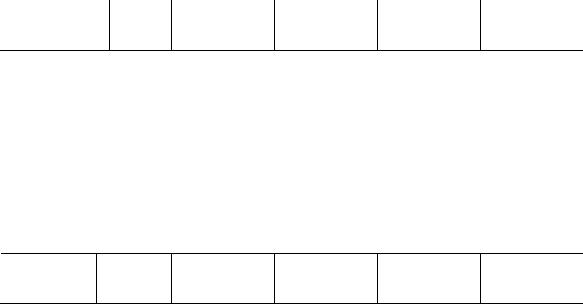
4. Порядок реакции равен: n ln 0,0200 ln 0,0187 0,77. ln 0,204 ln 0,193
Вывод. Дробный порядок реакции, определенный по экспериментальным данным, указывает на более сложный механизм протекания данной реакции, чем изображенный в виде химического уравнения.
3.4.ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
3.4.1.Интегральные методы определения порядка химической реакции
1.Для кинетического анализа была составлена стехиометрическая газовая смесь из NO и O2 . В ходе реакции
2NO + O2 2NO2
при Т = 298 К наблюдалось следующее изменение периода полураспада газовой смеси в зависимости от начального давления:
p0 · 10–4, Па |
3,04 |
2,53 |
2,03 |
1,52 |
1,01 |
t1/ 2 , с |
24,7 |
35,6 |
55.3 |
98,7 |
223,5 |
Определите порядок данной реакции и рассчитайте среднюю константу скорости.
2. При разложении пероксида водорода на платиновом катализаторе происходит выделение кислорода по реакции:
H2O2 H2 O2
При изучении кинетики этой реакции наблюдалось следующее изменение во времени объема выделенного кислорода:
t, мин |
9 |
15 |
20 |
28 |
∞ |
VO2 , мл |
3,3 |
5,3 |
6,5 |
8,1 |
15,6 |
Определите порядок данной реакции, среднюю константу скорости и время разложения 1/4 исходного количества перекиси водорода.
3. Восстановление оксида азота (II) водородом протекает по уравнению
2NO + 2H2 N2 + 2H2O
72
Если исходные газы взяты в эквивалентных количествах при 0,454 · 105 Па, то их давление уменьшилось вдвое за 102 с, если же начальное давление было 0,384 · 105 Па, то оно уменьшилось вдвое в течение 140 с. Определите порядок реакции, общее давление газовой смеси через 200 с.
4. При изучении реакции
C2H5I + OH C2H5OH + I
были измерены времена полупревращения для различных начальных концентраций реагентов при температуре 298 К:
cC2H5I,0 cOH ,0 , М |
0,010 |
0,025 |
0,050 |
0,075 |
0,100 |
t1/ 2 , мин |
1110 |
445 |
220 |
150 |
110 |
Определите порядок реакции и рассчитайте среднюю константу скорости.
5. Реакция взаимодействия триэтиламина с бромистым этилом в бензоле
(C2H5 )3N + C2H5Br (C2H5 )4N+ + Br
протекает при Т = 298 К. При одинаковых начальных концентрациях реагентов (c0 = 0,1 М) наблюдался следующий процент их расходования (x) во времени:
t, с |
300 |
1000 |
1500 |
2000 |
x, % |
30,5 |
59,4 |
68,8 |
74,5 |
Определите порядок реакции и рассчитайте среднюю константу скорости данной реакции.
6. При исследовании реакции разложения аммиака при 900 °С на вольфрамовой проволоке по реакции
2NH3 N2 + 3H2
были получены следующие данные зависимости периода полураспада от начального давления паров аммиака:
p0 · |
10–3, Па |
3,33 |
5,33 |
10,66 |
18,63 |
33,00 |
t1/2 |
· 10–3, c |
0,9 |
1,62 |
3,36 |
7,50 |
10,8 |
Определите порядок реакции и рассчитайте среднюю константу скорости данной реакции.
73
7. При изучении реакции разложения щавелевой кислоты под воздействием 99,5%-й серной кислоты при 50 °С получены следующие данные:
t, мин |
0 |
120 |
240 |
420 |
600 |
900 |
1440 |
cH2C2O4 103 , моль/дм3 |
2,50 |
2,10 |
1,77 |
1,36 |
1,05 |
0,65 |
0,31 |
Постройте график зависимости изменения концентрации щавелевой кислоты от времени. Определите порядок реакции по щавелевой кислоте и константу скорости реакции.
8. Изучалась кинетика реакции
H2 + Br2 2HBr
при Т = 574 К. Было установлено, что при одинаковых начальных кон-
центрациях H |
2 |
и |
Br , равных c1 = 0,04 моль/дм3; |
c2 = 0,03 моль/дм3; |
|
|
2 |
|
|
c3 = 0,02 моль/дм3, |
их концентрация уменьшается |
на 1/4 за время |
||
t1 = 97,4 мин; t2 = 129,8 мин; t3 = 194,7 мин.
Определите порядок реакции и рассчитайте константу скорости реакции.
9. Изучалась кинетика реакции
(C2H5 )3N + C2H5I (C2H5 )4N+ + I
протекающей в среде нитробензола при 298 К. При одинаковой начальной концентрации реагентов, равной 0,0198 М, изменение их концентрации во времени происходило на величину x:
t, с |
1200 |
1800 |
2400 |
3600 |
4500 |
5400 |
x · 102, моль/дм3 |
0,876 |
1,066 |
1,208 |
1,392 |
1,476 |
1,538 |
Определите порядок реакции и рассчитайте среднюю константу скорости.
10. При изучении кинетики реакции превращения цианата аммония в мочевину
NH4CNO k (NH2 )2CO
при Т = 308 К были определены времена полураспада цианата аммония при различных начальных концентрациях реагента. Получены следующие данные:
74
cNH4CNO,0 , моль/дм3 |
0,05 |
0,10 |
0,2 |
t1/ 2 , ч |
37,03 |
19,15 |
9,45 |
Определите порядок реакции и рассчитайте среднюю константу скорости.
11. Изучалась кинетика реакции омыления метилуксусного эфира щелочью
CH3COOCH3 NaOH CH3COONa + CH3OH
при 298 К. Фиксировалось изменение концентрации щелочи во времени.
t, мин |
0 |
3 |
5 |
7 |
10 |
15 |
∞ |
сNaOH · 103, моль/дм3 |
20 |
14,8 |
12,68 |
11,00 |
9,28 |
7,26 |
3,5 |
Рассчитайте изменение концентрации эфира во времени. Определите порядок данной реакции и вычислите среднюю константу скорости.
12. Реакция взаимодействия пиридина и бромистого бензила
C5H5N + C6H5CHBr C5H5NC6H5CHBr
изучалась в среде тетрагидрофурана. Для синтеза была выбрана стехиометрическая смесь исходных веществ с начальной концентрацией 0,2 моль/дм3. За ходом реакции следили по количеству пиридина, вступившего в реакцию к моменту времени t:
t, мин |
244 |
574 |
939 |
1336 |
18800 |
c, моль/дм3 |
0,174 |
0,148 |
0,127 |
0,110 |
0,093 |
Определите порядок данной реакции и вычислите среднюю константу скорости.
13. При нагревании дибромянтарная кислота разлагается на броммалеиновую и бромистоводородную кислоты по уравнению
(CHBr)2 (COOH)2 (CH)(CBr)(COOH)2 + HBr
Кинетику этой реакции исследовали титрованием проб одинакового объема стандартным раствором щелочи. При 323 К были получены следующие результаты:
75
t, мин |
0 |
214 |
380 |
VNaOH, мл |
10,095 |
10,35 |
10,57 |
Определите порядок данной реакции, среднюю константу скорости и время разложения 1/4 исходного количества дибромянтарной кислоты.
14. В результате взаимодействия -фенилпропионовой кислоты с иодом происходит образование , -дииодкоричной кислоты по реакции
C5H5 C C COOH + I2 C5H5 CI=CI COOH
Кинетику этой реакции изучали при T = 297,8 К по скорости расходования иода путем титрования его тиосульфатом. В реакцию вводили эквивалентные количества иода и фенилпропионовой кислоты. Были получены следующие данные:
t, мин |
0 |
114 |
405 |
1388 |
1780 |
2790 |
сI2 · 102, моль/дм3 |
2,51 |
2,13 |
1,55 |
0,79 |
0,66 |
0,46 |
Определите порядок данной реакции и рассчитайте среднюю константу скорости.
15. При протекании реакции
СH3COСH3 → C2H4 + H2 + CO
общее давление газовой смеси изменялось следующим образом:
t, мин |
0 |
6,5 |
13,0 |
19,9 |
p 10 4 , Па |
4,149 |
5,439 |
6,505 |
7,491 |
Определите порядок реакции и вычислите среднее значение константы скорости при температуре опыта 298 К.
16. Для реакции
2CO CO2 C(т)
протекающей при 583,2 К и постоянном объеме, давление за 30 мин уменьшилось с 1,049 105 Па до 0,924 105 Па, а затем за тот же промежуток времени с 0,714 105 Па до 0,624 105 Па. Определите порядок реакции и общее давление газовой смеси через 20 мин от начала опыта.
17. При изучении реакции термического разложения ацетальдегида при 518 °С были получены данные о доле ацетальдегида (1 – ), не вступившего в реакцию к моменту времени t:
76
t, с |
0 |
42 |
85 |
105 |
160 |
195 |
1 – |
1,000 |
0,906 |
0,818 |
0,786 |
0,685 |
0,631 |
Определите порядок реакции, среднюю константу скорости и период полураспада.
18. Экспериментально установлено, что период полураспада для реакции
NH4CNO (NH2 )2CO
изменялся при изменении начальной концентрации NH4CNO :
cNH4CNO , моль/дм3 |
0,1 |
0,2 |
0,4 |
t1/2, ч |
19,15 |
9,45 |
4,62 |
Определите порядок реакции и рассчитайте среднюю константу скорости.
19. Реакция распада NO2 протекает при малых давлениях и больших температурах практически необратимо:
2NO2 k 2NO + O2
При начальной концентрации cNO2 = 10,6 10–5 моль/дм3 за 20 мин NO2 превращается в продукты реакции на 59,5 %, а при начальной концентрации cNO2 = 6,3 10–5 моль/дм3 за 52 мин превращается в продукты
реакции на 35,4 %.
Определите порядок реакции и среднюю константу скорости данной реакции.
20. Реакция термического распада диоксана при 504 °С протекает по уравнению
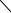
При начальной концентрации диоксана 1,066 105 Па половина ис-
ходного вещества распадается за 13,9 мин, а при 0,533 105 Па — за 19,0 мин. Определите порядок реакции и рассчитайте значение средней константы скорости.
77
21. При Т = 583,2 К AsH3 (г) разлагается по реакции:
2AsH3 (г) k 2As(т) + 3H2 (г)
Кинетику данной реакции изучали путем измерения общего давления газовой смеси во времени (V = const). Получены следующие данные:
t, ч |
0 |
5,5 |
6,5 |
8,0 |
p 10 4 , Па |
9,751 |
10,742 |
10,905 |
11, 351 |
Определите порядок данной реакции и рассчитайте среднюю константу скорости.
22. Кинетика реакции
2C2H5OH 2Br2 CH3COOC2H5 + 4HBr
изучалась в избытке спирта. Было установлено, что период полураспада Br2 следующим образом меняется с изменением начальной концентра-
ции брома:
cBr ,0 ·103, моль/дм3 |
4 |
6 |
8 |
2 |
|
|
|
t1/2, мин |
3680 |
2450 |
1840 |
Определите порядок реакции и рассчитайте константу скорости.
23. При изучении реакции между пиридином и иодистым этилом
C5H5N + C2H5I C7H10N+ I
измерялась концентрация ионов I– через определенные промежутки времени. Для одинаковых концентраций двух исходных реагентов (c0 = 0,1 М) были получены следующие данные:
t, с |
235 |
465 |
720 |
1040 |
1440 |
1920 |
2370 |
cI 103 , М |
15 |
26 |
35 |
44 |
52 |
59 |
64 |
Определите порядок и вычислите константу скорости реакции.
3.4.2. Дифференциальные методы определения порядка химической реакции
1. Для реакции
CH3I + C2H5ONa CH3OC2H5 NaI
78

протекающей в среде этилового спирта при Т = 321 К, были определены опытные значения концентрации CH3I в различные моменты времени (начальные концентрации реагентов равны между собой):
t, мин |
0 |
180 |
360 |
540 |
720 |
900 |
1260 |
1620 |
ci, моль/дм3 |
0,100 |
0,080 |
0, 065 |
0,056 |
0,049 |
0,044 |
0,036 |
0,030 |
Определите порядок данной реакции и рассчитайте среднюю константу скорости.
2. Для реакции между оксидом азота и водородом
2NO +2H2 N2 +2H2O
при 373 К были получены следующие кинетические данные:
а) |
при |
начальных |
концентрациях |
реагентов |
cH2 ,0 = 0,005 M, |
||||||||
cNO,0 = 0,1 M: |
|
|
|
|
|
|
|
|
|
|
|
||
|
t, мин |
0 |
60 |
120 |
180 |
|
240 |
300 |
|
360 |
|
420 |
|
|
cH2 102, М |
0,50 |
0,40 |
0, 32 |
0,26 |
|
0,20 |
0,16 |
|
0,13 |
|
0,10 |
|
б) |
при |
начальных |
концентрациях |
|
реагентов |
|
cH2 ,0 |
= 0,1 M, |
|||||
cNO,0 = 0,01 M: |
|
|
|
|
|
|
|
|
|
|
|
||
|
t, мин |
0 |
300 |
600 |
900 |
|
1200 |
1500 |
|
1800 |
|
210 |
|
|
cNO 102, М |
1,00 |
0, 90 |
0, 82 |
0,75 |
|
0,69 |
0,64 |
|
0,60 |
|
0,56 |
|
в) |
при |
начальных |
концентрациях |
|
реагентов |
|
cH2 ,0 = 0,05 M, |
||||||
cNO,0 = 0,05 M: |
|
|
|
|
|
|
|
|
|
|
|
||
|
t, мин |
0 |
360 |
720 |
1080 |
1440 |
1800 |
2160 |
2520 |
||||
|
cH2 |
102, М |
5,0 |
3,9 |
3, 3 |
2,9 |
2,6 |
2,4 |
2,3 |
2,1 |
|||
Вычислите порядок реакции по оксиду азота, водороду и общий порядок реакции. Рассчитайте среднюю константу скорости.
3. Дегидрирование н-бутилена до дивинила на катализаторе К-16 при температуре 600 °С в присутствии водяного пара можно представить схемой:
C4H8 k C4H6 H2
Проводились измерения начальной скорости этой реакции при различных разбавлениях н-бутилена водяным паром.
79
Получены следующие результаты:
pC4H8 ,0 ·10–3, Па |
8,822 |
4,664 |
3,160 |
v0 102 , моль/(дм3 ч) |
2,62 |
2,10 |
1,83 |
Определить порядок реакции и среднее значение константы скорости.
4. Определите порядок реакции стадии, определяющей скорость пиролиза диборана ( B2H6 ) при 100 °С по изменению начальной
скорости процесса, как функции концентрации:
cB2H6 ,0 · 102, М |
2,15 |
1,550 |
0,850 |
0,433 |
v0 104 , моль дм–3ч–1 |
7,71 |
5,23 |
1,95 |
0,73 |
Рассчитайте среднюю константу скорости данной стадии.
5. Изучение термического разложения диметилсульфоксида (DMSO) проводили при 340 °С путем измерения его концентрации. Получены следующие результаты:
t, с |
0 |
300 |
600 |
900 |
1200 |
1500 |
1800 |
2100 |
cDMSO 103, моль/дм3 |
2,50 |
2,00 |
1,60 |
1,30 |
0,97 |
0,77 |
0,61 |
0,48 |
Определите порядок реакции и рассчитайте значение средней константы скорости.
6. Реакция термического распада диоксана при 504 °С протекает по уравнению
Парциальное давление диоксана менялось во времени следующим образом:
t, мин |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
p · 10–4, Па |
11 |
6,6 |
4,7 |
3,5 |
2,8 |
2,2 |
1,8 |
1,5 |
1,3 |
1,1 |
0,92 |
Определите порядок реакции и рассчитайте значение средней константы скорости.
7. Изучена зависимость скорости распада н-бромистого пропила:
н-C3H7Br k C3H6 HBr
80
