
kinetics_problem
.pdf
Подставляя значение Ea 2 = 4 (дано по условию задачи), находим:
Ea1
Т2 = 4 · 298 = 1192 К (919 °С). Таким образом, для достижения одинаковой с каталитической реакцией скорости требуется значительное повышение температуры по сравнению с 298 К, т. е. существенные затраты энергии.7 Обратим внимание, что для решения задачи не требуется знания численного значения Еa1 — энергии активации каталитической реакции.
Пример 2. Для некоторой химической реакции присутствие катализатора позволяет уменьшить энергию активации химического процесса, реализуемого при температуре 500 °С, от 50 до 35 кДж. Покажем:
1)во сколько раз увеличится скорость каталитической реакции по сравнению с некаталитической, полагая, что все другие факторы скорости реакции остаются неизменными;
2)при какой температуре каталитическая реакция протекала бы с такой же скоростью, что и некаталитическая при 500 °С;
3)какие преимущества дает использование катализатора?
Решение
1. Пусть для некаталитической реакции уравнение Аррениуса имеет вид:
k |
Aexp |
|
|
Ea1 |
. |
(1) |
|
|
|||||
1 |
|
|
RT |
|
|
|
|
|
|
|
|
|
В присутствии катализатора это уравнение имеет вид:
|
|
|
Ea 2 |
|
|
|
k2 |
Aexp |
|
. |
(2) |
||
RT |
||||||
|
|
|
|
|
Если поделим уравнение (1) на уравнение (2), то после логарифмирования получим:
7 Обратим внимание, что для решения задачи не требуется знания численного значения Еa1 — энергии активации каталитической реакции.
201

ln |
k |
|
|
E |
E |
|
(5 3,5) 104 |
= 2,3; |
||
|
2 |
a1 |
a 2 |
|
|
|
||||
|
RT |
8,314 773 |
||||||||
|
k |
|
|
|
||||||
|
|
1 |
|
|
|
|
|
|
|
|
откуда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k2 |
10,3 и k |
2 |
10,3k . |
|
||
|
|
|
|
k1 |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2. Найдем температуру, при которой k2 будет иметь такое же значение, что и k1 при 500 °С (или 773 К). Это означает, что надо найти
температуру Т2, для которой |
k2 |
1и ln k2 |
= 0. То есть |
|||||
|
k |
|
|
|
k |
|
||
|
|
1 |
|
|
|
1 |
|
|
ln k2 |
|
Ea1 |
|
Ea 2 |
0 , |
|||
RT |
RT |
|||||||
|
k |
|
|
|
|
|||
|
1 |
|
|
1 |
|
2 |
|
|
откуда
Ea1 Ea 2
RT1 RT2
или
T |
T |
E |
T 773 |
3,5 104 |
= 541,1 К (261,8 °С). |
a 2 |
5,0 104 |
||||
|
|||||
2 |
1 E |
1 |
|
||
|
|
a1 |
|
|
|
3. Использование катализатора позволяет понизить температуру, не уменьшая скорости процесса, что приведет к экономии энергии (особенно это важно для промышленных процессов).
Пример 3. Экспериментально установлено, что реакция
2Се4+ + Тl = 2Се3+ + Т13+
протекает в растворе очень медленно, но ускоряется в присутствии ионов Ag+, причем скорость становится пропорциональной концентрации ионов Ag+. На основании предложенного механизма для этой реакции
|
+ |
|
4+ |
k1 |
|
2+ |
|
3+ |
|
(1) |
|
|
Ag |
|
|||||
Ag |
+ Се |
|
|
|
+ Се |
||||
|
|
|
|
|
k 1 |
|
|
|
|
(2) |
Ag |
2+ |
+ Tl |
+ |
k2 |
|
+ |
+ Tl |
2+ |
|
|
Ag |
|
||||||
202
(3) |
Tl |
2+ |
+ Се |
4+ k3 |
3+ |
+ Се |
3+ |
|
Tl |
|
|
необходимо вывести кинетическое уравнение для образования продукта реакции — ионов Т13+.
Решение. Скорость образования продукта Т13+ можно записать как
d cTl3 |
k c |
2 c |
4 . |
(4) |
|
dt |
|||||
3 Tl |
Ce |
|
|
||
|
|
|
Ион Т12+образуется только на стадии (2) и вступает в реакцию лишь на стадии (3), поэтому скорости этих двух стадий выравниваются, т. е.
d cTl2 |
k c |
2 c |
|
k c 2 c 4 |
0, |
dt |
|
||||
2 Ag |
Tl |
3 Tl Ce |
|
||
|
|
||||
|
k2cAg2 cTl |
k3cTl2 cCe4 . |
(5) |
||
Концентрацию другого промежуточного соединения, Ag2+, находим, используя принцип квазистационарных концентраций:
d cAg2 |
k c |
+ c |
4+ k c |
2+ c |
3+ k c |
2+ c + 0. |
(6) |
|
dt |
||||||||
1 Ag |
Ce |
1 Ag |
Ce |
2 Ag |
Tl |
|
||
|
|
Подставляя значение cAg2+ из выражения (6) в уравнение (4), учитывая (5), получим:
d c |
3 |
|
k1k2c |
+ c |
4+ c |
+ |
|
|
k1c |
|
+ c |
4+ |
|
|
|
Tl |
|
|
Ag |
Ce |
Tl |
|
|
|
Ag |
|
Ce |
|
. |
(7) |
|
dt |
|
k c 3+ k c + |
|
k 1c 3+ |
1 |
||||||||||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
k2cTl+ |
|
|
||||
|
|
|
1 Ce |
|
2 Tl |
|
|
|
|
Ce |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Значение отношения констант k 1 в начальный период реакции та- k2
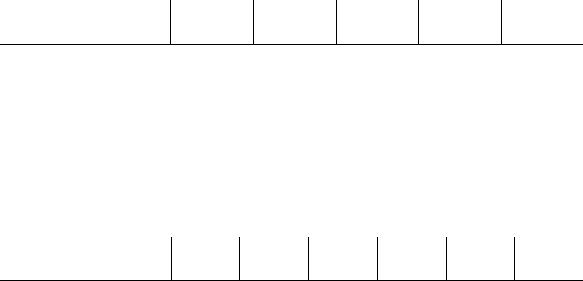
ково, что в знаменателе никакой член не является доминирующим — это не позволяет провести аппроксимацию. Но на последних стадиях реакции первый член становится преобладающим, т. е. единицей можно пренебречь, и выражение для скорости примет вид:
203
d c |
3 |
|
k1k2c |
|
+ c |
|
4+ c |
+ |
|
|
Tl |
|
|
Ag |
Ce |
Tl |
|
. |
(8) |
||
dt |
|
k |
|
c |
3+ |
|
||||
|
|
|
|
|
|
|||||
|
|
|
|
1 Ce |
|
|
|
|
|
|
Полученное кинетическое уравнение подтверждает опытный факт прямо пропорциональной зависимости скорости образования продуктов от концентрации катализатора — ионов Ag+.
9.2.ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.Химическая реакция
CH3COOCH3 (aq) H2O CH3COH(aq) + CH3OH(aq)
катализируется ионами Н+. Экспериментально установлено, что наблюдаемая (эффективная) константа скорости связана с константой скоро-
сти некаталитического процесса соотношением: kэф k(cH+ )n . Опытные данные следующие:
kэф · 104, с–1 |
0,108 |
0,585 |
1,000 |
2,682 |
3,469 |
cHCl, моль/дм3 |
0,1005 |
0,5024 |
0,8275 |
1,8000 |
2,4290 |
Определите k и n для этой каталитической реакции.
2. Химическая реакция
CrCl2 (H2O)+4 (aq) H2O CrCl(H2O)52+ (aq) + Cl (aq)
замедляется при увеличении концентрации ионов Н+ в среде. Наблюдаемая при этом эффективная константа скорости связана с константой
скорости в отсутствии ионов Н+ соотношением: kэф k kH+ cH1+ .
cHCl, моль/дм3 |
0,200 |
0,861 |
1,005 |
4,196 |
8,000 |
9,953 |
kэф · 103, с–1 |
1,100 |
0,341 |
0,307 |
0,170 |
0,078 |
0,070 |
Используя экспериментальные данные, найдите постоянные k и
kH+ .
3. Влияние первичного солевого эффекта на скорость реакции можно отметить, если проследить за скоростью, с которой фенолфталеин изменяет цвет в растворе KOH (0,31 М) в зависимости от концентрации хлорида натрия в растворе. Установлено, что наблюдаемая константа скорости связана с константой скорости реакции соотношением: kэф k k cNaCl .
204
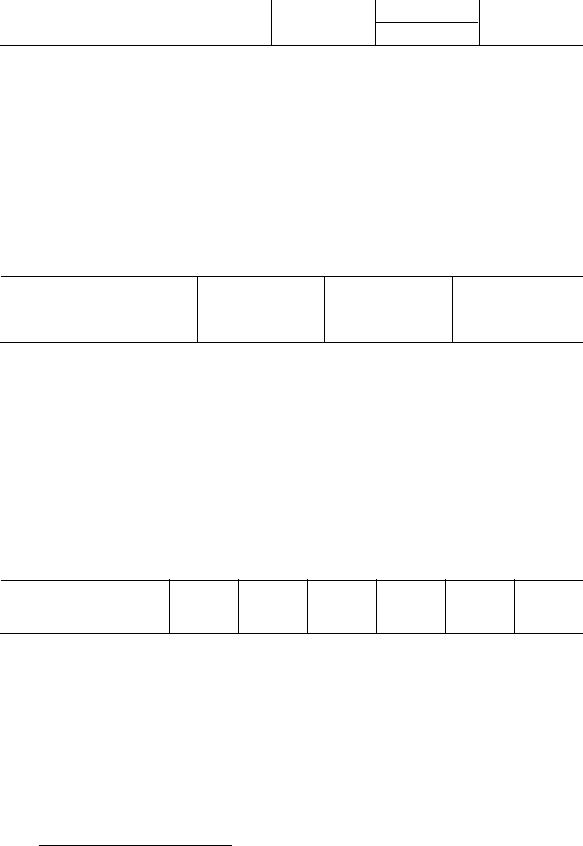
cNaCl, моль/дм3 |
0,050 |
0,116 |
0,194 |
kэф · 103, с–1 |
1,746 |
2,006 |
2,176 |
Используя экспериментальные данные, найдите постоянные k и k'.
4. Исследовалась кинетика разложения гидропероксида кумила в среде хлорбензола при Т = 373 К в присутствии катализаторов — солей 2-этилгексаноатов цинка, кадмия и ртути. Гидропероксид кумила образует с катализатором прочный промежуточный комплекс.
Концентрации катализаторов [МеЭГ2] были выбраны одинаковыми, равными 5 · 10–3 моль/дм3.
При изменении состава катализатора константа скорости реакции и константы равновесия комплексов промежуточных соединений изменялись следующим образом:
Катализатор |
[ZnЭГ2] |
[CdЭГ2] |
[HgЭГ2] |
kэф · 102, с–1 |
1,28 |
1,13 |
0,38 |
Ka, дм3/моль |
2,51 |
4,05 |
4,86 |
Проверьте применимость корреляционного соотношения Бренстеда: ln k ln В ln Ka . Найдите значения постоянных В и .
5. Мутаротация8 глюкозы катализируется кислотами и основаниями и имеет первый порядок по концентрации глюкозы. Если в качестве катализатора используется хлорная кислота, то концентрацию ионов водорода можно считать равной концентрации хлорной кислоты, а влияние перхлорат ионов можно не учитывать, так как он является очень слабым основанием.
Экспериментально найдено, как меняется эффективная константа скорости от концентрации хлорной кислоты:
c HClO4 , моль/дм3 |
0,0010 |
0,0048 |
0,0099 |
0,0192 |
0,0300 |
0,0400 |
kэф · 104, мин–1 |
1,25 |
1,38 |
1,53 |
1,90 |
2,15 |
2,59 |
Постройте график зависимости kэф k0 kH+ cH+ и определите постоянные этого уравнения: k0 , kH+ .
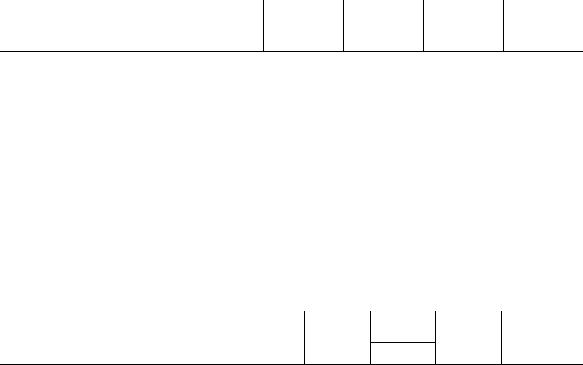
6. Каталитическая реакция синтеза C6H5COC6H5 по методу Фриделя– Крафтса осуществляется в присутствии катализатора AlCl3 (aq) по механизму:
8 Мутаротация (от лат. muto — изменяю и rotatio — вращение) — изменение величины оптического вращения растворов оптически активных соединений вследствие их эпимеризации.
205
|
|
|
|
|
|
|
|
|
k1 |
|
|
|
|
|
|
C6H5COCl + AlCl3 |
|
||
|
|
|
|
|
|
A |
|||
|
|
|
|
|
|
|
|
|
k 1 |
|
|
|
|
|
A + C6H6 |
|
k2 |
|
|
|
|
|
|
|
|
C6H5COC6H5 + AlCl3 + HCl |
|||
где |
|
A |
— |
некоторое |
промежуточное соединение. При условии |
||||
c0 |
H |
COCl |
= c0 |
H |
= 10–2 |
моль/дм3 и c0 |
= 10–3 моль/дм3 начальная ско- |
||
C |
C |
6 |
|
AlCl |
|
||||
6 |
|
5 |
|
6 |
|
|
3 |
|
|
рость образования C6H5COC6H5 равна 5 · 10–4 моль/(дм3 с).
Во сколько раз возрастет скорость реакции при увеличении в 10 раз концентрации: а) C6H5COCl; б) C6H6 ; в) AlCl3 .
7. Реакция окисления гидроксиламина в присутствии ЭДТА (этилендиаминтетрауксусной кислоты) является каталитической и протекает по механизму:
(1) |
|
|
H2O |
NH2OH + OH NH2O |
|
||
(2) |
NH2O + O2 продукты + OH |
||
Лимитирующей стадией этого процесса является вторая стадия. Была изучена кинетика этого процесса при изменении концентрации катализатора:
cOH , моль/дм3 |
0,5 |
1,0 |
1,6 |
2,4 |
kэф · 104, с–1 |
2,15 |
2,38 |
3,32 |
3,54 |
Используя значение ионного произведения воды Kw = 1 · 1014, рассчитайте кислотность среды h0 , постройте график зависимости 1/ kэф от
1/ h0 и определите k2 и константу равновесия реакции депротонизации гидроксиламинаKa .
8. Реакция гидролиза диазоуксусного эфира протекает по схеме:
N2CHCOOC2H5 (aq) H2O HOCH2COOC2H5 (aq) + N2
Катализатором данного процесса являются ионы водорода. Эффективная константа скорости процесса изменяется с концентрацией ионов водорода следующим образом:
cH3O+ 103, моль/дм3 |
0,46 |
0,87 |
1,58 |
3,23 |
kэф · 102, дм3/(моль с) |
1,68 |
3,20 |
5,78 |
12,18 |
Постройте график зависимости kэф k0 kH+ cH+ и определите постоянные этого уравнения: k0 , kH+ .
206

9. Карбоновые кислоты не реагируют с гидропероксидами в отсутствие катализаторов. Реакцию образования пероксиэфиров (ROOC(O)R'), протекающую по общей схеме
+
ROOH R C(O)OH H ROOС(O)R H2O
катализируют добавки сильных кислот. В таблице приведены экспериментальные данные изменения эффективной константы скорости реакции (293 К) синтеза третбутилпероксиацетата из гидропероксида трет- бутила и уксусной кислоты в зависимости от функции кислотности Гаммета. Необходимая кислотность раствора в изученных растворах достигалась и изменением концентрации катализатора (HClO4), и изменением концентрации воды:
–Н0 |
0,546 |
0,677 |
0,840 |
|
0,998 |
1,178 |
1,476 |
1,972 |
|
|
|
|
|
|
|
|
|
kэф · 107, дм3/(моль с) |
2,0 |
2,5 |
4,0 |
|
5,6 |
8,3 |
18 |
60 |
Постройте график |
зависимости lg kэф – H0 |
и определите k2Ka . Счи- |
||||||
тая k2 = 0,012 дм3/(моль ч), оцените константу протонизации гидропероксида трет-бутила.
10. Кинетику окисления D-глюкозы (S) дихлоризоциануровой кислотой (окислитель, О) исследовали в присутствии постоянных концентраций уксусной (АсОН) и хлорной кислот при T = 313 К. В отсутствии катализатора (RuCl3) реакция практически не протекает. Изучено, как изменяется константа скорости этой реакции при изменении концентрации катализатора RuCl3. Порядок реакции по D-глюкозе равен нулю, порядок реакции по дихлоризоциануровой кислоте — первый.
Условия опытов: cS = 0,01 моль/дм3; c |
= 0,01 моль/дм3; c |
= 50 %; |
|||||||
c |
= 0,0005 моль/дм3. |
|
|
HClO4 |
|
AcOH |
|
||
|
|
|
|
|
|
|
|
||
O |
|
|
|
|
|
|
|
|
|
|
cRuCl3 106, моль/дм3 |
|
|
1,25 |
|
2,50 |
3,75 |
|
5,00 |
|
kэф · 104, с–1 |
|
|
2,6 |
|
5,4 |
8,0 |
|
10,8 |
|
Постройте график зависимости |
kэф k0 k |
c |
и определите по- |
|||||
стоянные этого уравнения: k0 |
, k . |
|
|
RuCl3 RuCl3 |
|
|
|
||
|
|
|
|
|
|
||||
|
|
RuCl3 |
|
|
|
|
|
|
|
11. Исследовалась кинетика разложения гидропероксида кумила в среде хлорбензола в присутствии катализаторов — солей 2-этилгексаноатов цинка, кадмия и ртути. Были определены теплоты образования промежуточного комплекса гидропероксида кумила с различными катализаторами и энергии активации всего процесса. При изменении состава катализатора эти величины изменялись следующим образом:
207
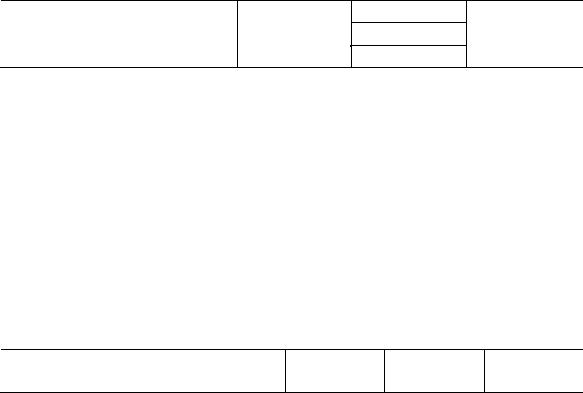
Катализатор |
[ZnЭГ2] |
[CdЭГ2] |
[HgЭГ2] |
– H , кДж/моль |
71,07 |
63,18 |
128,9 |
Еa, кДж/моль |
70,82 |
77,60 |
117,8 |
Проверьте применимость корреляционного соотношения Бренстеда: Ea E0 H . Оцените значения постоянных Е0 и .
12. Реакция
CH3COCH3 (aq) I2 (aq) H+ CH3COH2I(aq) + H+ (aq) + I (aq)
протекает при температуре 293 К в кислой среде и относится к автокаталитическим химическим реакциям. Скорость этой реакции не зависит от концентрации I2 . Начальная концентрация CH3COCH3 равна
0,683 моль/дм3. За ходом реакции следили по количеству ионов водорода (х), образовавшихся к моменту времени t. Получены следующие данные:
t, ч |
24 |
46 |
65 |
х · 103, моль/дм3 |
0,196 |
0,602 |
1,492 |
Экспериментально установлено, что изменение концентрации катализатора во времени можно описать уравнением:
ln x ln cH0 + (cCH0 3OCH3 cH0 + )kt .
Определите кинетические характеристики этой автокаталитической реакции: cH0 + и k. Рассчитайте cH+ к моменту времени t = 150 ч.
13. Исследовалась кинетика реакции образования надуксусной кислоты при Т = 293 К. Реакция протекает как обратимая химическая реакция по схеме:
|
k1 |
|
CH3COOH(aq) H2O2 |
|
CH3COOOH(aq) + H2O(aq) |
(aq) |
||
|
k2 |
|
и катализируется минеральными кислотами. Для стабилизации распада надуксусной кислоты в реакционную смесь вводили ортофосфорную кислоту. Установлено, что прямая реакция имеет первый порядок по уксусной кислоте и пероксиду водорода, а обратная — по надуксусной кислоте и воде. Константа равновесия этой реакции равна 2,10. При кон-
центрациях компонентов |
исходной смеси |
c0 |
= 4,48 моль/дм3, |
||||
|
|
|
|
|
H2O2 |
|
|
c0 |
COOH |
= 11,2 моль/дм3 |
и |
концентрации |
катализатора c |
= |
|
CH |
|
|
|
|
H SO |
4 |
|
3 |
|
|
|
|
|
2 |
|
208

= 0,057 моль/дм3 были определены константы скоростей прямой и об-
ратной реакций: k1 = 9,46 · 10–5 дм3/(моль c); k2 = 4,51 · 10–5 дм3/(моль c).
Было изучено влияние концентрации серной кислоты на кинетические параметры процесса. Получены следующие данные:
cH2SO4 , моль/дм3 |
0,011 |
0,023 |
0,034 |
0,046 |
0,069 |
k1эф · 105, дм3/(моль c) |
0,44 |
0,85 |
1,26 |
4,13 |
6,79 |
k2эф · 105, дм3/(моль c) |
0,21 |
0,40 |
0,60 |
1,97 |
3,24 |
Считая, что зависимость эффективных констант скоростей как прямого, так и обратного процессов от концентрации катализатора опи-
сываются уравнением kэф k kH+ cHn + , оцените постоянные этого урав-
нения, как для прямой, так и для обратной реакции. Найдите отношение констант скоростей для этой реакции при разных концентрациях катализатора и сделайте вывод, какой процесс (прямой или обратный) катализируется катализатором лучше.
14. Скорость реакции иодирования ацетона проводят в присутствии органических кислот как катализаторов:
CH3COCH3 + I2 H+ CH3COCH2I + HI
При стехиометрических соотношениях реагентов скорость этой реакции не зависит от концентрации иода. Наблюдается функциональная зависимость между наблюдаемой (эффективной) константой скорости и
значением константы диссоциации кислоты: kэф Kan . Изучив экспериментальные данные, определите значения параметров n и .
Кислота-катализатор |
Ka |
kэф, дм3/(моль c) |
Дихлоруксусная |
5,70 · 10–2 |
220 |
, -Дибромпропионовая |
6,70 · 10–3 |
63 |
Монохлоруксусная кислота |
1,41 · 10–3 |
34 |
Гликолевая кислота |
1,54 · 10–4 |
8,4 |
15. Реакция кислотно-каталитического гидролиза 3-изопропил-2-трет- бутилоксазиризина в водном растворе HClO4 (катализатор) описывается брутто-уравнением:
(CH3 )2 CH2ONC(CH3 )3 H2O (CH3 )2 CHCOH + CH3NH2 (CH3 )2 CO
Первой стадией этого процесса является быстрая реакция протонирования 3-изопропил-2-трет-бутилоксазиризина, а лимитирующей стадией — разрыв оксазиридинового кольца в протонированной молекуле.
209
Экспериментально определены эффективные константы скорости при различной кислотности раствора. Получены следующие данные:
h0 |
0,03 |
0,10 |
0,22 |
0,4 |
0,53 |
0,67 |
|
|
|
|
|
|
|
kэф, мин–1 |
0,30 |
8,3 · 10–3 |
5,9 · 10–3 |
5,0 · 10–3 |
4,85 · 10–3 |
4,76 · 10–3 |
Постройте график зависимости 1/ kэф от 1/ h0 , определите k2 и кон-
станту равновесия реакции протонизации 3-изопропил-2-трет- бутилоксазиризина Ka .
16. Реакция бензидиновой перегруппировки протекает при участии ионов гидроксония, играющих роль катализатора:
(C6H5 )2 (NH)2 2H3O+ (C6H5 )2 (NH+2 ) 2 2H2O (C6H5 )2 (NH+2 ) 2 2H2O k (C6H4 )2 (NH2 ) 2 2H3O+
Изучена зависимость эффективной константы скорости этой реакции от рН среды. Получены следующие данные:
рН |
1,1 |
1,0 |
0,8 |
0,7 |
0,54 |
0,40 |
|
|
|
|
|
|
|
kэф · 10–3, мин–1 |
2,5 |
2,5 |
12,6 |
25,1 |
63,1 |
100,0 |
Считая, что зависимость эффективной константы скорости этой реакции от рН описывается уравнением lg kэф lg k npH , постройте гра-
фик зависимости lg kэф от pH , определите k и порядок этой реакции по ионам катализатора.
17. Карбоновые кислоты не реагируют с гидропероксидами в отсутствие катализаторов. Реакцию образования пероксиэфиров (ROOC(O)R'), протекающую по общей схеме:
+
ROOH R C(O)OH H ROOС(O)R H2O
катализируют добавки сильных кислот. В таблице приведены экспериментальные данные изменения эффективной константы скорости реакции синтеза трет-бутилпероксикапроната из гидропероксида трет- бутила и капроновой кислоты в зависимости от функции кислотности Гаммета. Необходимая кислотность раствора в изученных растворах достигалась изменением концентрации катализатора (HClO4 и H2SO4 ) и
изменением концентрации воды:
210
