
Савинкина Е.В., Климова Э.В.Классификация неорганических веществ
.pdf60
Издание учебное
Савинкина Елена Владимировна, Климова Эльвира Владимировна
КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
Учебное пособие
Подписано в печать …………. Формат 60х84/16. Бумага писчая. Отпечатано на ризографе. Уч. изд. листов 1,5 Тираж 250 экз. Заказ № ……..
Московская государственная академия тонкой химической технологии им. М.В.Ломоносова.
Издательско-полиграфический центр.
119571 Москва, пр. Вернадского 86.
Федеральное агентство по образованию
Московская государственная академия тонкой химической технологии им. М.В.Ломоносова
Кафедра неорганической химии
Савинкина Е.В., Климова Э.В.
КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
Учебное пособие
Москва, 2009
www.mitht.ru/e-library
2
ББК 24г УДК 501
Рецензенты:
д.х.н., проф. Киселев Ю.М. (химический факультет МГУ) к.х.н., проф. Аликберова Л.Ю.
Савинкина Е.В., Климова Э.В. Классификация неорганических веществ Учебное пособие
М., МИТХТ им. М.В.Ломоносова, 2009 – 60 с.
Утверждено Библиотечно-издательской комиссией МИТХТ им. М.В.Ломоносова в качестве учебного пособия. Поз. Данное учебное пособие является дополнением к существующим учебникам по неорганической химии. Оно предназначено для самостоятельной работы студентов 1 курса бакалавриата по направлениям 510500 (Химия), 550800 (Химическая технология и биотехнология), 551600 (Материаловедение и технология новых материалов), 553500 (Защита окружающей среды), 552200 (Метрология, стандартизация и сертификация), 521500 (Менеджмент) и 3-4 курсов бакалавриата по направлениям 510500 (Химия).. В пособии дана информация о различных способах классификации неорганических веществ. Рассмотрены особенности состава, строения и химических свойств неорганических веществ, относящихся к различным классам.
©МИТХТ им. М.В.Ломоносова
|
59 |
Содержание |
|
1. Способы классификации неорганических веществ............... |
3 |
Развитие понятий о химических элементах, простых и |
|
сложных веществах ................................................................ |
3 |
Классификация неорганических веществ по поведению в |
|
растворе.................................................................................. |
5 |
Классификация неорганических веществ по строению и типу |
|
связей.................................................................................... |
11 |
Классификация неорганических веществ по составу.......... |
15 |
2. Классификация простых веществ........................................ |
19 |
Металлы................................................................................ |
20 |
Неметаллы............................................................................ |
22 |
Простые вещества с амфотерными свойствами ................. |
25 |
Благородные газы................................................................. |
26 |
3. Классификация простых соединений................................... |
27 |
Гидроксиды............................................................................ |
27 |
Оксиды................................................................................... |
35 |
Соли....................................................................................... |
38 |
4. Общие представления о комплексных соединениях........... |
44 |
Состав комплексных соединений......................................... |
44 |
Номенклатура комплексных соединений ............................. |
47 |
Поведение комплексных соединений в растворе................ |
49 |
5. Классификация комплексных соединений........................... |
52 |
Комплексы с неорганическими лигандами........................... |
52 |
Комплексы с органическими лигандами............................... |
56 |
www.mitht.ru/e-library
58
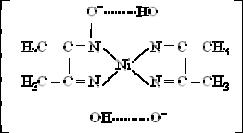
группы и через атом азота аминогруппы. Назовите образующийся комплекс и изобразите его графическую формулу.
2. Важное значение в химико-аналитической практике имеет открытая Л. А. Чугаевым реакция взаимодействия диметилглиоксима с катионами никеля(II) в аммиачной среде, приводящая к образованию малорастворимого ярко-красного комплексного соединения - бис(диметилглиоксимато)никеля(II)
К каким типам комплексов можно отнести это соедине-
ние?
3
1. Способы классификации неорганических веществ
Для систематического описания свойств химических веществ необходима их классификация. В отличие от органической химии, где классификация основана на таком естественном признаке органического соединения, как наличие одной или нескольких функциональных групп, в неорганической химии приходится рассматривать сразу целый ряд признаков, обусловливающих те или иные химические свойства. Поэтому, несмотря на кажущуюся простоту, проблема классификации неорганических веществ до сих пор остается нерешенной.
В химии широко используются представления о различных классах неорганических веществ. Однако границы между ними весьма размыты, поскольку при их определении постоянно смешиваются различные характеристики веществ. Для четкой классификации неорганических веществ, необходимо выбрать какой-то один признак. При этом нужно оценить достоинства и недостатки различных способов классификации неорганических веществ.
Развитие понятий о химических элементах, простых и сложных веществах
Элементом принято называть составную часть чего-либо. Уже древние ученые полагали, что все тела состоят из элементов. Однако понятие о химических элементах возникло лишь в XVII в. Английский физик и химик Роберт Бойль в 1661 г. в книге “Химик-скептик” определил элементы как “первоначальные и простые, вполне не смешанные тела, которые не составлены друг из друга, но представляют собой те части, из которых составлены все так называемые смешанные тела и на которые последние могут быть, в конце концов, разложены”. Он ввел представление о первичных корпускулах (мельчайших частицах) как элементах и о вторичных корпускулах как сложных телах. Бойль считал элементы именно веществами. Правда, он относил воду к чистым элементом, а золото, медь, ртуть и серу – к химическими соединениями или смесями.
В 1741 г. в работе “Элементы математической химии” русский ученый Михаил Васильевич Ломоносов высказал вполне современное представление об атомах как о мельчайших части-
www.mitht.ru/e-library
4
цах химических элементов, способных связываться в более крупные частицы (корпускулы) – молекулы, из которых состоят сложные вещества.
Французский химик Антуан Лавуазье первым научился выделять простые вещества из химических соединений. Он предположил, что каждый “элемент” соединения весит меньше, чем все соединение в целом. Долгое время понятия “элемент” и “простое вещество” не различали. Лавуазье, предложивший в 1789 г. “Таблицу простых тел” – по существу первую классификацию элементов, приравнивал смысл терминов “элемент” и “простое тело”.
В начале девятнадцатого века английский химик и физик Джон Дальтон определил элемент как вещество, состоящее из атомов одного вида. Атомы различных веществ различаются по массе и при превращениях веществ не изменяются, а только перегруппировываются. Дальтон писал: “Мы с таким же успехом можем стараться прибавить новую планету в Солнечную систему, как уничтожить или создать атом водорода”. Дальтон открыл закон кратных отношений: если два элемента образуют несколько соединений, то массы одного элемента, приходящиеся на одну и ту же массу другого, относятся как целые числа.
Шведский химик и минералог Йёнс Якоб Берцелиус в 1814– 18 гг. опубликовал таблицу, в которую он поместил атомные веса 46 элементов и данные о процентном составе около 2000 соединений, им проанализированных. В 1841 г. Берцелиус ввел понятие аллотропии. Так называют явление существования некоторых элементов (например, углерода и серы) в различных модификациях.
Таким образом, ученые многих стран внесли свой вклад в развитие представлений о химических элементах. Но все же решающую роль здесь сыграли работы русского ученого Дмитрия Ивановича Менделеева. Он первым начал разделять термины “элемент” и “простое тело”. Менделеев считал, что “простое тело есть вещество... с рядом физических признаков и химических реакций”. А под именем “элементы” должно подразумевать те материальные составные части простых и сложных тел, которые придают им известную совокупность физических и химических свойств”. В качестве одной из ярких иллюстраций отличий этих понятий он называл элемент углерод и простые вещества уголь, графит и алмаз. Л.И. Менделеев создал Периодическую систему
57
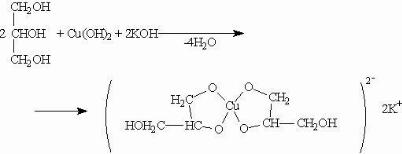
Органические лиганды нередко образуют хелаты – комплексные соединения, внутрення сфера которых состоит из циклических группировок, включающих комплексообразователь. Например, при взаимодействии гидроксида меди(II) с глицерином и другими многоатомными спиртами происходит растворение гидроксида и образуется комплексное соединение синего цвета. Внутренняя сфера комплекса содержит два замкнутых пятичленных цикла, в связи с чем полученный комплекс отличается высокой устойчивостью. Эта реакция используется для обнаружения многоатомных спиртов, имеющих гидроксильные группы при соседних атомах углерода -СН(ОН)-СН(ОН)-:
Подобные соединения могут образовывать и другие органические лиганды, содержащие несколько донорных атомов, например, анионы карбоновых кислот – карбоксилат-ионы. Кар- боксилат-ион может служить монодентантным лигандом, бидентатным хелатирующим лигандом или бидентатным мостиковым лигандом (в полиядерных комплексах).
Вопросы
1. Известно, что a-аминоуксусная кислота (глицин) может реагировать с гидроксидом меди с образованием синефиолетового прочного комплекса, растворимого в воде:
Cu(OH)2 + 2 NH2CH2COOH = [Cu(NH2CH2COO)2] + 2 H2O
Лиганд NH2CH2COO- (глицинат-ион) относят к категории бидентатных лигандов, образующих две химические связи с комплексообразователем – через атом кислорода карбоксильной
www.mitht.ru/e-library
56
2. Составьте уравнения окислительновосстановительных реакций с участием комплексов в водном растворе: а) гексацианоферрат(II) калия + хлор =, б) хлорид гексаамминкобальта(II) + пероксид водорода =. К каким типам комплексных соединений относятся реагенты и продукты?
Комплексы с органическими лигандами
Среди многочисленных и разнообразных комплексов с органическими лигандами можно выделить так называемые π- комплексы, в которых связь лиганда с комплексообразователем осуществляется за счет делокализованной π-связи. Первый такой комплекс был получен в 1830 г. датским химиком-органиком В. Цейзе и получил его имя – соль Цейзе K[Pt(C2H4)Cl3]. Строение этого комплекса было установлено лишь в 1953 г., когда было показано образование связи за счет взаимодействия π- электронов этилена с атомом платины.
Известно большое число соединений состава [M(C5H5)2], в которых в качестве лигандов выступают анионы очень слабой циклической кислоты циклопентадиена C5H6. Первое подобное соединение бис(циклопентадиенил)железо (ферроцен) [Fe(C5H5)2 было получено в 1951 г.
Циклопентадиен С5H6 – соединение с двумя двойными связями. Он является очень слабой кислотой. При взаимодействии с металлическим натрием образуется циклопентадиенилнатрий Na(C5H5) с анионом С5Н5–:
2Na + 2С5H6 = 2Na(C5H5) + H2
При действии циклопентадиенилнатрия Na(C5H5) на соль железа(II) в среде тетрагидрофурана выделяются оранжевые кристаллы бис(циклопентадиенил)железа:
FeCl2 + 2 Na(C5H5) = [Fe(C5H5)2] + 2 NaCl
Структуру таких комплексов назвали «сэндвичевой». Действительно, ферроцен напоминает сэндвич, где атом металла расположен между двух пентадиенильных колец. Он находится на равных расстояниях от всех атомов углерода и образует связь со всей -электронной системой лиганда:
5
химических элементов, отражающую свойства образованных ими простых и сложных веществ в зависимости от атомной массы.
По современным представлениям химический элемент – это отдельный атом или совокупность одинаковых атомов. А если между атомами одного и того же элемента появляются химические связи, это – простое вещество. Поскольку атомы могут быть связаны друг с другом по-разному, то один элемент иногда образует несколько простых веществ – аллотропных модификаций.
Вопросы
1.Перечислите аллотропные модификации углерода. Рассмотрите способы связывания атомов в структурах различных модификаций и сравните их физические и химические свойства.
2.Покажите, как меняются свойства простых веществ при изменении порядкового номера элемента в Периодической системе. Какие закономерности при этом наблюдаются?
3.Между атомами благородных газов в простых веществах не образуются химические связи. Можно ли считать химическими соединениями другие простые вещества?
Классификация неорганических веществ по поведению в растворе.
Одним из способов классификации сложных веществ является классификация по их поведению в водном растворе. В 1887 г. шведский физикохимик Сванте Аррениус предложил теорию электролитической диссоциации. Он утверждал, что в растворах многих веществ (электролитов) присутствуют ионы, способные перемещаться и проводить электрический ток. Многие электролиты распадаются на ионы полностью. Их называют сильными электролитами. В разбавленных растворах сильных электролитов присутствуют только продукты диссоциации (катионы и анионы). В растворах слабых электролитов имеются как продукты диссоциации (катионы и анионы), так и исходные молекулы.
www.mitht.ru/e-library

6
В зависимости от типа ионов, образующихся при диссоциации, химические вещества подразделяют на кислоты, основания, соли.
Таблица 1. Продукты диссоциации неорганических веществ
Класс |
Катионы |
Анионы |
Примеры |
соединений |
|
|
соединений |
Кислоты |
водорода |
анионы кислоты |
H+ | NO3– |
Основания |
металла |
гидроксид-ионы |
Na+ | OH– |
Соли |
металла |
анионы кислоты |
Na+ | NO3– |
Сильные основания, например гидроксид натрия, необратимо диссоциируют в водном растворе с образованием гидро- ксид-ионов, создавая щелочную среду:
NaOH = Na+ + OH–
Слабые основания, растворяясь в воде, также создают щелочную среду. В их растворе (например, в растворе аммиака) имеются как исходные гидратированные молекулы (не следует употреблять "гидроксид аммония" – такой частицы не существует), так и ионы:
NH3 . H2O 
 NH4+ + OH–
NH4+ + OH–
При диссоциации кислот в растворе образуются катионы водорода, и среда становится кислотной. Сильные кислоты (например, серная кислота) в водном растворе диссоциируют необ-
ратимо:
H2SO4 = 2H+ + SO42–
Слабые кислоты (например, угольная кислота) в водном растворе подвергаются обратимой диссоциации:
H2CO3 |
|
H+ + HCO3– |
|
|
|
|
|
|
|||
|
|
|
|||
Таблица 2. Некоторые кислоты и основания |
|||||
Вещества |
|
|
Сильные |
|
Слабые |
Основания |
|
|
KOH, |
Ca(OH)2, |
NH3.H2O |
|
|
|
Ba(OH)2 |
|
|
Кислоты |
|
|
HCl, HBr, HI, H2SO4, |
H3PO4, H2CO3, H2S |
|
|
|
|
HNO3 |
|
|
55
ным атомом всегда является наименее электроотрицательный элемент.
Анионные комплексы галогенов получают при взаимодействии в растворе соответствующих галогенидов с галогенами или межгалогенными соединениями:
KI + I2 = K[I(I)2]
CsCl + IBr = Cs[I(Br)(Cl)]
Синтез катионных комплексов галогенов возможен только с участием сильных акцепторов галогенидных ионов в средах, не содержащих восстановителей. Растворителями и одновременно поставщиками противоионов комплекса здесь служат со-
единения типа SbCl5, SbF5, PF5, BF3: BrF3 + AsF5 = [BrF2][AsF6]
Соединения, содержащие комплексные анионы, при нагревании легко разлагаются с выделением свободных галогенов или межгалогенных соединений, причем в составе остающейся соли всегда оказывается самый электроотрицательный из галогенов:
Rb[IBr2](т) = RbBr(т) + IBr(г);
K[I(I)2](т) = KI(т) + I2(г)
Эти комплексные соединения умеренными окислительными свойствами. Катионные комплексы галогенов – сильнейшие окислители. Они бурно реагируют с водой и органическими растворителями.
В среде межгалогенных соединений анионные и катионные комплексы галогенов взаимодействуют как кислоты и основания. Например, в жидком трифториде брома идет реакция:
Ag[BrF4](s) + [BrF2][SbF6](s) = Ag[SbF6](s) + 2 BrF3(ж)
Комплексные соединения, в которых лигандами являются молекулы оксида углерода, получили название карбонилов. Они обычно содержат металл в нулевой степени окисления, например [Cr(CO)6]. Образование карбонилов часто стабилизирует необычные степени окисления комплексообразователей – очень низкие и даже отрицательные.
Вопросы
1. Приведите по два примера а) квакомплексов, б) гидроксокомплексов, в) амминкомплексов, г) ацидокомплексов, д) идридокомплексы, е) комплексов галогенов, ж) карбонилов. Опишите их строение, способы образования и разрушения.
www.mitht.ru/e-library

54
Ацидокомплексы, содержащие в качестве лигандов анионы кислот, являются самыми многочисленными комплексами с неорганическими лигандами. Многие элементы образуют комплексы с галогенид-ионами, например:
B(OH)3 + 4KF = 3KOH + K[BF4] CuCl + Cl– = [CuCl2]–
В зависимости от числа лигандов во внутренней сфере комплекс может изменять окраску: Это относится, например, к бромокомплексам меди: [Cu(H2O)3Br]+ – светло-зеленый, [Cu(H2O)2Br2] – темно-зеленый, [Cu(H2O)Br3]– – коричневый, [CuBr4]2– – темно-вишневый
С другой стороны, один и тот же лиганд, например, тио- цианат-ион NCS–, образует разноцветные комплексы с разными комплексообразователями: синий комплекс тетракис(тиоцианато)кобальтат(II) [Co(NCS)4]2–, зеленоватый комплекс тетракис(тиоцианато)-феррат(II) [Fe(NCS)4]2–, красные комплексы [Fe(H2O)x(NCS)6–x]x–3, наиболее устойчивым из которых является трис(тиоцианато)триакважелезо [Fe(H2O)3(NCS)3].
Очень прочные комплексы образует с металлами циа- нид-ион. Примерами являются желтая кровяная соль K4[Fe(CN)6].3H2O и красная кровяная соль K3[Fe(CN)6] (тригидрат гексацианоферрата(II) калия и гексацианоферрат(III) калия, соответственно).
Комплексообразователями в гидридокомплексах, содержащих анион водорода Н–, обычно являются элементы IIIAгруппы. Наиболее устойчивы гидридокомплексы бора и алюминия. Они являются сильными восстановителями, реагируют с водой с выделением водорода:
Al[BH4]3 + 12H2O = Al(OH)3 + 3B(OH)3 + 12H2
Известно большое число комплексных соединений, , в которых и комплексообразователь, и лиганды представляют собой галогены. Они могут быть как анионными, так и катионными. Анионные комплексы могут включать атомы только одного галогена (обычно иода, реже – брома), например дииодоиодат(I) калия K[I(I)2], или нескольких галогенов, например тетрахлороиодат(III) калия K[ICl4]. В катионных комплексах комплексообразователем и лигандами всегда являются разные галогены, например гексахлоростибат дихлороиода(I) [ICl2][SbCl6].При наличии в составе комплексной частицы нескольких галогенов централь-
7
Таблица 3. Химические свойства оснований
Растворимые |
основания |
Молорастворимые основания |
|
(щелочи) |
|
|
|
Реагируют с кислотами: |
Реагируют с кислотами: |
||
2KOH + H2SO4 → K2SO4 + |
2Mg(OH)2 + 3H2SO4 → |
||
H2O |
|
|
→ MgSO4 + 3H2O |
При умеренном |
нагревании |
При умеренном нагревании раз- |
|
не разлагаются |
|
лагаются |
|
|
|
|
Mg(OH)2 → MgO + H2O |
Реагируют с растворами со- |
Реакции с растворами солей не- |
||
лей (если в их состав входит |
характерны |
||
металл, способный образо- |
|
||
вывать |
малорастворимый |
|
|
гидроксид): |
|
|
|
Fe2(SO4)3 + 6KOH → |
|
||
→ 2Fe(OH)3↓ + 3K2SO4 |
|
||
Реагируют с кислотными ок- |
Реакции с кислотными оксидами |
||
сидами: |
|
|
нехарактерны |
2KOH + CO2 → K2CO3 + H2O |
|
||
Таблица 4. Химические свойства кислот
Реагируют с металлами. Если металл находится в ряду напряжений металлов, до водорода, то выделяется водород и образуется соль. Исключение HNO3
Zn + 2HCl → ZnCl2 + H2↑
Реагируют с оксидами металлов. Образуется соль и вода
CuO + H2SO4 → CuSO4 + H2O
Реагируют с основаниями. Образуется соль и вода
NaOH + HCI → NaCI + H2O
Реагируют с солями. В соответствии с рядом кислот (каждая предыдущая кислота может вытеснить из соли последующую):
HNO3, H2SO4, HCl, H2SO3, H2CO3,H2S, H2SiO3, H3PO4
→
Образуются другая соль и другая кислота
ZnCl2 + H2SO4 → ZnSO4 + 2HCl↑
При нагревании некоторые кислоты разлагаются. Как правило, образуются оксид и вода
H2SiO3 → SiO2+ H2O
www.mitht.ru/e-library

8
Соли при растворении в воде диссоциируют на катионы металла и анионы кислоты. Растворы многих солей имеют кислотную или щелочную среду за счет обратимого гидролиза по катиону или по аниону.
Так, при гидролизе нитрата железа(III) сначала происходит диссоциация на катион железа(III) и нитрат ион. Далее катион Fe3+ обратимо взаимодействует с водой с образованием ка-
тионов водорода:
Fe(NO3)3 = Fe3+ + 3NO3–
Fe3+ + H2O  FeOH2+ + H+ (кислотная среда)
FeOH2+ + H+ (кислотная среда)
При гидролизе карбоната натрия карбонат-ион, образовавшийся при диссоциации соли, обратимо реагирует с водой с
образованием гидроксид-ионов: Na2CO3 = 2Na+ + CO32–
CO32– + H2O 
 HCO3– + OH– (щелочная среда)
HCO3– + OH– (щелочная среда)
Несмотря на свое название, многие кислые соли (например, гидрокарбонат натрия) создают в водном растворе щелочную среду:
NaHCO3 = Na+ + HCO3– |
|
|
|||
HCO3– + H2O |
|
|
H2CO3 + OH– |
|
|
|
|
|
|
||
|
|
|
|
||
Определить среду раствора можно с помощью индикато- |
|||||
ров. |
|
|
|
||
Таблица 5. Окраска индикаторов |
|
||||
Индикатор |
|
Кислотная |
Нейтральная |
Щелочная |
|
|
|
|
среда |
среда |
среда |
Лакмус |
|
Красный |
Фиолетовый |
Синий |
|
Фенолфталеин |
|
Бесцветный |
Бесцветный |
Малиновый |
|
Метиловый |
|
Розовый |
Оранжевый |
Желтый |
|
оранжевый |
|
|
|
|
|
Вдальнейшем были предложены и другие теории кислот
иоснований, из которых наибольшее распространение получила протонная теория, созданная датским физикохимиком Иоханнесом Николаусом Брёнстедом и английским химиком Томасом Лоури.
С точки зрения протолитической теории кислот и оснований Бренстеда-Лоури кислотные или основные свойства ве-
ществ обусловлены их способностью отдавать или присоединять катион водорода (протон Н+). Такие процессы могут проте-
|
53 |
|
[Zn(H2O)(OH)3]– + H2O |
|
[Zn(H2O)2(OH)2] + OH– |
|
||
|
||
Встречаются и более устойчивые в воде гидроксокомплексы: хорошо растворимые Na2[Sn(OH)6] и Na2[Pb(OH)6], малорастворимые Na[Sb(OH)6] и Ag2[Pt(OH)6]. Гидроксокомлпексы легко разрушить действием любых кислот, даже самых слабых, например, водным раствором диоксида углерода CO2:
[Al(OH)4]– + 3CO2 = Al(OH)3 + 3HCO3–
Химия гидроксокомплексов очень сложна. Так, в водном растворе гидроксокомплекса алюминия можно обнаружить много разных ионов: [Al(OH)4]–, [Al(H2O)2(OH)4]–, [Al(H2O)4(OH)2]+, [Al2(H2O)8(OH)2]4+. В сложных гидроксокомплексах алюминия и некоторых других металлов атомы комплексообразователя могут связываться через мостиковые гидроксо-лиганды:
|
|
OH |
|
|
|
\ |
| |
/ |
\ |
| |
/ |
|
Al |
|
|
Al |
|
/ |
| |
\ |
/ |
| |
\ |
OH
Комплекс может включать одновременно мостиковые лиганды разных типов. В катионе [Sn3(OH)4]2+ одна из мостиковых гидроксогрупп соединяет три атома олова, а остальные три мос-
тика – по два атома олова: |
Sn |
|
|
|
|
/ |
| |
\ |
HO |
| |
OH |
| |
OH |
| |
| / |
\ |
| |
Sn |
|
Sn |
\ / OH
Аммины содержат в составе внутренней сферы молекулы аммиака. Более широко понятие аммиакаты относится к соединениям, включающим также внешнесферные молекулы аммиака. Для многих переходных элементов аммины более устойчивы, чем аквакомплексы, и легко образуются в водном раство-
ре:
[Cu(H2O)4]2+ + 4NH3 
 [Cu(NH3)4]2+ + 4H2O
[Cu(NH3)4]2+ + 4H2O
Такие комплексы разрушаются при нагревании и под действием кислот, вызывающих протонирование лиганда.
www.mitht.ru/e-library
52
5. Классификация комплексных соединений
Комплексы с неорганическими лигандами
Многообразие комплексных соединений и их свойств не позволяют создать единую классификацию. Наиболее простой является классификация по типу лигандов. В этом случае все комплексы можно условно разделить на соединения с неорганическими и органическими лигандами, а далее рассматривать каждый тип лигандов в отдельности.
Аквакомплексы содержат в качестве лигандов молекулы воды. Они существуют в водных растворах, а также во многих крисатллогидратах. Так, при растворении в воде белого порошок сульфата меди CuSO4 образуется голубой раствор за счет образования аквакомплекса – катиона тетрааквамеди(II) [Cu(H2O)4]2+. Если из такого раствора выпаривать воду, то начнется кристаллизация голубого пентагидрата сульфата меди CuSO4.5H2O, известного как медный купорос, который содержит комплексные катионы [Cu(H2O)4]2+, поэтому более точное название соединения – гидрат сульфата тетрааквамеди(II), а формула – [Cu(H2O)4]SO4.H2O. При прокаливании этого вещества оно теряет воду и вновь превращается в белый CuSO4.
Важнейшим свойством аквакомплексов в растворе является способность к протолизу – большинство из них являются слабыми кислотами. При этом протоны уходят из молекул воды,
являющихся лигандами, например:
[Cr(H2O)6]3+ + H2O 
 H3O+ + [Cr(H2O)5OH]2+
H3O+ + [Cr(H2O)5OH]2+
Вслед за первым комплексный катион может потерять и следующие протоны, но по мере удаления протонов из внутренней сферы кислотные свойства резко ослабевают. Кислотные свойства аквакатионов тем сильнее, чем выше степень окисления комплексообразователя. Катион гексаакважелеза(II) [Fe(H2O)6]2+, например, проявляется слабые кислотные свойства, а катион гексаакважелеза(III) [Fe(H2O)6]3+является более сильной кислотой, чем уксусная и ортофосфорная.
В гидроксокомплексах лигандами являются гидроксидионы. Гидроксокомплексы обычно устойчивы только в присутствии избытка гидроксид ионов. При разбавлении растворов они
легко разрушаются, выделяя гидроксид-ионы: [Zn(OH)4]2– + H2O 
 [Zn(H2O)(OH)3]– + OH–
[Zn(H2O)(OH)3]– + OH–
9
кать в любом растворителе, а не только в воде, как в теории Аррениуса. Так, например, при взаимодействии катиона аммония и сульфид-иона происходит перенос протона от NH4+ к S2–
NH4+ + S2– 
 NH3 + HS–
NH3 + HS–
Следовательно, катион аммония проявляет свойства кислоты, а сульфид ион – свойства основания. При этом образуется новая кислота – гидросульфидион и новое основание – аммиак.
Пары химических частиц, отличающиеся только содержанием катионов водорода, называются сопряженными. В данном случае парами сопряженная кислота/сопряженное основание являются NH4+/NH3 и HS–/S2–. Процесс переноса протона (протолиз) является обратимым, и гидросульфид-ион также передает протон молекуле аммиака с образованием исходных веществ.
В водных растворах кислота передает протон молекуле воды, которая в данном случае является основанием, превращаясь в катион оксония H3O+. Кислоты могут находиться в виде нейтральных молекул а также в виде анионов и катионов.
Пример нейтральной кислоты – циановодородная (синильная) кислота:
HCN + H2O |
|
CN– + H3O+ |
|
||
Пример анионной кислоты – дигидроортофосфат-ион: |
||
H2PO4– + H2O |
HPO42– + H3O+ |
|
Пример катионной кислоты – катион аммония: |
||
NH4+ + 2 H2O |
NH3.H2O + H3O+ |
|
Если кислота передает протон молекуле воды необратимо, то ее считают сильной кислотой. К сильным кислотам относятся галогеноводородные кислоты (кроме слабой фтороводородной) и те из кислородсодержащих кислот, которые отвечают правилу Полинга: кислоты состава НхЭОу являются сильными, если у – х 2. Анионы сильных кислот являются непротолитами и не участвуют в реакциях протолиза.
Основание в водном растворе забирает протон у молекулы воды, которая в данном случае выступает в роли кислоты, превращаясь в гидроксид-ион OH–. Основания также могут быть нейтральными, анионными или катионными.
Пример нейтрального основания – гидрат аммиака:
www.mitht.ru/e-library

10 |
|
NH3.H2O + H2O |
NH4+ + OH– + H2O |
Пример анионного основания – цианид-ион: |
|
CN– + H2O |
HCN + OH– |
Редкий случай катионного основания – катион гидразиния(1+) N2H5+. У одного из атомов азота остается неподеленная пара электронов, поэтому он может присоединить еще один протон:
N2H5+ + H2O 
 N2H62+ + OH–
N2H62+ + OH–
Если основание получает протон от молекулы воды необратимо, то его считают сильным основанием. К сильным основаниям относятся амид-ион NH2–, метилат-ион CH3O– и другие алкоголят-ионы, гидроксид-ион ОН–, а также соединения, дающие эти ионы при диссоциации. Поэтому сильными основаниями считают гидроксиды щелочных металлов, бария, таллия(I). Эти хорошо растворимые сильные основания носят название щелочей. В растворах щелочей обычно рассматривают только диссоциацию вещества, поскольку при этом сразу образуются гидро- ксид-ионы.
Многие химические частицы могут проявлять свойства как кислот, так и оснований. Их называют амфолитами. Амфолитами является большинство гидроанионов кислот, например, гидрокарбонат-ион. Передавая протон молекуле воды, гидро- карбонат-ион является кислотой
HCO3– + H2O |
CO32– + H3O+ |
Забирая протон у молекулы воды, гидрокарбонат-ион |
|
проявляет свойства основания |
|
HCO3– + H2O |
H2CO3 + OH– |
Поскольку основные свойства гидрокарбонат-иона сильнее, чем кислотные, вторая реакция протекает в большей степени, и среда в растворе будет щелочной.
Хотя в теориях Аррениуса и Брёнстеда-Лоури используются разные способы описания кислот и оснований и их поведения в водном растворе, применение этих двух теорий приводит к одному и тому же результату: в растворах кислот среда кислотная, в растворах оснований – щелочная. Среда в растворах солей зависит от того, как взаимодействуют с водой ионы, образующиеся при диссоциации.
51
Большое влияние на прочность комплексов оказывает так называемый хелат-эффект. Он наблюдается в тех случаях, когда в образовании комплексов участвуют полидентатные лиганды, которые при образовании связей с комплексообразователем формируют хелатные циклы. Так, аммиак в комплексе никеля(II) легко замещается на молекулы этилендиамина NH2CH2CH2NH2 (En), поскольку образуется более прочный ком-
плекс ( 3 = 1,3.1019) с пятичленным хелатным циклом: [Ni(NH3)6]2+ + 3 En [Ni(En)3]2+ + 6 NH3
Использование констант образования комплексов позволяет отличать их от солей. Комплексы и соли по-разному ведут себя в водных растворах: соли диссоциируют на катионы и анионы необратимо, а в комплексах происходит обратимое замещение лигандов на молекулы воды, характеризуемое соответствующими константами.
В то же время процесс диссоциации соединения на комплексные ионы и ионы, составляющие внешнюю сферу, проте-
кает необратимо:
K2Cu(SO4)2 = 2K+ + Cu2+ + 2SO42– (двойная соль) K2[Cu(C2O4)2] = 2K+ + [Cu(C2O4)2]2– (комплексная соль) [Cu(C2O4)2]2– 
 Cu2+ + 2C2O42–; 3 ~ 1010
Cu2+ + 2C2O42–; 3 ~ 1010
Вопросы
1.Напишите уравнения электролитической диссоциации
вводном растворе для комплексных соединений: а) гидроксид диамминсеребра(I), б) тетрахлороплатинат(II) калия, в) цис-
дихлородиамминплатина, г) K2[PtCl6], д) [Pt(NH3)2Br4].
2. Составьте уравнения ступенчатых реакций образования комплексов и запишите для них выражения ступенчатых констант устойчивости Kn: а) тетрагидроксоцинкат(II)-ион, б) катион диамминмеди(I). Пользуясь справочником, приведите значения ступенчатых констант устойчивости (lg Kn) этих комплексов
исделайте вывод об их устойчивости.
3.Составьте уравнения реакций образования следующих комплексов из катионов центральных атомов и лигандов и запишите для них выражения общих констант устойчивости βn: а) ка-
тион тетраамминмеди(II) и катион бис(этилендиамин)меди(II), б) гексацианоферрат(III)-ион и гексацианоферрат(II)-ион, в) г) тет- раиодокадмат(II)-ион и тетраиодомеркурат(II)-ион.
www.mitht.ru/e-library
