
1А,2А,6А и 7А, комментарии к практикуму
.pdfпоэтому в растворе [PO43−] << [H2PO4−] << [HPO42−]. Концентрация ортофосфат-иона в растворе Na2HPO4 мала, и произведение концентраций ионов C3(Li+)×C(PO43−) лишь незначительно превышает
ПР(Li3PO4). Поэтому вместо выпадения обильного осадка Li3PO4
наблюдается лишь легкое помутнение раствора.
Добавление гидроксид-ионов смещает равновесие (а) влево,
равновесие (б) – вправо. Концентрация ортофосфат-ионов повышается.
Если щелочь добавлена в достаточном количестве, анионы HPO4− и
H2PO42− полностью превратятся в ортофосфат-ион. В результате литий практически нацело будет осажден в виде Li3PO4. Мы наблюдаем резкое увеличение массы и объема осадка. Уравнение реакции:
3Li+ + HPO42− + OH− = Li3PO4(т) + H2O
17.2. ЭЛЕМЕНТЫ IIА-ГРУППЫ
(БЕРИЛЛИЙ И МАГНИЙ)
17.2.1. ПРОСТЫЕ ВЕЩЕСТВА
Магний взаимодействует с сильными "кислотами-неокислителями"
по уравнению:
Mg(т) + 2H3O+ = Mg2+ + H2(г) + 2H2O
К сильным "кислотам-неокислителям" относят такие сильные кислоты,
окислительные свойства которых обусловлены восстановлением
водорода(+I) (в растворе – иона оксония) до диводорода. При этом степень окисления элемента, образующего кислоту, не изменяется. К
таким кислотам относятся разбавленная серная и галогеноводородные кислоты любой концентрации, кроме фтороводородной (слабая кислота).
С водой магний реагирует только при нагревании:
Mg(т) + 2H2O(гор) = Mg(OH)2(т) + H2(г)
Mg + 2H2O – 2ē = Mg(OH)2 + 2H+ 2H2O + 2ē = H2 + 2OH−
По имеющимся справочным данным для щелочной среды, Δφo = φo(H2O/H2) – φo[Mg(OH)2/Mg] = −0,828 – (−2,689) = =1,861В. Но,
11
www.mitht.ru/e-library

согласно уравнению реакции, под стандартными условиями здесь следует понимать to = 25оC, p(H2) = 1атм, pH = 7. Допустимо ли в этих условиях пользоваться рассчитанной величиной потенциала? Поскольку
ни гидроксид-ионы, ни ионы оксония участия в реакции не принимают, Δφo не зависит от pH раствора. Следовательно, Δφo(нейтр.среды) =
Δφo(щел.среды) = 1,861В.
Однако, несмотря на высокое значение Δφo, магний практически
не реагирует с водой при комнатной температуре. Причина в том, что он всегда покрыт с поверхности пленкой оксида магния, который при контакте с водой переходит в малорастворимый гидроксид. Низкая скорость диффузии молекул воды через слой Mg(OH)2 при комнатной
температуре и объясняет низкую скорость реакции взаимодействия с
водой. При нагревании диффузия молекул воды усиливается, а пленка
Mg(OH)2 становится тоньше из-за повышения растворимости гидроксида
магния. Растворению гидроксида способствует также усиление автопротолиза воды при повышении температуры с образованием ионов оксония и гидроксид-ионов. Кроме того, образующиеся пузырьки водорода, а также непосредственно тепловое расширение металлического магния разрывают поверхностную пленку, обнажая поверхность металла. (Надо заметить, что величина Δφo при повышении
температуры изменяется незначительно.)
По завершении процесса величина pH образовавшегося насыщенного раствора гидроксида магния отвечает фазовому
равновесию |
|
Mg(OH)2(т) ↔ Mg2+ + 2OH−; |
ПР = 6,8×10−12 |
pH(25oC) = 14 + lg3 2ПР 14 lg3
2ПР 14 lg3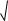 2 6,8 10 12 10,3.
2 6,8 10 12 10,3.
17.2.2. ОКСИДЫ, БИНАРНЫЕ СОЕДИНЕНИЯ
При сгорании магния на воздухе протекают два независимых процесса, которым соответствуют два уравнения реакций:
2Mg + O2 = 2MgO; 3Mg + N2 = Mg3N2
Спёк белого цвета состоит из оксида и нитрида магния; возможна примесь непрореагировавшего металлического магния.
Спек реагирует с водой:
12
www.mitht.ru/e-library

Mg3N2(т) + 8H2O = 3Mg(OH)2(т) + 2NH3·H2O (реакция необратимого
гидролиза бинарного соединения). Полученный раствор имеет
щелочную среду, обусловленную следующими равновесиями:
Mg(OH)2(т) ↔ Mg2+ + 2OH−
NH3·H2O + H2O ↔ NH4+ + OH− + H2O
Оксид и нитрид магния растворяются в кислотах:
MgO(т) + 2H3O+ = Mg2+ + 3H2O
Mg3N2(т) + 8H3O+ = 3Mg2+ + 2NH4+ + 8H2O
С растворами щелочей оксид и гидроксид магния не реагируют, а
нитрид магния в щелочных растворах вступает с водой в реакцию
необратимого гидролиза. Опыт проводится при нагревании.
Mg3N2(т) + 6H2O = 3Mg(OH)2(т) + 2NH3(г)
(NaOH, нагревание).
Гидроксид натрия не участвует в реакциях, но влияет на растворимость аммиака. В воде растворимость аммиака очень высока:
при 20oC ω(NH3) = 34,5%. В присутствии гидроксидов щелочных элементов, а также их солей растворимость аммиака и многих других газов в воде сильно снижается (так называемый "эффект высаливания").
Поэтому при обработке спека щелочными растворами наблюдается выделение газообразного аммиака. Выделению NH3 способствует и нагревание реакционной смеси; при нагревании растворимость NH3 в
воде понижается, так как растворение газов – экзотермический процесс;при 80oC ω(NH3) = 13,3%.
MgO взаимодействует с кислотой и не взаимодействует с раствором щелочи. Cледовательно, это основный оксид.
17.2.3. ГИДРОКСИДЫ
Гидроксид бериллия взаимодействует как с кислотой, так и с раствором щелочи – он относится к амфотерным гидроксидам. Mg(OH)2, как и MgO,- основный.
Для объяснения механизма растворения гидроксидов бериллия и
магния в кислотах следует рассмотреть смещение фазовых равновесий
M(OH)2(т) ↔ M2+ + 2OH−,
где M – бериллий или магний, под влиянием ионов оксония. Последние
13
www.mitht.ru/e-library
реагируют с гидроксид-ионами в насыщенном растворе: H3O+ + OH− ↔
2H2O, понижая концентрацию гидроксид-ионов. Согласно принципу Ле Шателье, фазовое равновесие смещается вправо, масса осадка
уменьшается, и при достаточном количестве кислоты весь осадок растворится. При этом выполняется условие растворения осадков:
C(M2+)×C2(OH−) < ПР[Mg(OH)2] (концентрация OH− понижается при взаимодействии с H3O+).
Растворение гидроксида бериллия в щелочных растворах связано со способностью бериллия к образованию гидроксокомплексов. В
избытке щелочи гидроксид-ионы связывают катионы Be2+ в
гидроксокомплексы [Be(OH)4)]2−, понижая концентрацию Be2+ в растворе;
C(Be2+)×C2(OH−) < ПР[Be(OH)2]; фазовое равновесие сместится вправо,
масса осадка уменьшится, а при достаточном количестве гидроксид-
ионов весь осадок растворится.
Амфотерность Be(OH)2 является причиной того, что даже при небольшом избытке щелочи часть гидроксида перейдет в раствор в форме гидроксокомплекса, и полного осаждения не будет. Для полного
(количественного) осаждения гидроксида бериллия рекомендуется использовать слабое основание – гидрат аммиака; в растворе аммиака гидроксид-ионов недостаточно для образования гидроксокомплексов.
Гидроксид магния растворяется в растворах солей аммония,
создающих в растворе кислую среду в результате гидролиза:
NH4CI = NH4+ + CI−
NH4+ + 2H2O ↔ H3O+ + NH3·H2O
Рассчитаем константу равновесия KC для реакции растворения гидроксида магния:
Mg(OH)2(т) +2NH4CI ↔ MgCI2 + 2NH3·H2O
Mg(OH)2(т) + 2NH4+ ↔ Mg2+ + 2NH3·H2O
Mg2 NH3 H2O 2 |
|
|
|
|
|||
KC |
|
NH4 2 |
(1) |
|
|
|
|
|
|
|
|
|
|
|
|
|
2+ |
− 2 |
следует, что Mg |
2 |
|
ПР |
|
Из ПР[Mg(OH)2] = [Mg |
|
][OH ] |
|
|
(2) |
||
|
|
OH 2 |
|||||
14
www.mitht.ru/e-library

|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH3 H2O H3O |
|
|
Из |
KK (NH4 |
/NH3H |
2O) |
|
NH4 |
получаем |
||||||||
|
|
NH3 H2O |
|
KK |
|
|
|
|
(3) |
|
|
||||
|
|
|
H3O |
|
|
|
|
||||||||
|
|
|
NH4 |
|
|
|
|
|
|||||||
После подстановки (2) и (3) в уравнение (1) получаем |
|
||||||||||||||
KC |
|
ПР KK2 |
|
ПР KK2 |
|
6,8 10 12 (5,75 10 10 )2 |
0,02. |
||||||||
OH 2 H3O 2 |
|
|
KB2 |
|
|
(10 14 )2 |
|||||||||
Хотя Кс < 1, при избытке иона аммония растворение происходит.
Например, можно показать, что в одном литре 1М раствора
хлорида аммония растворяется 0,17моль Mg(OH)2 и получается
0,17М раствор хлорида магния.
По стехиометрии реакции растворения Mg(OH)2
[NH3·H2O] = 2[Mg2+]; тогда
Mg2 2 Mg2 2 |
|
|
4 Mg2 3 |
|
|
|
||||
KC |
|
|
|
|
|
|
|
|
|
|
NH4 2 |
|
NH4 2 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
Mg2 3 |
KC NH4 2 |
|
|
|
|
|
|
|
||
|
3 |
|
0,02 12 |
|
|
0,17моль/л |
||||
4 |
4 |
|
||||||||
|
|
|
|
|
|
|
|
|||
Для гидроксида бериллия константа равновесия реакции его растворения в растворе хлорида аммония:
|
|
ПР(Be(OH) |
2 |
) K2 |
8,0 10 |
22 (5,75 10 |
10 )2 |
||
KC |
|
|
K |
|
|
|
|
2,64 10 14 |
|
KB2 |
|
|
|
(10 14 )2 |
|
||||
|
|
|
|
|
|
|
|
||
Константа столь мала, что даже в насыщенном растворе хлорида
аммония Be(OH)2 практически не растворяется.
Причина различного отношения гидроксидов бериллия и магния к
растворам солей аммония – в различии величин их ПР.
17.2.4. ГИДРОЛИЗ СОЛЕЙ
Катионы бериллия и магния, как и все прочие катионы металлов,
находятся в водных растворах в форме аквакомплексов. Аквакатионы бериллия и магния проявляют свойства слабых катионных кислот:
[Be(H2O)4]2+ + H2O ↔ [Be(H2O)3OH]+ + H3O+; Kк= 2,0×10−6 [Mg(H2O)6]2+ + H2O ↔ [Mg(H2O)5OH]+ + H3O+; Kк= 3,8×10−12
Продукты протолиза – катионы гидроксотриаквабериллия и
15
www.mitht.ru/e-library
гидроксопентааквамагния. Более сильной кислотой является протолит с
более высокой константой кислотности.
17.3. ЭЛЕМЕНТЫ IIА-ГРУППЫ (ЩЕЛОЧНОЗЕМЕЛЬНЫЕ
ЭЛЕМЕНТЫ)
17.3.1. ПРОСТЫЕ ВЕЩЕСТВА
Щелочноземельные металлы – сильнейшие восстановители.
Таблица 17.2.
Стандартные окислительно-восстановительные потенциалы для элементов IIA-группы
Элемент |
Be |
Mg |
Ca |
Sr |
Ba |
Ra |
|
|
|
|
|
|
|
φo(M2+/M), В |
-1,847 |
-2,370 |
-2,864 |
-2,888 |
-2,905 |
-2,916 |
|
|
|
|
|
|
|
Щелочноземельные металлы энергично взаимодействуют с водой,
как и щелочные металлы (см. раздел 17.1.1.); Be и Mg гораздо менее
активны (см. раздел 17.2.1.).
17.3.2. ГИДРОКСИДЫ
Гидроксиды щелочноземельных элементов растворимы в воде,
однако их растворимость значительно ниже, чем у гидроксидов щелочных элементов.
Таблица 17.3.
Растворимость гидроксидов щелочноземельных элементов в воде
Гидроксид |
ПР (25oC) |
Растворимость, моль/л (25оС) |
|
|
|
Ca(OH)2 |
6,3×10−6 |
1,15×10−2 |
|
|
|
Sr(OH)2 |
3,2×10−4 |
4,30×10−2 |
|
|
|
Ba(OH)2 |
* |
≈0,25 |
|
|
|
*ПР не используется, так как насыщенный раствор гидроксида
бария нельзя считать разбавленным, концентрация Ba(OH)2 выше
0,1моль/л.
16
www.mitht.ru/e-library

Растворимость возрастает в ряду Ca(OH)2 – Sr(OH)2 – Ba(OH)2.
Иногда при добавлении щелочей к растворам солей бария (или при добавлении разбавленного раствора щелочи к раствору соли
стронция) могут наблюдаться осадки (помутнение растворов). Это не гидроксиды, а малорастворимые карбонаты стронция и бария; они
образуются, если в растворе есть примесь карбонат-ионов. Последнее вполне вероятно, так как растворы щелочей легко поглощают
углекислый газ из воздуха: CO2 + 2NaOH = Na2CO3 + H2O.
17.3.3. ОКРАШИВАНИЕ ПЛАМЕНИ
Кальций – коричнево-красное, стронций – яркокрасное, барий –
желто-зеленое.
17.3.4.МАЛОРАСТВОРИМЫЕ СОЛИ
Вотличие от солей щелочных элементов, многие соли
щелочноземельных элементов малорастворимы: карбонаты, сульфаты,
ортофосфаты, фториды и другие.
Таблица 17.4.
Зависимость ПР сульфатов щелочноземельных элементов от порядкового номера элемента Z
Элемент |
Z |
ПР(25oC) |
|
|
|
Ca |
20 |
3,7×10−5 |
|
|
|
Sr |
38 |
2,1·×10−7 |
|
|
|
Ba |
56 |
1,8×10−10 |
|
|
|
Ra |
88 |
4,3×10−11 |
|
|
|
.Рассчитаем, выпадет ли осадок карбоната кальция из
насыщенного раствора сульфата кальция, если к нему добавить равный объем 0,1М раствора карбоната натрия;
ПР(СаSO4) = 3,7×10−5; ПР(CaCO3) = 4,4×10−9
В насыщенном растворе сульфата кальция
Сa2 |
|
|
|
|
|
|
3,7 10 5 |
6,1 10 3 моль/л |
|
ПР(CaSO4 ) |
17
www.mitht.ru/e-library

Условие выпадения в осадок CaCO3 выполняется:
C(Ca2 ) C(CO32 ) |
|
|
|
|
|
|
|
|
||||
Ca2 |
|
C(Na |
2CO3 ) |
|
6,1 10 3 |
0,1 |
|
4 |
|
|||
|
|
|
|
|
|
|
|
|
|
1,5 10 |
|
ПР(CaCO3 ) |
2 |
|
2 |
|
|
|
|
||||||
|
|
|
2 |
2 |
|
|
|
|
||||
Выпадет ли осадок CaSO4 из насыщенного раствора карбоната
кальция, если добавить к нему равный объем 0,1М раствора Na2SO4?
В насыщенном растворе карбоната кальция
|
[Ca2+] = |
ПР(CaCO3 ) |
= |
4,4 10 9 = 6,6·10−5моль/л. |
||||||
|
Условие |
выпадения |
|
в |
осадок |
CaSO4 не выполняется: |
||||
C(Ca2 ) C(SO42) ) |
|
|
|
|
||||||
Ca2 |
C(Na2SO4 ) |
|
6,6 10 5 |
|
0,1 |
1,65 10 6 |
ПР(CaSO4 ) |
|||
|
|
|
||||||||
2 |
2 |
2 |
|
2 |
|
|
||||
Следовательно, добавляя в насыщенный раствор карбоната
кальция сульфат-ион, нельзя добиться выпадения осадка сульфата кальция.
Таблица 17.5.
Растворимость хроматов щелочноземельных металлов в воде
Хромат |
ПР (25oC) |
Растворимость, г/100г H2O |
|
|
|
СaCrO4 |
─ |
13,2 (20oC) |
|
|
|
SrCrO4 |
2,7×10−5 |
0,09 (25oC) |
|
|
|
BaCrO4 |
1,1×10−10 |
0,027 (25оС) |
|
|
|
Причиной растворения хроматов стронция и бария в растворах сильных кислот и хромата стронция – в растворе уксусной кислоты
является превращение хромат–ионов в дихромат-ионы в кислой среде:
2CrO42− + 2H3O+ ↔ Cr2O72− + 3H2O (1)
K Cr2O72
C CrO24 2 H3O 2
При добавлении уксусной кислоты фазовое равновесие
SrCrO4(т) ↔ Sr2+ + CrO42−
смещается вправо, так как концентрация хромат-ионов понижается
(CrO42−→ Cr2O72−); C(Sr2+)×C(CrO42−) становится меньше ПР(SrCrO4). В
результате масса осадка уменьшается, в растворе повышается
концентрация ионов Sr2+ и Cr2O72−; при достаточном количестве уксусной
18
www.mitht.ru/e-library
кислоты весь осадок растворится:
2SrCrO4(т) + 2CH3COOH = 2Sr2+ + 2CH3COO− + Cr2O72− + H2O 2SrCrO4(т) + 2CH3COOH = Sr(CH3COO)2 + SrCr2O7 + H2O
Если после растворения хромата стронция концентрация катиона
Sr2+ в полученном растворе достигнет, к примеру, 0,1моль/л, то
концентрация хромат-иона в этом растворе будет определяться неравенством
CrO42 2,7 10 4 моль/л |
ПР(SrCrO |
4 |
) |
|
2,7 10 5 |
|
Sr2 |
|
|
|
. |
||
|
0,1 |
|||||
Чтобы таким же образом растворить BaCrO4 и получить
0,1М раствор катиона бария, нужно выполнить условие
СrO42 1,1 10 9 моль/л |
ПР(BaCrO |
4 |
) |
|
1,1 10 10 |
|
Ba2 |
|
|
|
. |
||
|
0,1 |
|||||
Достигнуть при помощи слабой уксусной кислоты столь сильного смещения равновесия (1) вправо и столь значительного понижения концентрации CrO42− в растворе не удается. В то же время добавление сильной кислоты приводит к полному растворению хромата бария:
2BaCrO4(т) + 2HCI = BaCI2 + BaCr2O7 + H2O
Разделение катионов Sr2+ и Ba2+ при их совместном присутствии в
растворе основано на различном отношении их хроматов к уксусной
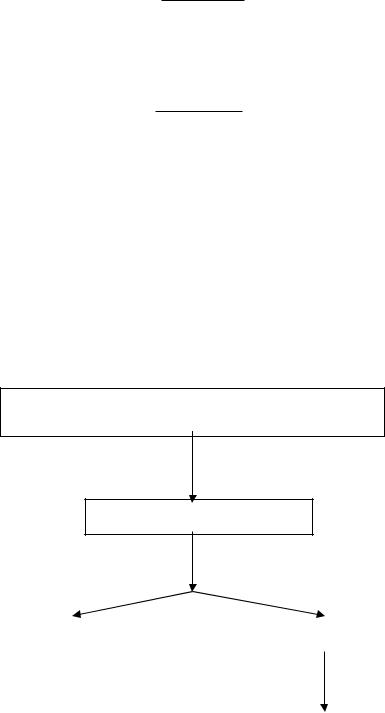
кислоте. Алгоритм разделения катионов Sr2+ и Ba2+:
Раствор, содержащий катионы Sr2+ и Ba2+
(раствор солей – хлоридов, нитратов и других)
Добавление раствора K2CrO4
Осадок (SrCrO4 + BaCrO4)
|
Добавление CH3COOH |
||||
|
Фильтрование |
||||
|
|
|
|
|
|
Раствор Sr2+ |
|
Осадок BaCrO4 |
|
||
|
|
|
|
|
|
|
|
|
Добавление |
||
|
|
|
сильной кислоты |
||
|
|
|
|
|
|
|
|
|
Раствор Ba2+ |
|
|
|
|
|
|
|
|
19
www.mitht.ru/e-library
18. ЛАБОРАТОРНАЯ РАБОТА
"ХИМИЯ ЭЛЕМЕНТОВ VIIА-ГРУППЫ"
18.1. ПРОСТЫЕ ВЕЩЕСТВА
18.1.1. ПОЛУЧЕНИЕ ПРОСТЫХ ВЕЩЕСТВ
Общее для реакций получения галогенов: окисляют
соответствующие галогениды щелочных элементов или галогеноводороды сильными окислителями (KMnO4, MnO2, K2Cr2O7) в
сильнокислой среде. Для этого используют концентрированные растворы галогеноводородов или добавляют концентрированную H2SO4.
Стандартные значения Δφо для этих реакций, как правило, близки к
нулю. Исключение – реакции получения дииода.
Таблица 18.1.
Стандартные значения Δφо для реакций получения дигалогенов
№ |
Окислитель (оф/вф) |
Восстановитель (оф/вф) |
Δφо реакции, В |
|
|
|
|
1 |
MnO4−/Mn2+ |
CI2/CI− |
0.173 |
|
|
|
|
2 |
Cr2O72−/Cr3+ |
CI2/CI− |
−0,025 |
|
|
|
|
3 |
MnO2/Mn2+ |
CI2/CI− |
−0.119 |
|
|
|
|
4 |
MnO2/Mn2+ |
Br2/Br− |
0.152 |
|
|
|
|
5 |
MnO2/Mn2+ |
I2/I− |
0,704 |
|
|
|
|
Приведенные значения Δφо определяют направление ОВР в стандартных условиях.
Очень важно правильно понимать, чему соответствуют
стандартные условия для данной реакции. Так, для реакции
2MnO4− + 16H+ + 10CI− = 5CI2(г) + 2Mn2+ + 8H2O
стандартные условия означают: C(MnO4−) = C(CI−) = C( Mn2+) = C(H+) =
1моль/л; p(CI2) = 1атм, T = const. В стандартных условиях температура может быть любой, но в таблицах приведены значения φо(298oC).
Если Δφо > 0, то в стандартных условиях реакция протекает в прямом направлении (слева направо); если Δφо < 0 – в обратном направлении (справа налево). Часто говорят о самопроизвольном протекании реакции в том или другом направлении, но при этом надо
20
www.mitht.ru/e-library
