
Федеральное агентство по образованию Российской федерации
Владимирский государственный университет
Кафедра химии.
Лабораторная работа №14.
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ.
Выполнил:
Студент гр. Хб-109
Леденёв С.А.
Проверил:
Проф. Орлин Н.А
Владимир 2010.
Теоретическая часть.
Коррозией называют самопроизвольное разрушение металлов и сплавов под действием окружающей среды. Среда, в которой происходит разрушение, называется коррозийной. Химические соединения, образующиеся в результате коррозии, называют продуктами коррозии.
Так как самопроизвольно протекающий процесс коррозии сопровождается выделением энергии, он приводит к росту энтропии системы. Следовательно, коррозия – необратимый процесс. Причиной коррозии является термодинамическая неустойчивость металла в окружающей среде. В природе металлы находятся в окисленном состоянии. Получение металлов происходит с затратой энергии. Энергия, затраченная на получение металлов, накапливается в них в виде свободной энергии Гиббса и делает их химически активными. При коррозии энергия Гиббса высвобождается, т. е. процесс окисления металлов характеризуется уменьшением ΔG.
По механизму взаимодействия металла со средой различают следующие виды коррозии:
Химическая коррозия – разрушение металлов в результате действия на них окислителей (без участия электролитов).
Электрохимическая коррозия – разрушение металлов в результате действия микрогальванопар в среде электролита. При контакте двух металлов с разными потенциалами, а также в металлах с примесями, возникают среди электролита гальванопары, в которых анодные участки (металл с более отрицательным потенциалом) окисляются – разрушаются, а на катодных участках происходит восстановление Н2 или О2.
Восстановление Н2 или О2 на катодном участке возможно по следующим четырем реакциям:
Среда нейтральная или щелочная:
1) О2 + 2Н2О + 4е = 4ОН- 2) 2Н2О + 2е = Н2 + 2ОН-
Среда кислая:
3) О2 + 4Н+ + 4е = 2Н2О 4) 2Н+ + 2е = Н2
Для определения катодного процесса необходимо φМе анодного участка сравнить с φН2 и φО2:
Если φА<φН2 на катоде восстанавливается водород по уравнению 2 или 4.
Если φА>φН2, φА<φО2 на катоде восстанавливается кислород по уравнению 1 или3.
Атмосферная коррозия – протекает в результате различного доступа О2 к поверхности металла. Металлическая поверхность в ненастную погоду под действием капель дождя и О2 воздуха, проникающего к поверхности металла, подвергается коррозии.
Электрокоррозия – частный случай электрохимической коррозии, но причиной служат блуждающие токи.
Факторы, влияющие на электрокоррозию:
-
рН среды
-
состояние поверхности металла
-
соотношение количества О2 и Н2О
-
температура (через ΔG)
-
наличие постоянных ионов, которые могут либо активировать, либо замедлить коррозию
Способы защиты металла от коррозии:
-
Нанесение на поверхность металла защитного покрытия
-
Изменение структуры поверхности металла (оксидирование, фосфатирование)
-
Электрозащита
-
Протекторная защита
-
Ингибиторы
Выполнение работы.
Цель работы: изучить электрохимическую коррозию.
Приборы и реактивы. Штатив с пробирками, пластинка стали, кусочки цинка, алюминия, свинца, оцинкованного и луженого железа, медная проволока. Растворы: серной кислоты – 0,2 н., сульфата меди (II) – 0,5 н., хлорида натрия 3 % - ный, уксусной кислоты – 0,5 н., иодида калия – 0,5 н., ферроксилиндикатора, красной кровяной соли – 0,5 н.
Опыт №1.
Коррозия, возникающая при контакте двух различных металлов.
В пробирку было налито 10 капель раствора серной кислоты, затем туда была опущена медная проволока. Пузырьки водорода на поверхности проволоки не выделялись. При опускании в пробирку кусочка цинка наблюдалось довольно сильное его окисление с выделением водорода, который образовывался в виде пузырьков на поверхности цинка. При касании цинка медной проволокой скорость образования пузырьков водорода заметно увеличивается (т.к. образуется гальванопара и цинк окисляется еще активнее). Также пузырьки водорода образуются и на поверхности проволоки (т.к. в образовавшейся гальванопаре она является катодом)
-
ZnO + H2SO4 = ZnSO4 + H2O
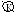

Zn / H2SO4 / ZnО
А: Zn – 2e = Zn2+
К: 2Н+ + 2е = Н2
2)Zn + Н2SO4 = ZnSO4 + Н2
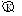

Zn / H2SO4 / Cu
А: Zn – 2е = Zn2+
K: 2H+ + 2e = H2
Опыт № 2.
Образование микрогальванопар.
В пробирку с серной кислотой был помещен кусочек цинка. Наблюдалось окисление цинка с выделением водорода. Потом в пробирку был добавлен раствор сульфата меди. Скорость выделения водорода увеличилась, на поверхности цинка восстанавливается медь.
Zn + H2SO4 = ZnSO4 + H2
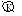

Zn / H2SO4 / H2
Z
 n
+ CuSO4
= Cu + ZnSO4
n
+ CuSO4
= Cu + ZnSO4
Zn / H2SO4 / Cu
А: Zn + H2SO4 = ZnSO4 + H2
K: 2H2O + 2e = H2 + 2OH-
Опыт №3.
Активирующее действие ионов хлора на коррозию.
Поместили в две пробирки по кусочку алюминия и по 10 капель 0.5 н. раствора сульфата меди и по 3 капли 0.2 н. раствора серной кислоты. В одну из пробирок добавили 3 капли 3%-ного раствора хлорида натрия.
1 пробирка: Al+CuSO4+H2SO4+NaCl
2 пробирка: Al+CuSO4+H2SO4
Наблюдали контактное выделение меди на поверхности алюминия в виде черноватого налета и в следствии этого обесцвечивание раствора.
2Al+3CuSO4=Al2(SO4)3+3Cu

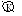
Al│H2SO4│Al2O3
Также наблюдаем образование пузырьков водорода.
A: Al-3e=Al3+ K: 2H++2e=H2, Cu2++2e=Cu
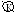
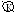
Al│H2SO4, NaCl│CuSO4
Ионы, разрушающие защитные пленки металлов и тем самым способствующие коррозии, называют активаторами коррозии. В данном опыте активатором коррозии является ион хлора. Из этого следует, что в первой пробирке процессы протекают интенсивнее, т.к. присутствуют ионы хлора.
Опыт№4.
Коррозия в результате различного доступа кислорода к поверхности металла(атмосферная коррозия).
Очистили стальную пластину наждачной бумагой. На чистую поверхность нанесли каплю специального реактива – ферроксилиндикатора (состоящий из фенолфталеина ( индикатор на гидроксильные ионы) и красной кровяной соли (индикатор на ионы двухвалентного железа – синее окрашивание)). Через 10 минут наблюдали появление синей окраски (свидетельствует о наличии Fe2+) в центре капли и розовой (свидетельствует о наличии OH-) по окружности.
F
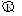 e│H2O,
O2│FeO
e│H2O,
O2│FeO
A: Fe-2e=Fe2+
K: O2+H2O+4e=4OH-
Из-за различного доступа кислорода к поверхности металла возникают участки с различными потенциалами, т.е. образуется гальванопара. Катодные участки с наиболее положительным потенциалом возникают возле краев капли, куда легче проникает кислород. Анодные участки с наиболее отрицательным потенциалом возникают в центре капли, защищенные каплей электролита.
Fe2++2OH-=Fe(OH)2
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe(OH)3=FeO(OH)+H2O
Опыт№5.
Анодные и катодные покрытия.
Налить в пробирки по 10-15 капель 3 %-ного раствора хлорида натрия и по 1-2 капли 0,5 М раствора K3[Fe(CN6)] – красная кровяная соль. Поместить в одну пробирку кусочек оцинкованного, в другую – луженого железа.
При коррозии оцинкованного железа – коррозии подвергается покрытия.
Реакция на аноде. Реакция на катоде.
Zn-2e=Zn2+
2H2O+2e=H2+2OH-


Fe | K2 [Fe(CN)6] | Zn
При коррозии лужённого железа – коррозии подвергается железо.
Реакция на аноде. Реакция на катоде.
Fe-2e=Fe2+ 2H2O+2e=H2+2OH-

 Sn
| K2
[Fe(CN)6]
| Fе
Sn
| K2
[Fe(CN)6]
| Fе
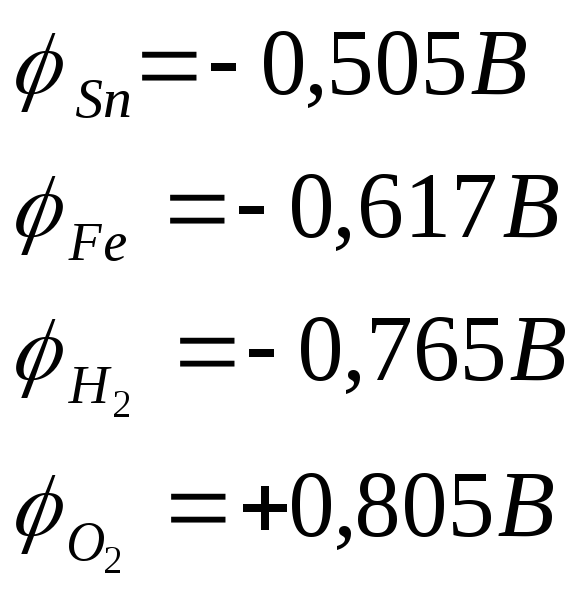
3Fe(OH)2 +
2![]() = Fe3
= Fe3
![]() + 6KOH
+ 6KOH
Опыт № 6.
Протекторная защита.
В две пробирки по налили по 10-15 капель раствора уксусной кислоты и по 2-3 капли 0,5н.раствора иодида калия. В одну пробирку поместили кусочек свинца, а в другую – кусочек свинца в контакте с кусочком цинка. Желтая окраска быстрее появляется в первой пробирке.
1) PbO + 2CH3COOH = (CH3COO)2Pb + H2O
Pb| CH3COOH | PbO
А: Pb – 2е = Pb2+
К: 2H+ + 2e = H2
Pb + 2CH3COOH = (CH3COO)2Pb + H2
Pb | CH3COOH | Zn
А: Zn – 2e = Zn2+
К: 2Н+ + 2е = Н2
Кусочек цинка, находящейся в контакте со свинцом, предотвращающего коррозию свинца вследствие того, что цинк имеет более отрицательный потенциал в отличие от свинца, и поэтому на аноде будет окисляться цинк.
Вывод: мы изучили электрохимическую коррозию.
