
Laby_po_Khimii / Определение эквивалентных масс(Струнина)
.docМинистерство образования Российской Федерации
Владимирский государственный университет
Кафедра химии и экологии
Лабораторная работа № 2
Определение эквивалентных масс
металла
Выполнила студентка группы ВВ – 108
Хроменкова К.А.
Приняла
Кузурман В.А.
Владимир 2005
План
-
Цель работы.
-
Краткое теоретическое введение.
-
Приборы и реактивы.
-
Ход выполнения работы.
-
Таблица экспериментальных данных.
-
Расчеты.
-
Выводы.
-
Цель работы
Научиться определять эквивалентную массу металла по объему вытесненного водорода.
-
Краткое теоретическое введение.
Эквивалент – реальная или условная частицу вещества, которая может замещать, присоединять, высвобождать один ион водорода в кислотно-основных или ионообменных реакциях или один электрон в окислительно-восстановительных процессах. Количество эквивалентов вещества обозначают nэ.
Масса одного моля эквивалентов называется молярной массой эквивалента (эквивалентной массой), обозначается Мэ и измеряется в граммах на моль (г/моль):
Мэ=m/nэ
В общем случает эквивалентная масса (Мэ) определяется отношением молярной массы(М) к фактору эквивалентности(fэкв):
Мэ=М*fэкв
Закон эквивалентов: вещества в химических реакциях взаимодействуют друг с другом в эквивалентных количествах. Математически закон эквивалентов выражается следующим образом:
m1 m2
=

Mэ1 Mэ2
-
Приборы и реактивы:
Прибор для определения эквивалентных масс, штатив, бюретки, резиновые трубки, металл(Mg, Zn или Fe), соляная кислота(16%).
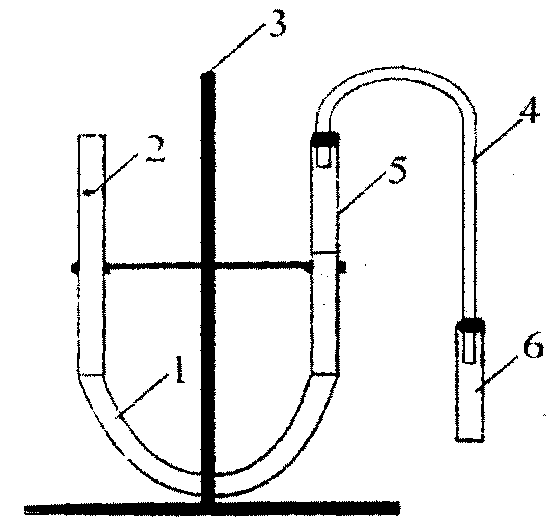
-
Ход выполнения работы.
Собрали установку: на штативе укрепили две бюретки (2 и 5) с делениями, соединенные между собой резиновой трубкой 1. Бюретки были наполовину заполнены водой. К одной бюретке (5) герметично подсоединена через резиновую трубку реакционная пробирка 6.
Взяли навеску металла и положили ее в реакционную пробирку 6. В вытяжном шкафу отмерили 4 мл 16%-ной соляной кислоты. Кислоту перелили в реакционную пробирку 6. Металл начал реагировать с кислотой. Выделившийся водород по резиновой трубке 4 попал в бюретку 5 и вытеснил воду. Уровень воды в этой бюретке понизился.
После прекращения реакции добились совпадения уровня воды в обеих бюретках. По положению нижнего мениска воды внутри бюретки 5 определили объем выделившегося водорода.
-
Таблица экспериментальных данных.
|
Параметры |
Обозначение |
Ед. измерения |
Результат |
|
Масса металла |
mMe |
г |
0,112 |
|
Объем выделившегося водорода |
V |
мл |
39,6 |
|
Температура |
t |
°С |
18=291К |
|
Атмосферное давление |
P |
мм рт. ст. |
744 |
|
Давление насыщенного водяного пара при температуре опыта |
PH2O |
мм рт. ст. |
18,7 |
-
Расчеты.
а) приводим объем водорода к значению объема при нормальных условиях. По объединенному газовому закону
P![]() * V
P0
* V0
* V
P0
* V0


T T0
В данном уравнении вместо Р берем парциальное давление водорода РН2.
РН2 = Р – РН2О
РН2= 744 мм рт.ст. – 18,7 мм рт.ст. = 725,3 мм рт.ст.
760 мм рт.ст. * V0 мл 725,3 мм рт.ст. * 39,6 мл

 =
=
273 К 294 К
V0 = 35,1 мл
б) По закону эквивалентов определяем экспериментальное значение эквивалентной массы металла
МЭме = mМе * 11200 / V0
МЭме = 0,112 * 11200/ 35,1 = 35,7
в) Зная, что для эксперимента был взят двухвалентный металл, рассчитываем атомную массу:
АМЕэкс = МЭМЕэкс * В
АМЕэкс = 71,4
г) Взять из таблицы точно значение атомной массы металла АМEтеор. Рассчитать относительную погрешность опыта η
η=[ (АМEтеор - АМЕэкc) / АМEтеор ] * 100%
η= ((65,37 – 71,4)/65,37)*100%=9,4%
в) Zn + 2HCl = ZnCl2 + H2
-
Выводы.
В результате опыта было установлено, что использовался Цинк(Zn). Погрешность определения массы составила 9%. Это может быть связано с потерей части довески, а также тем, что точность определения объема выделившегося водорода составляет лишь десятые доли миллилитра.
