
Laby_po_Khimii / Определение эквивалентной массы металла
.docМинистерство образования Российской Федерации
Владимирский государственный университет
Кафедра химии и экологии
Лабораторная работа № 3
Определение эквивалентной массы металла.
Выполнил студент группы МТС – 104
Сазонова Е.В.
Приняла
Гришина Е.П.
Владимир 2005
План
-
Цель работы.
-
Краткое теоретическое введение.
-
Приборы и реактивы.
-
Ход выполнения работы.
-
Таблица экспериментальных данных.
-
Расчеты.
-
Выводы.
-
Цель работы
Определение эквивалентной массы металла.
-
Краткое теоретическое введение.
Эквивалентом называют реальную или условную частицу вещества, которая может замещать, присоединять, высвобождать один ион водорода в кислотно-основных или ионообменных реакциях или один электрон в окислительно-восстановительных процессах. Количество эквивалентов вещества обозначают nэ.
Масса одного моля эквивалентов называется молярной массой эквивалента (эквивалентной массой), обозначается Мэ и измеряется в граммах на моль (г/моль):
Мэ=m/nэ
В общем случает эквивалентная масса (Мэ) определяется отношением молярной массы(М) к фактору эквивалентности(fэкв):
Мэ=М*fэкв
Для газообразных веществ существует также и молярный объем эквивалента (эквивалентный объём) Vэ, который определяется как отношение молярного объёма газа Vm к фактору эквивалентности вещества:
Vэ=Vm*fэкв
Физический смысл эквивалентного объёма заключается в том, что он показывает объём, занимаемый одним молем эквивалентов газообразного вещества.
Фактор эквивалентности веществ зависит от характера реакции, в которой данного вещество принимает участие.
Фактор эквивалентности сложных соединений определяется следующим образом:
а) фактор эквивалентности кислоты определяется её основностью, т.е. числом атомов водорода в молекуле кислоты.
б) фактор эквивалентности основания определяется валентностью металла, образующего основание, или числом гидроксогрупп.
в) фактор эквивалентности соли определяется произведение валентности металла на число его атомов в молекуле.
Закон эквивалентов: вещества в химических реакциях взаимодействуют друг с другом в эквивалентных количествах. Математически закон эквивалентов выражается следующим образом:
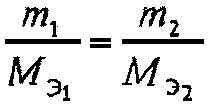
-
Приборы и реактивы:
У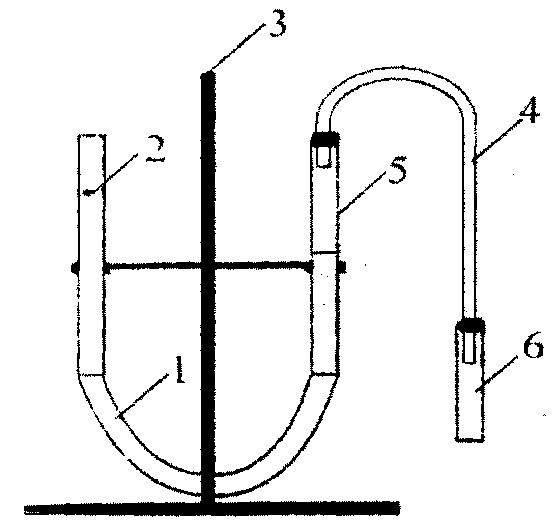 становка.
становка.
Металл (Fe, Zn или Mg).
Соляная кислоты (16%).
-
Ход выполнения работы.
На штативе 3 укрепить две стеклянные трубки с делениями (бюретки) 2 и 5, соединенные между собой резиновой трубкой 1.
Бюретки заполнить наполовину водой. К бюретке 5 подсоединить через резиновую трубку 4 реакционную пробирку 6. Проверить герметичность прибора. Для этого приподнять вверх бюретку 2. Вода в обеих бюретках должны держаться на полученных уровнях.
Получить у лаборанта навеску металла. Отмерить в вытяжном шкафу 4 мл 16%-ной соляной кислоты при помощи цилиндра и кислоту перенести в реакционную пробирку 6.
Приподнять бюретку 2 и установить уровень воды в бюретке 5 на нулевой отметке. Открыть реакционную пробирку 6, опустить в нее полученный металл и быстро закрыть пробирку 6 пробкой. Попав в кислоту, металл начинает с ней реагировать. Выделившийся водород по резиновой трубке 4 попадет в бюретку 5 и вытеснит воду. Уровень воды в бюретке 5 понижается. По объему вытесненной воды судят об объеме выделившегося водорода.
После прекращения реакции добиться совпадения уровня воды в обеих бюретках, перемещая бюретку 2. Этим создается давление внутри бюретки 5, равное атмосферному давления. По положению нижнего мениска воды в бюретке 5 определяется объем выделившегося водорода.
-
Таблица экспериментальных данных.
|
Параметры |
Обозначение |
Единица измерения |
Результат |
|
Масса металла |
mМе |
г |
0,114 |
|
Объем выделившегося водорода |
V |
Мл |
43,2 |
|
Температура |
t |
0C |
21 |
|
Атмосферное давление |
Р |
мм рт.ст. |
744 |
|
Давление насыщенного водяного пара при температуре воды |
РН2О |
мм рт.ст. |
18,7 |
-
Расчеты.
а) перевести объем водорода к значению объема при нормальных условиях. По объединенному газовому закону
P![]() * V
P0
* V0
* V
P0
* V0


T T0
В данном уравнении вместо Р брать парциальное давление водорода РН2.
РН2 = Р – РН2О
РН2= 744 мм рт.ст. – 18,7 мм рт.ст. = 725,3 мм рт.ст.
732,2 * 273 * (41,4 -3,6)

 V0
=
=33,7
V0
=
=33,7
760 * 295
V0 = 33,7 мл
б) По закону эквивалентов определить экспериментальное значение эквивалентной массы металла
МЭме = mМе * 11200 / V0
МЭме = 0,114 * 11200/ 38,28 = 33,35
в) Зная, что для эксперимента был взят двухвалентный металл, рассчитать атомную массу:
АМЕэкс = МЭМЕэкс * В
АМЕэкс = 66,71
г) Взять из таблицы точно значение атомной массы металла АМEтеор. Рассчитать относительную погрешность опыта η
η=[ (АМEтеор - АМЕэкc) / АМEтеор ] * 100%
η= ((65,37 – 66,71)/65,37)*100%=2,05%
в) Zn + 2HCl = ZnCl2 + H2
-
Выводы.
В результате опыта было установлено что использовался Цинк(Zn). Погрешность определения массы составила 2% это связано с тем, что точность определения объема выделившегося водорода лишь десятые доли миллилитра.
