
- •1. Общая характеристика р-элементов (р-блок).
- •2. Общая характеристика р-элементов iiiа-группы.
- •3. Биологическая роль р-элементов iiiа-группы. Применение их соединений в медицине.
- •4. Общая характеристика р-элементов ivа-группы.
- •5. Биологическая роль р-элементов ivа-группы. Применение их соединений в медицине.
- •6. Общая характеристика р-элементов vа-группы.
- •7. Биологическая роль р-элементов vа-группы. Применение их соединений в медицине.
- •8. Общая характеристика р-элементов viа-группы. Халькогены.
- •9. Биологическая роль р-элемеитов viа-группы. Применение их соединений в медицине.
- •10. Общая характеристика р-элементов viia-группы. Галогены.
- •11. Биологическая роль р-элементов viiа-группы. Применение их соединений в медицине.
р-ЭЛЕМЕНТЫ И ИХ СОЕДИНЕНИЯ
1. Общая характеристика р-элементов (р-блок).
К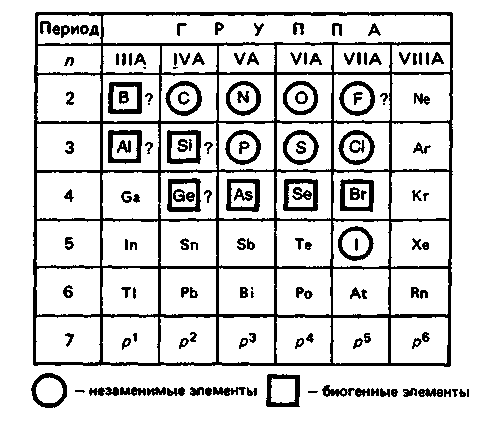 р-блоку относят 30 элементовIIIА—VIIIА-групп
периодической системы. р-Элементы входят
во второй и третий малые периоды, а также
в четвертый — шестой большие периоды.
У элементов IIIА-группы
появляется первый электрон на р-орбитали.
В других группах IVА—VIIIА
происходит последовательное заполнение
р-подуровня до 6 электронов (отсюда
название р-элементы).
р-блоку относят 30 элементовIIIА—VIIIА-групп
периодической системы. р-Элементы входят
во второй и третий малые периоды, а также
в четвертый — шестой большие периоды.
У элементов IIIА-группы
появляется первый электрон на р-орбитали.
В других группах IVА—VIIIА
происходит последовательное заполнение
р-подуровня до 6 электронов (отсюда
название р-элементы).
Строение внешних электронных оболочек атомов элементов р-блока (общая формула пs2npa, где а = 1-6).
В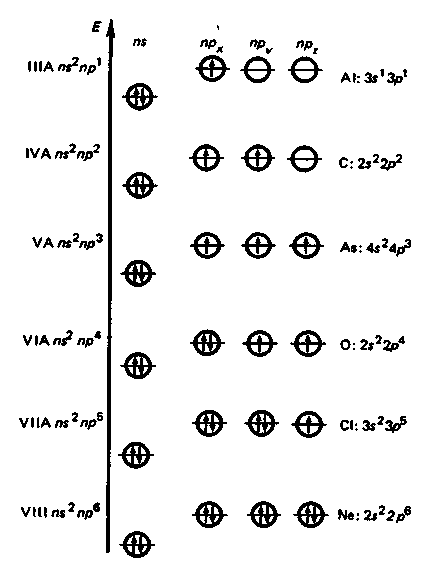 периодах слева направо атомные и ионные
радиусы р-элементов по мере увеличения
заряда ядра уменьшаются, энергия
ионизации и сродство к электрону в целом
возрастают, электроотрицательность
увеличивается, окислительная активность
элементных веществ и неметаллические
свойства усиливаются.
периодах слева направо атомные и ионные
радиусы р-элементов по мере увеличения
заряда ядра уменьшаются, энергия
ионизации и сродство к электрону в целом
возрастают, электроотрицательность
увеличивается, окислительная активность
элементных веществ и неметаллические
свойства усиливаются.
В группах радиусы атомов и однотипных ионов, в общем, увеличиваются. Энергия ионизации при переходе от 2р-элементов к 6р-элементам уменьшается, так как по мере возрастания числа электронных оболочек усиливается экранирование заряда ядер электронами, предшествующими внешним электронам.
С увеличением порядкового номера р-элемента в группе неметаллические свойства ослабевают, а металлические усиливаются.
На свойства р-элементов и их соединений оказывает влияние как появление новых подуровней на внешней электронной оболочке, так и заполнение подуровней внутренних электронных оболочек. р-Элементы второго периода — В, С, N, О, F — резко отличаются от элементов нижеследуюших периодов Так, начиная с р-элементов третьего периода, появляется низколежащий свободный d-подуровень, на который могут переводить электроны с р-подуровня при возбуждении атомов Полностью заполненный 3d-полуронень у d-элементов четвертого периода — Gа, Gе, Аs, Sе, Вr — обусловливает отличие их свойств от элементов третьего периода Максимальное заполнение 4f-подуровня в шестом периоде аналогично сказывается на различии свойств р-элементов шестого и пятого периода.
Вдоль периода у р-элементов падает способность к образованию положительно заряженных ионов с зарядом, отвечающим номеру группы. Наоборот, способность к образованию отрицательных ионов с зарядом, равным разности (8 — № группы), возрастает при движении вдоль периода.
р -Элементы
образуют двухатомные молекулы Э2,
различающиеся по устойчивости. Наиболее
устойчивы молекулы Э2
элементов
второго периода — N2,
О2
и F2.
При переходе от IIIА-
к IVА-
и VА-группам
устойчивость молекул возрастает, а
затем при переходе к VIIIА-группе
понижается. В группах при движении вниз
прочность связи Э—Э уменьшается.
-Элементы
образуют двухатомные молекулы Э2,
различающиеся по устойчивости. Наиболее
устойчивы молекулы Э2
элементов
второго периода — N2,
О2
и F2.
При переходе от IIIА-
к IVА-
и VА-группам
устойчивость молекул возрастает, а
затем при переходе к VIIIА-группе
понижается. В группах при движении вниз
прочность связи Э—Э уменьшается.
р-Элементы второго периода — азот, кислород и фтор — обладают ярко выраженной способностью участвовать в образовании водородных связей. Элементы третьего и последующих периодов эту способность теряют.
Сходство р-элементов второго периода с р-элементами последующих периодов заключается в основном только в строении внешних электронных оболочек и тех валентных состояний, которые возникают за счет неспаренных электронов в невозбужденных атомах. Бор, углерод и особенно азот сильно отличаются от остальных элементов своих групп (наличие d- и f-подуровней).
При переходе от р-элементов второго периода к р-элементам третьего и последующих периодов сохраняются все типы связей, характерные для элементов второго периода, и появляются новые типы химической связи. В этом направлении увеличивается склонность элементов образовывать комплексные соединения и повышаются координационные числа.
Т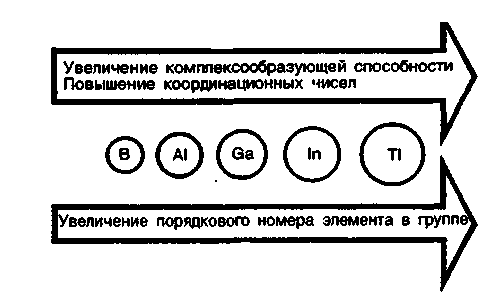 ак,
если р-элементы второго периода имеют
в соединениях координационные числа
2, 3, 4, то р-элементы последующих периодов
могут иметь координационные числа 5, 6,
7, 8 и даже 12.
ак,
если р-элементы второго периода имеют
в соединениях координационные числа
2, 3, 4, то р-элементы последующих периодов
могут иметь координационные числа 5, 6,
7, 8 и даже 12.
При переходе вниз по группе устойчивость максимальной положительной степени окисления у р-элементов уменьшается и возрастает устойчивость низших степеней окисления. Так, например, для углерода устойчивая степень окисления +4, а для свинца +2, для алюминия +3, а для таллия +1.
Физические свойства простых веществ р-элементов сильно различаются. Одни вещества — кислород, азот (газы) — кипят и плавятся при очень низких температурах, другие — бор, углерод — при очень высоких. По группам и периодам физические свойства изменяются немонотонно, и не всегда характер изменений легко связать со строением электронных оболочек атомов, типом химической связи, координационным числом атома.
Таким образом, у p-элементов различия в свойствах соседних элементов как внутри группы, так и по периоду выражены значительно сильнее, чем у s-элементов.
Все р-элементы и в особенности р-элементы второго и третьего периодов (С, N. Р, О, S, Si, Сl) образуют многочисленные соединения между собой и с s-, d- и f-элементами. Большинство известных на Земле соединений — это соединения р-элементов.
Таким образом, изучение р-элементов особенно важно для медиков, так как пять из них — С, N. Р, О и S — являются органогенами и составляют основу живых систем, а ряд других — Р, Сl, I — незаменимые микроэлементы.
