
Лекція 01 Біохімія як наука, Ферменти
.pdf
Лекція 1
Біохімія як наука Ферменти

Корифеї вітчизняної біохімії
ГОРБАЧЕВСЬКИЙ Іван (1854 - 1942)
Український біохімік, гігієніст та епідеміолог, громадсько-політічний і освітній діяч. автор 66-ти наукових публікацій з хімії, біохімії, епідеміології, судової медицини, токсикології. понад 100 наукових опрацювань у галузі санітарії, багато з яких впроваджено в Австро-Угорщині. 1882 р. вперше у світі синтезував сечову кислоту.
БАХ Олексій Миколайович
(1857 - 1946)
Учений, основоположник радянської школи
біохіміків, академік АН СРСР з 1929 р.
ПАЛЛАДІН Олександр Володимирович (1885 - 1972).
Учений - біохімік, один з засновників вітчизняної наукової біохімічної школи, академік ВУАН (з 1929), академік АН СРСР (з 1942), дійсний член АМН СРСР ( з 1944 )., президент АН УРСР (1946–1962), Синтезував новий водорозчинний аналог вітаміну К — вікасол (1943). Співзасновник міжнародного нейрохімічного товариства, засновник і голова Українського товариства фізіологів, біохіміків і фармакологів (1928–1959), Українського біохімічного
товариства (1959–1972),
БЄЛІЦЕР Володимир Олександрович
(1906—1988)
Академік НАН України, доктор біологічних наук (1941), професор (1936), член-кореспондент АН УРСР (1945), дійсний член АН УРСР (1957). Автор близько 200 наукових праць і 6 патентів, автор монографії «Химические превращения в мышцах» (1940)
Чаговeць Ростислав Всеволодович (1904-1982)
Видатний біохімік-вітамінолог, доктор біологічних наук (1954), професор (1956), академік АН УРСР, заслужений діяч науки УРСР (1964), професор, академік-секретар Відділення біохіміі-біофізики та фізіології і теоретичної медицини АН УРСР (1966).
ВЕНДТ Володимир Петрович (1906-1993)
Доктор біологічних наук, професор, лауреат державної премії України. Розробив технологію для промислового виробництва вітаміну D3 (“відеїну D3”). Автор понад 200 наукових праць, 17 авторських свідоцтв і винаходів.
ГУЛИЙ Максим Федотович. (1905-2007)
Визнаний український вчений, патріарх і класик вітчизняної біохімії, доктор біологічних наук (1940), професор (1945), академік НАН України (1957), лауреат державних премій СРСР (1952) та УРСР (1978, 1985), заслужений діяч науки УРСР (1956), Герой України (2005), директор Інституту біохімії ім. О.В. Палладіна НАН України (1972– 1977).
МАЦУКА Геннадій Харлампійович (1930)
Вчений у галузі біохімії, молекулярної біології та генетики, доктор біологічних наук (1973 р.), професор (1975 р.), академік НАН України (1985 р.), заслужений діяч науки і техніки України (1997 р.), лауреат Державної премії УРСР в галузі науки і техніки (1986 р.).
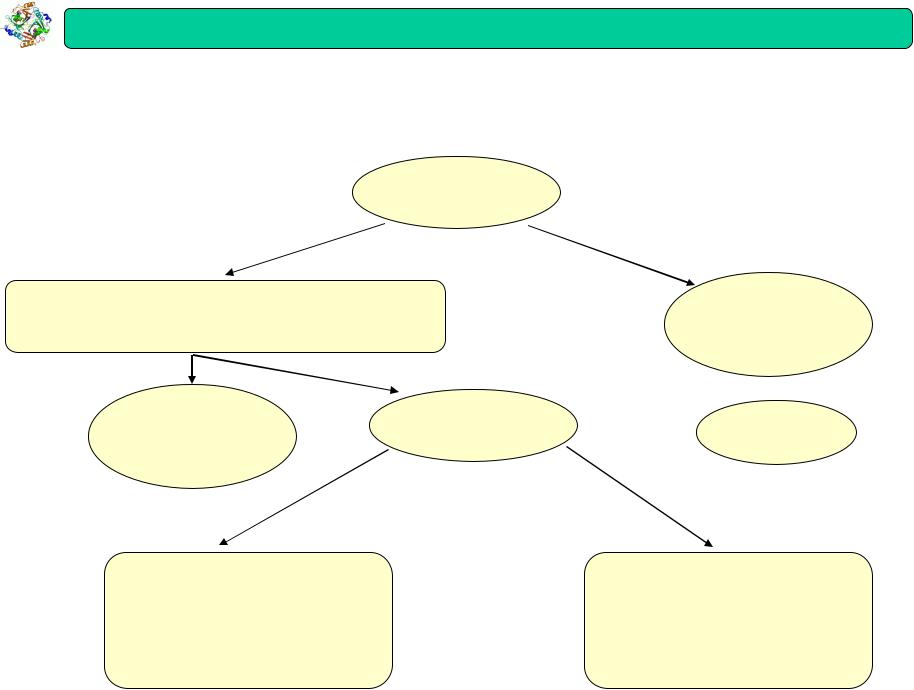
 Біохімія
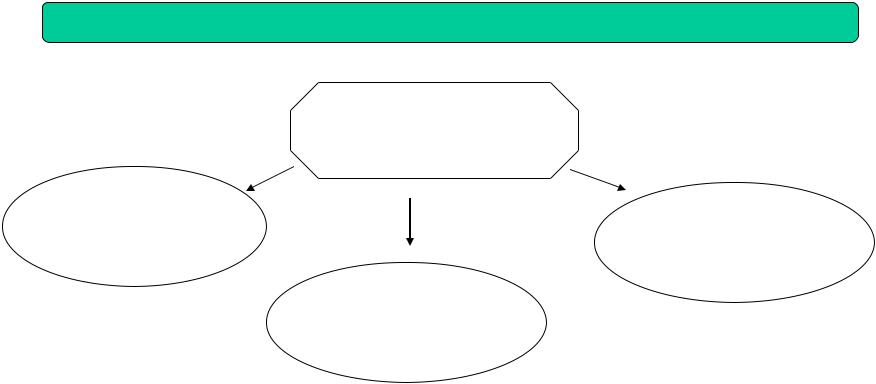
Біохімія
Біохімія
Статична
біохімія
|
Динамічна |
Вивчає: складові |
біохімія |
хімічні частини |
|
організмів, їх |
Вивчає : шляхи |
розподіл, фізико- |
перетворення певних сполук |
хімічні та |
в організмах (окиснення, |
біологічні |
відновлення, гідролітичне і |
властивості. |
фосфоролітичне |
|
розщеплення, етерифікацію, |
|
синтез складних сполук з |
|
простіших, тощо). |
Функціональна
біохімія
Вивчає біохімічні процеси, що лежать в основі проявів життєдіяльності організмів та окремих органів а також зміни цих процесів під впливом різних зовнішніх умов і внутрішніх факторів, пов'язаних з видовою належністю, віком і статтю організмів. Відповідно до об'єктів дослідження розрізняють біохімію людини, тварин, рослин (фітобіохімія) і мікроорганізмів.
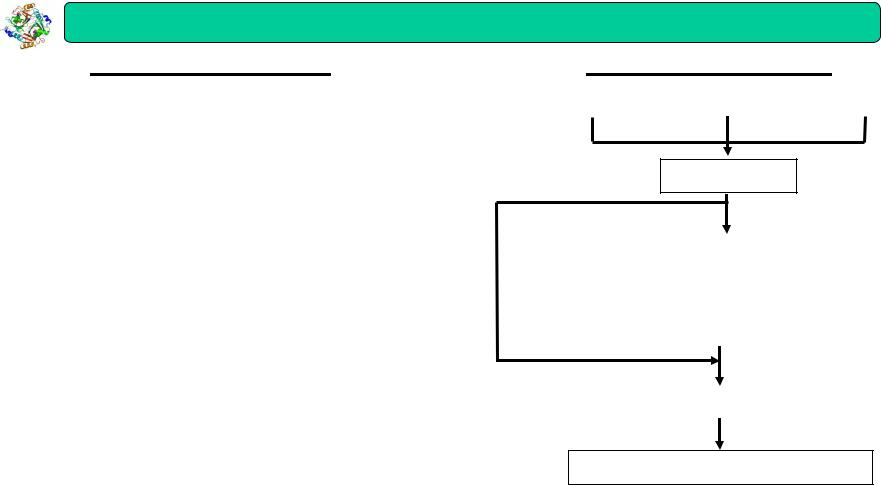
Біохімічні методи
Етапи дослідження |
Об’єкт дослідження |
||||
|
|
|
|
|
|
І. Гомогенізація |
Орган |
|
Тканина |
|
Клітина |
Гомогенат
ІІ. Ультрацентрифугування |
Субклітинні структури |
|||
(седиментація) |
(ядра, мітохондрії, лізосоми, мікросоми, пероксисоми, |
|||
рибосоми, цитомембрани, гіалоплазма, міофібрили, |
||||
|
||||
|
нейрофібрили, мікрофіламенти,) |
|||
ІІІ. Екстракція |
|
|
|
|
|
|
|
||
|
Екстракт |
|
||
ІV. Аналіз |
|
|
||
|
|
|
||
|
|
|
||
Діаліз Електрофорез: фронтальний, зональний (горизонтальний, диск), Молекулярні біоструктури
імунофорез, ДНК-(РНК) форез, гельелектрофорез (крохмальний, целюлозний, агарозний, поліакриламідний) Ізоелектрофокусування в рН градіенті Полярографія Реекстракція
Седиментація (в спеціальних середовищах)
Спектроскопія:І. Абсорбційна (спектроскопія, нефелометрія, атомно-абсорбційна спектроскопія) ІІ. Емісійна( флюорометрія, полуменева фотометрія, атомно-емісійна спектроскопія) Термообробка: дистиляція, перекристалізація, сублімація)
Хроматографія: тонкошарова (одно-, та двомірна), газорідинна, рідинна, гельфільтрація, афінна, іонообмінна, високоефективна рідинна хроматографія (ВЕРХ)р
Ферменти

План
•Загальна характеристика ензимів як біологічних каталізаторів
•Класифікація та номенклатура ензимів
•Механізми дії ензимів
•Основи кінетики ензиматичних реакцій
•Регуляція ензиматичної активності
•Регуляція метаболічних процесів
Актуальність теми:
В основу життєдіяльності організму покладено хімічні процеси. Майже всі вони відбуваються за участі природних біокаталізаторів ензимів (ферменти). З безлічі енергетично можливих реакцій ензими вибірково перетворюють реагенти – субстрати фізіологічно корисним шляхом. Таким чином, ензими здійснюють керівництво всіма метаболічними процесами організму.
Ферменти : |
Будова ферментів |
Ензими (ферменти) - біологічні каталізатори білкової природи за допомогою яких відбуваються всі реакції в живих організмах
Ензими
Складні - холоферменти (білкова частина - |
Прості |
|
апофермент небілкова частина - кофактор) |
||
(апоферменти) |
||
|
Апофермент |
Ензими |
Кофактор |
|
|
|
(білкова частина) |
|
|
Простетична група |
Кофермент |
|
|
||
–як правило мала неорганічна |
-велика органічна молекула; |
|
молекула або атом; |
||
|
-як правило постійно зв’язана |
-зв’язується з ферментом тільки |
|
в момент реакції |
||
з апоферментом |
||
|
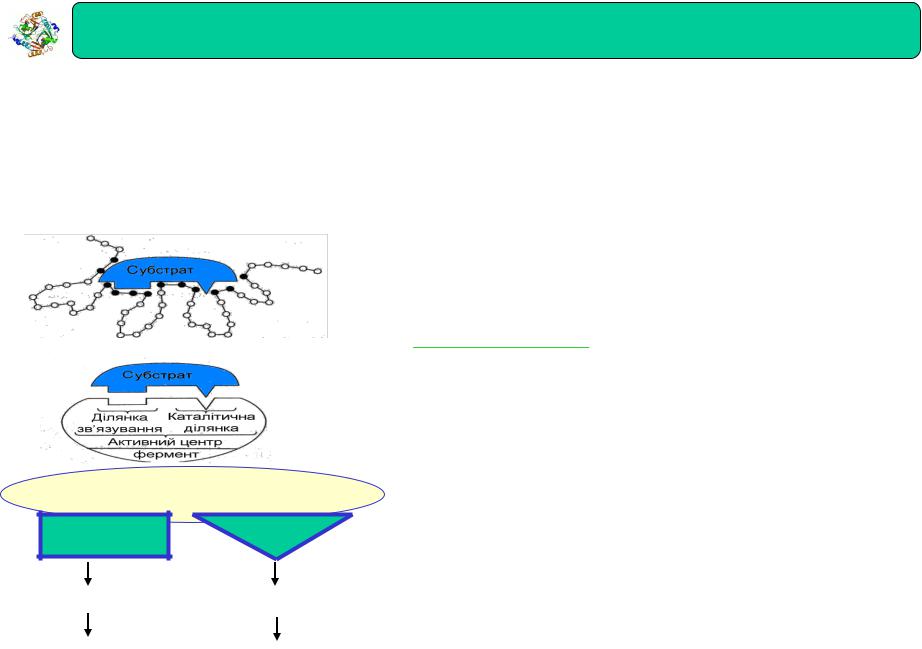
Ферменти : Будова активного центру ферментів
Субстрат (S), як правило, мала молекула
Фермент (E) – велика білкова молекула
Продукт (P)
Е + S ES EP E + P
Активний центр – специфічна ділянка фермента до якої приєднується субстрат
Будова активного центру ферменту
Активний центр ферменту
Ділянка |
Каталітична |
|
ділянка |
||
зв'язування |
||
|
Молекула ферментів взаємодіє з субстратом не всією поверхнею, а певними ділянками, активними центрами (2, 4, 6, 8) кожен 7-15 амінокислот
•Ділянка яка зв'язується з субстратом: контактна (“якірна”)
•Каталітична ділянка до складу якої входять хімічні групи, що приймають безпосередню участь в перетворенні субстрату:
•OH - (серин, треонін, тирозин)
•SH - (цистеїн)
•NH - (гістидин)
•N -
•NH2- (аргінін, лізин)
•COOH- (глутамат, аспартат)
забезпечує |
забезпечує вибір шляху хімічного |
Аллостеричний центр – додатковий регуляторний центр |
|
|
|
субстратну специфічність |
перетворення даного субстрату |
|
|
|
|
• абсолютна субстратна специфічність; |
специфічність шляху |
|
• групова субстратна специфічність; |
перетворення |
|
• стереоспецифічність |
|
|
|
Ферменти : |
|
|
|
каталізатори |
|||
Спільність між хімічними каталізаторами і |
Специфічні властивості |
ОСНОВНІ ВЛАСТИВОСТІ |
||||||
ферментами: |
ферментів: |
|
|
ФЕРМЕНТІВ ЯК |
||||
1. |
Каталізують тільки темодинамічно можливі реакції. 1. |
Прискорюють |
реакції |
БІОЛОГІЧНИХ |
||||
КАТАЛІЗАТОРІВ |
||||||||
|
|
більшою |
мірою, |
ніж |
||||
2. |
Не змінюються в процесі реакції. |
|
|
|||||
неорганічні каталізатори |
• |
Специфічність; |
||||||
|
|
|||||||
3. |
Не змінюють точки рівноваги і напрямку реакції. |
2. |
Специфічність дії |
|
• |
Каталітична ефективність; |
||
|
|
|
||||||
4. Каталізують реакції в мікрокількостях. |
3. |
Чутливість до температури |
• |
Лабільність ферментів; |
||||
|
|
|||||||
5. |
Діють формуючи комплекс із субстратом. |
4. |
Чутливість до pH |
|
• |
Здатність до регуляції |
||
|
|
|
||||||
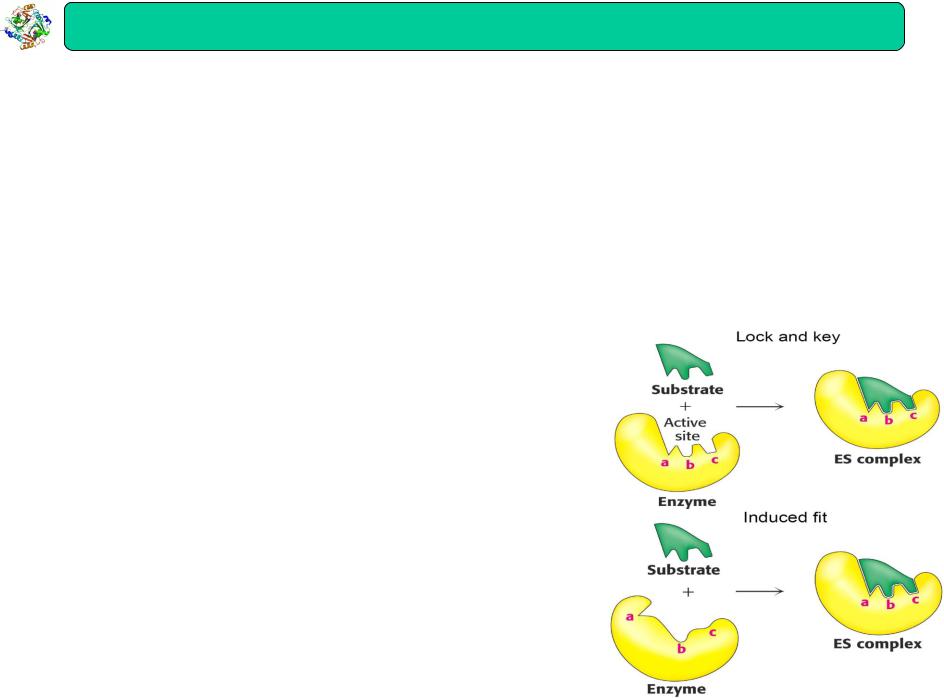
Теорії специфічності
Теорія Фішера (“ключ-замок”)
Активний центр ферменту (замок) здатний прийняти тільки субстрат специфічної форми (ключ)
Теорія Кошланда
(індукованої адаптації)
Процес приєднання субстрату індукує специфічні конформаційні зміни в активному центрі

Ферменти :
Специфічність
•Абсолютна – каталізує перетворення одного субстрату (уреаза, аргіназа,
сахараза, лактаза ), активний центр є комплементарним лише до одного субстрату.
•Стереоструктурна - каталізує перетворення певного стереоізомера
(лактатдегідрогеназа - L-лактат)
•Відносна – каталізує перетворення групи сполук з одним типом зв’язку
(пептидази, естерази, глікозидази)
специфічність
В організмі людини спостерігають специфічність
ферментів до наступних стереоізомерів:
•стереоспецифічність до D- цукрів;
•стереоспецифічність до L-амінокислот;
•стереоспецифічність до цис-транс-ізомерів;
•стереоспецифічність до - , -глікозидних
зв'язків.
