
Лекція 01 Біохімія як наука, Ферменти
.pdf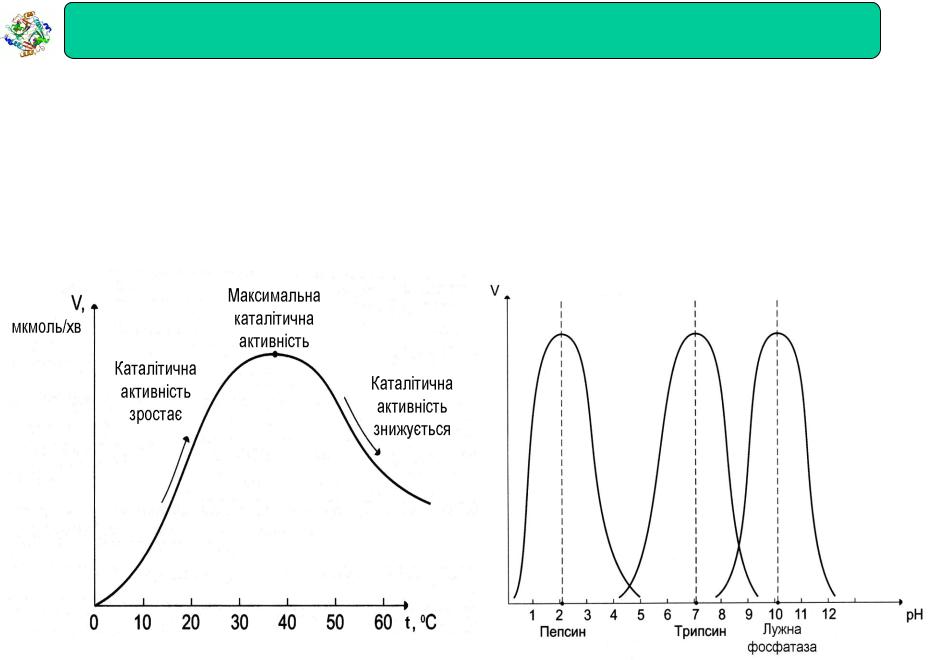
Ферменти :
Термолабільність -
залежність активності від температури
-Більшість ферментів мають температурний оптимум при 37o
Залежність активності від рН
Кожний фермент проявляє максимальну активність при певному pH (оптимум pH) Для більшості ферментів оптимум pH = ~7 (є виключення)
Залежність швидкості ферментативної реакції від температури Залежність швидкості ферментативної реакції від рН
Ферменти : класифікація та класи ферментів
Загальні назви - утворюються додаванням суфікса –аза до назви субстрату ( тирозиназа – окислює тирозин; - мальтаза – гідролізує мальтозу. Загальні назви не описують хімізму реакції
Тривіальні назви (пепсин, каталаза, трипсин). Не дають інформації про субстрат, продукт чи хімізм реакції Принципи міжнародної класифікації Шість класів відповідно до типу реакції
Кожний фермент має класифікаційний номер, що складається з чотирьох цифр: EC: 2.3.4.2
Перша цифра – клас фермента; друга – підклас; третя – підпідклас; четверта – порядковий номер ферменту в підпідкласі.
1.Оксидоредуктази - каталізують
окислювально-відновні реакції
(оксидази, пероксидази, дегідрогенази)
2.Трансферази - каталізують перенесення атомів або груп атомів

Ферменти : |
Класи ферментів |
3. Гідролази - каталізують гідролітичні реакції (розщеплення за участю води)
Естерази, пептидази, глікозидази
4.Ліази - каталізують розщеплення субстратів без участі води з утворенням подвійного зв’язку
5.Ізомерази - каталізують реакції ізомеризації
6.Лігази (синтетази) Каталізують реакції синтезу
•Потребують енергії АТФ
Ферменти : механізм дії ферментів та типи каталізу
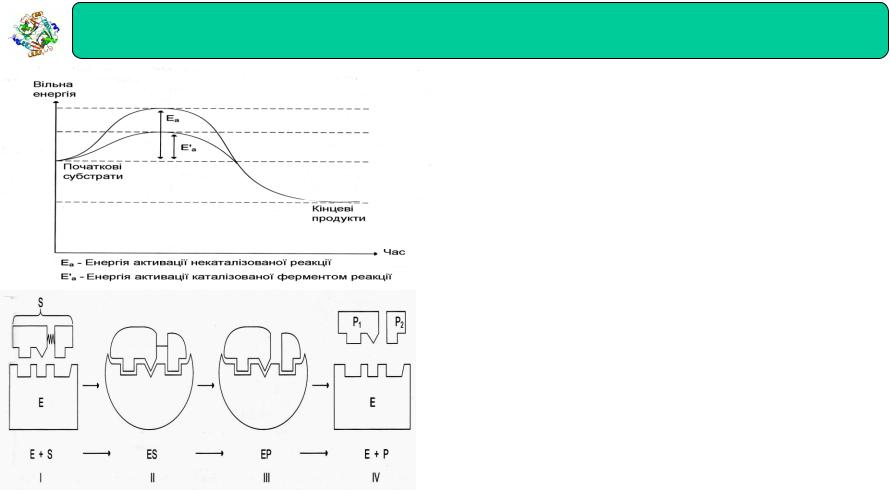
Зміна вільної енергії під час хімічної реакції, що каталізується і не каталізується ферментом
Фермент знижує енергію активації Еа, тобто знижує висоту енергетичного бар'єру, в результаті зростає частка реакційноздатних молекул, отже, збільшується швидкість реакції.
І- етап зближення й орієнтації субстрату відносно активного центру ферменту;
ІІутворення фермент-субстратного комплексу (ЕS) у результаті - індукованої відповідності;
ІІІ деформація субстрату й утворення нестабільного комплексу
-фермент – продукт (ЕР)
ІV розпад комплексу (ЕР) з вивільненням продуктів реакції із
-активного центру ферменту та звільнення ферменту.
Типи ферментативного каталізу
•Кислотний каталіз - вбудовування протону в субстрат
•Лужний каталіз - відрив протону від субстрату
•Електрофільний каталіз - вбудовування електрону в субстрат
•Нуклеофільний каталіз - відрив електрону від субстрату

Ферменти : Кінетика ферментативних реакцій
Вплив концентрації субстрату на швидкість реакції
-При фіксованій концентрації ферменту початкова швидкість реакції є лінійно пропорційною до концентрації субстрату, якщо остання є малою, але не залежить від концентрації субстрату, якщо вона є великою
-Швидкість реакції зростає лінійно при збільшенні концентрації субстрату і потім припиняється при насиченні ферменту
При достатній концентрації субстрату чим вища концентрація ферменту, тим вища швидкість реакції
Michaelis і Menten – першими дослідили кінетику реакцій (1913)
Під час реакції молекула ферменту E і молекула субстрату S формують проміжний фермент-субстратний (ES) комплекс
E S ES E P |
|
k1 |
k2 |
k-1
V
Vmax
k1, k-1, k2 – константи швидкості – вказують на швидкість або |
||||||||||
ефективність реакції |
|
|
|
|
|
½Vmax |
||||
|
|
|
k1 k2 |
|
Рівняння Міхаеліса-Ментен |
|
||||
Km |
|
|
V |
|
S |
|
||||
|
|
|
||||||||
|
|
|
k 1 |
V |
max |
|
|
|
||
|
|
|
Km |
S |
|
|
||||
К |
m |
– константа Міхаеліса |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
Кm |
[S] |

Ферменти : Інгібування ферментативних реакцій
Різні хімічні агенти (метаболіти, аналоги субстратів, токсини, лікарські засоби, метали і ін.) можуть пригнічувати (інгібувати) активність ферментів
Інгібітор – зв’язується з ферментом і попереджає формування комплексу ЕS або його розщеплення до E + P
•Зворотні інігібітори – після зв’язування з ферментом (утворення EI комплексу) швидко дисоціює
•Фермент пригнічений тільки коли зв’язаний з інгібітором
•EI комплекс утримується разом за допомогою слабких нековалентних зв’язків
•Типи зворотнього інгібування:
•конкурентне
•неконкурентне
•безконкурентне
•Незворотнє інгібування - дуже повільна дисоціація EI комплексу
Міцно зв’язуються ковалентними зв’язками з ферментом
Незворотні інгібітори
•інгібітори специфічні до груп амінокислотних залишків
•аналоги субстратів
•суїцидні інгібітори
Ферменти : |
Гальмування ферментів |
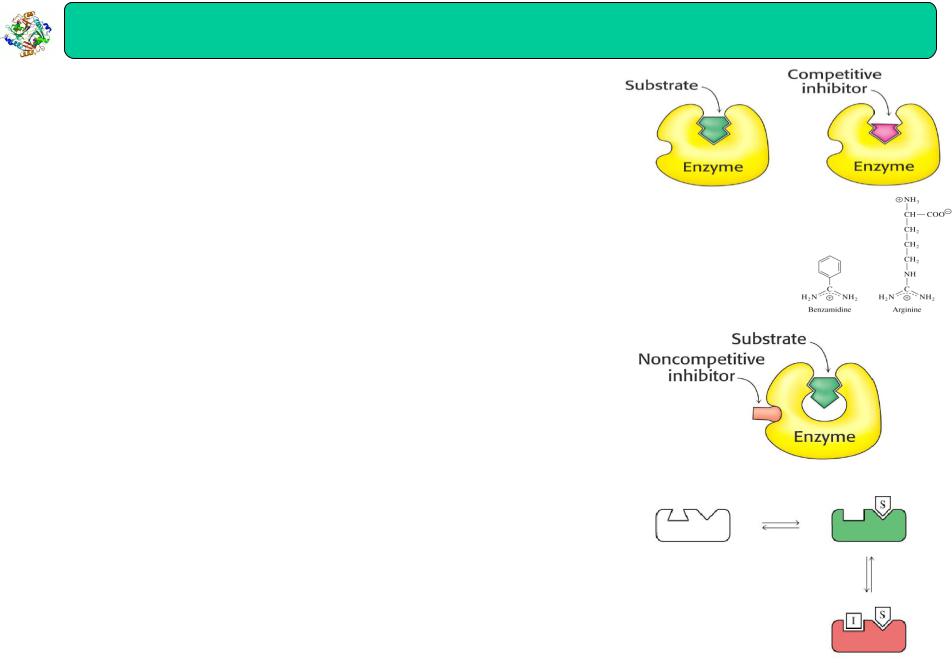
Конкурентне гальмування
•Інгібітор за структурою подібний до субстрату, тому зв’язується з тим самим активним центром
•Фермент не може розрізнити інгібітор і субстрат
•Приєднання інгібітора до активного центру попереджує зв’язування субстрату
•Конкурентний інгібітор знижує швидкість каталізу зменшуючи кількість молекул ферменту, зв’язаних із субстратом
•Інгібітор може бути витіснений з активного центру шляхом збільшення концентрації субстрату
Неконкурентне гальмування
•Інгібітор приєднується не до активного центру, а до іншої ділянки ферменту
•Інгібітор і субстрат можуть зв’язуватися з ферментом в один і той же час
•Інгібітор може зв’язуватися як з ферментом (EI) , так і з ферментсубстратним комплексом (ESI)
•Інгібітор не може бути витіснений шляхом збільшення концентрації субстрату
Безконкурентне гальмування
•Інгібітор приєднується до ES але не до вільного E
•Зустрічається тільки в мультисубстратних реакціях
• Бензамідин конкурує з аргініном за зв’язування з трипсином

Ферменти : |
Ізоферменти |
множинні форми ферменту, які відрізняються амінокислотною послідовністю, але каталізують ту ж саму реакцію
Ізоферменти можуть відрізнятися:
кінетикою
регуляторними властивостями
коензимом
поширенням в клітині і тканинах
Ізоферменти кодуються різними
генами
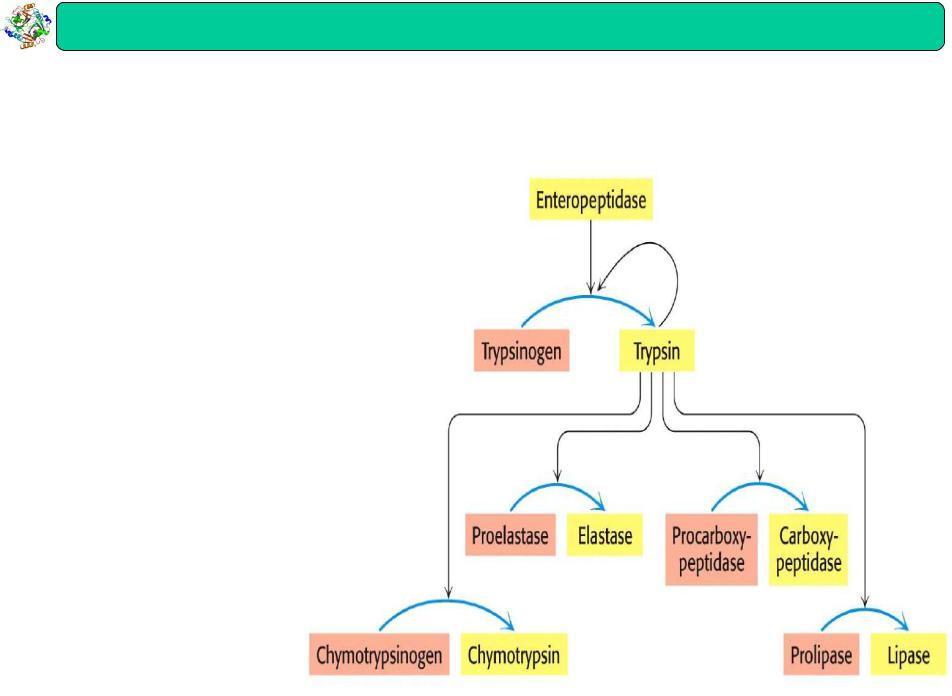
Ферменти : |
Протеолітична активація |
Багато ферментів синтезуються як неактивні попередники (зимогени) і активуються протеолітичним розщепленням
Приклади специфічного протеолізу
•Ферменти травлення
–синтезуються як зимогени в шлунку і підшлунковій залозі
•Ферменти згортання крові
–каскад протеолітичної активації
•Деякі білкові гормони
–проінсулін в інсулін шляхом видалення пептиду

Ферменти : Мультиферментні комплекси та поліфункціональні ферменти
•Мультиферментні комплекси - надмолекулярні утворення, які включають кілька ферментів та коферментів, що каталізують послідовні реакції одного процесу і просторово розміщуються в одному місці -продукт однієї реакції переноситься прямо на активний центр наступного ферменту значно підвищується швидкість реакції.
•Мультиферментні комплекси формуються як правило на мембранах шляхом самозбирання
•Поліфункціональні ферменти – в залежності від умов один фермент може мати різні (часом протилежні) активності
•МЕХАНІЗМ ВПОРЯДКОВАНОЇ ВЗАЄМОДІЇ СУБСТРАТУ З АКТИВНИМ ЦЕНТРОМ ФЕРМЕНТУ
•МЕХАНІЗМ ВИПАДКОВОЇ ВЗАЄМОДІЇ СУБСТРАТУ З АКТИВНИМ ЦЕНТРОМ ФЕРМЕНТУ
