
Praktikum_Klimnyuk
.pdf
Розділ 12. Будова і класифікація вірусів |
|
|
321 |
|||
|
|
|
|
|
Продовження табл. 68 |
|
|
|
|
|
|
|
|
1 |
2 |
3 |
4 |
5 |
|
6 |
Herpesviridae |
Так |
Кубічний |
150-200 |
Двониткова, |
|
Вірусипростогоі |
|
|
|
|
лінійна |
|
оперізуючого |
|
|
|
|
|
|
герпесу, итомега- |
|
|
|
|
|
|
ловірус, вірус |
|
|
|
|
|
|
Епштейна-Барр, |
|
|
|
|
|
|
вірусигерпесу |
|
|
|
|
|
|
6, 7, 8 |
Poxviridae |
Так |
Змішаний |
220-450 у |
Двониткова, |
|
Вірус нату- |
|
|
|
довжину |
лінійна |
|
ральної віспи, |
|
|
|
140-260 у |
|
|
вірус вакцини |
|
|
|
товщину |
|
|
|
|
|
|
140-260 |
|
|
|
|
|
|
у висоту |
|
|
|
|
|
|
|
|
|
|
ромінення залежить від величини геному вірусів: чим менший геном, тим резистентніший вірус до опромінення. Віруси, які мають ліпопротеїдну оболонку, чутливі до ефіру, хлороформу та дезоксихолату натрію, інших жиророзчинників і детергентів.
Важливоюособливістювірусівєїхчутливістьдоконцентраціїводневихіонів. Частина з них стійка до кислих значень рН (2,2-3,0). До них належать віруси, які викликаютькишковіінфекції, проникаючиворганізмаліментарнимшляхом(віруси поліомієліту, Коксакі, ЕСНО). Віруси, які потрапляють в організм через верхні дихальні шляхи (риновіруси, віруси грипу та ін.), чутливі до кислих значень рН.
Взаємодія вірусів і клітини. Розрізняють декілька типів взаємодії. Припродуктивній інфекції вірус функціонує в клітині автономно, а його репродукція відбуваєтьсянезалежновідрепродукціїклітинногогенетичногоапарата. Прицьому утворюється нове покоління інфекційних вірусів.
Якщо цикл репродукції вірусів блокується на одній із стадій, а інфекційні віріони не утворюються, такий тип взаємодії позначають як абортивний.
КолизклітиноювзаємодіютьонкогенніРНК- таДНК-геномнівіруси(СНІДу, лейкозу), нуклеїнова кислота інтегрується в клітинну хромосому та існує там у вигляді провірусу. В результаті може спричинятися зміна спадкових властивостей клітини. Такий тип взаємодії називають вірогенією.
Отже, віруси є особливими інфекційними агентами, які вимагають своєрідних прийомів для роботи з ними, не подібних до мікробіологічних. Вірусологічні дослідження проводять у спеціально обладнаних вірусологічних лабораторіях.
Методи лабораторної діагностики вірусних інфекцій
Лабораторна діагностика вірусних інфекцій може здійснюватись за двома основними напрямками. Перший – виявлення та ідентифікація вірусів або їх компонентів в організмі хворого (вірусологічна діагностика). Другий напрямок – ви-
322 |
Частина ІV. Вірусологія |
явлення специфічних противірусних антитіл у сироватці крові (серологічна діагностика). Оскільки антитіла з’являються не зразу після проникнення вірусів в організм, а потім їх титр протягом деякого часу зростає, діагностичну цінність має визначення приросту титру антитіл. Саме тому всі імунологічні реакції ставляться зпарнимисироватками, першазякихбереться у хворого на початку захворювання, а друга – через 2-3 тижні. Оскільки застосування цьогометоду практично підтверджує перенесення захворювання, його ще називають ретроспективною діагностикою. Практичнодлявсіхвіруснихінфекційреакції, яківикористовуються з цією метою, вважаються позитивними, якщо в досліді виявлено чотирикратний і більше приріст титру антитіл.
Третя група методів – експрес-діагностика вірусних інфекцій. Використання цих чутливих і надійних імунологічних тестів дозволяє значно прискорити лабораторну діагностику захворювань.
Виявленнявірусів. Длявиділеннявірусів, необхіднихдляподальшогоїхдослідження зметою ідентифікації, дуже важливо провести правильний забір, швидке транспортування матеріалу до лабораторії, раціональний вибір тест-системи (курячі ембріони, культури клітин, лабораторні тварини).
Для вірусологічного дослідження матеріал краще збирати у перші дні захворювання. Від правильного його забору залежить хід подальшого вірусологічного дослідження. Залежно від проявів хвороби досліджуваним матеріалом може бути кров, змиви з носо- і ротоглотки, харкотиння, рідина з пухирців, спинномозкова рідина, сеча, фекалії, шматочки органів і тканин людини, отриманих при дослідженні трупів, матеріал від лабораторних тварин тощо. Одержаний матеріал необхідно зберігати за умов збереження активності вірусів. Тому його слід тримати (заморозити) притемпературі -20 °С. Длятранспортуваннявірусівможнавикористати термоси, які заповнюються сухим льодом.
Досліджуванийматеріал, якийнеконтамінуєтьсясторонньоюфлорою(кров, плазма, сироватка, спинномозкова рідина), може бути безпосередньо використаний для зараження тест-систем. Допустимим є розведення його фосфатно-буфер- ним розчином рН 7,6. Якщо досліджуються шматочки тканин, вони спочатку подрібнюютьсявстерильнихумовахдогомогенногостану, потімдодаєтьсяфосфатний буферний розчин, одержана суспензія центрифугується протягом 10 хв при 1500-2000 об/хв. З метою зараження використовують надосадову рідину.
Однак у багатьох випадках досліджуваний матеріал (фекалії, змиви з ротоглотки, носовихходівтощо) можеміститибактеріальнуфлору, якаприподальшому зараженні тест-систем спотворюватиме результати досліджень, включаючи їх загибель. Тому в лабораторіях використовують методи знищення бактерій в доставлених взірцях. Надійним методом є обробка матеріалу антибіотиками пеніциліном і стрептоміцином у концентрації 500-1000 ОД/мл, у разі простих вірусів – ефіром. Допустимим вважається використання спеціальних антибактеріальних фільтрів абоцентрифугуванняматеріалу при невисоких швидкостях. У цьому випадку бактерії опускаються з осадом на дно. Супернатант підлягає подальшому ультрацентрифугуванню, і його потім використовують для зараження.
Розділ 12. Будова і класифікація вірусів |
323 |
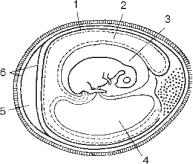
Зараження курячих ембріонів. Курячі ембріони 6-12-денного віку є зручною моделлю для виділення та подальшої ідентифікації вірусів. Після зараження їх інкубують у термостаті при температурі 36-38 °С протягом декількох днів.
Існує два способи зараження курячих ембріонів – відкритий і закритий (рис. 83). Перед проведенням зараження відбирають ембріони, у яких візуально немаєпошкодженняшкаралупи. Їхпросвічуютьзадопомогою овоскопаівідмічають межу повітряного мішка. При відкритому способі шкаралупу над мішкомобробляють спиртом і розчином йоду, за допомогою гострих ножиць зрізають шкаралупу, знімають верхній листок оболонки повітряного мішка і проводять зараження. Отвір закривають спеціальною скляною кришкою або шкаралупою і герметизують стерильним розтопленим парафіном.
При закритому способі зараження шкаралупу над повітряним мішком також обробляютьрозчиномйодуіспиртом, потімроблятьколючимінструментомотвір ушкаралупіівводятьзадопомогоюшприцазтовстоюголкою0,1-0,2 млвірусмісткогоматеріалупідконтролемовоскопа. Отвірзаливаютьстерильнимрозплавленим парафіном, а ембріони закладають у термостат.
Длявиділеннявірусівукурячихембріонахїхможназаражатинахоріоналантоїсну оболонку, в алантоїсну порожнину, порожнину амніону, жовтковий мішок тощо. При зараженні на хоріоналантоїсну оболонку після зняття шкаралупи над повітряним мішком обережно відшаровують верхній і нижній листки підшкаралупної оболонки і наносять матеріал на відповідну оболонку.
В алантоїсну порожнину матеріал вводять закритим способом через невеликий отвір у шкаралупі на глибину 10-15 мм у безсудинній ділянці хоріоналантоїсної оболонки.
Призараженні вамніотичну порожнину використовують ембріони старшого віку. Зараженняможнапроводитивідкритимізакритимспособами. Припершому після знаходження хоріоналантоїсної оболонки в ній роблять отвір, захоплюють
стерильнимпінцетомамніотичнуоболонкуівво- |
|
|
дять матеріал з вірусами. Призакритому способі |
|
|
вірусмісткий матеріал вводять на глибину до 20- |
|
|
25 мм за допомогою голки, яку спрямовують до |
|
|
тіла ембріона. |
|
|
Для зараження в жовтковий мішок викорис- |
|
|
товують3-8-денніембріони, томущовнихжовт- |
|
|
ковий мішок займає значну частину порожнини |
|
|
яйця. Зараження проводять закритим способом. |
|
|
Заражені ембріони інкубують у термостаті |
|
|
протягом 2-4 діб. Потім їх охолоджують до тем- |
|
|
ператури 4 °С протягом однієї доби для макси- |
Рис. 83. Курячий ембріон: |
|
мального звуження судин. Розтинають ембріони |
1 – хоріоналантоїсна оболонка; |
|
в стерильних умовах, попередньо обробивши |
2 – порожнина алантоїса; 3 – |
|
порожнина амніона; 4 – жовтковий |
||
шкаралупу йодом і спиртом. Матеріал із порож- |
мішок; 5 – повітряний мішок; |
|
нин ембріона відсмоктують стерильним шпри- |
||
6 – підшкаралупна оболонка. |

324 Частина ІV. Вірусологія
цом. У разі потреби досліджують оболонки і сам ембріон, які після виймання поміщають у стерильні чашки Петрі.
Деяківіруси(натуральноївіспи, простогогерпесу) маютьхарактернуцитопатичнудію, якапроявляєтьсяутвореннямособливихбляшокнаповерхніхоріоналантоїсної оболонки. Вони опуклі, мають дрібні розміри, білуватий колір (рис. 84).
Таким чином, визначити наявність вірусів у матеріалі з курячих ембріонів можна за їх цитопатичною дією. Однак більшість вірусів репродукується в ньому без зовнішніх проявів ураження. Тоді для індикації вірусів застосовують реакцію гемаглютинації. Принцип її полягає в тому, що віруси здатні, адсорбуючись на мембрані еритроцитів, викликати їх аглютинацію. Кількість віріонів в ембріоні визначають за титром гемаглютинації – найбільшим розведенням матеріалу, при якомущевиявляютьсклеювання еритроцитів. Титрувати віруси можнатакож при культивуванніїхнашматочкаххоріоналантоїсноїоболонки. Дляцьоговстерильні лунки плексигласових пластин вносять шматочки шкаралупи, на якій знаходиться неушкоджена хоріоналантоїсна оболонка. Потім у цих лунках роблять розведенняматеріалу, щоміститьвіруси. Їхзакриваютьспеціальнимистерильнимипластинами з фольги, і культивують віруси протягом двох-трьох діб при температурі 35-37 °С. Пізніше в кожну лунку вносять 0,5 % завись еритроцитів курки і через деякийчасзаумовинаявностівірусівспостерігаютьвипаданняосадуеритроцитів у вигляді перевернутої парасольки.
Зараження лабораторних тварин. Численні лабораторні тварини широко використовуютьсяувірусологіїдлявиділеннятаідентифікаціївірусів, отримання специфічних противірусних сироваток, вивчення різноманітних аспектів патогенезу вірусних захворювань, розробки способів боротьби із захворюваннями та їх профілактики. Найчастішевикористовуютьбілихмишейрізноговіку(навітьодно- і дводенного), білих щурів, гвінейських свинок, кролів, ховрахів, бавовникових щурів, мавп та інших.
Існуютьрізноманітніспособизараженнятваринзалежновідтропізмувірусів, клінічної картини захворювання тощо. Досліджуваний матеріал можна вводити через рот, у дихальні шляхи (інгаляційно, через ніс), нашкірно, внутрішньошкірно, підшкірно, внутрішньом’язово, внутрішньовенно, внутрішньоочеревинно, внутрішньосерцево, на скарифіковану рогівку, у передню
камеру ока, у мозок.
|
Для виділення вірусів простого герпесу, |
|
|
натуральної віспи використовують зараження |
|
|
лабораторнихтварин(кроликів) наскарифіко- |
|
|
вану рогівку ока. При дослідженні вірусів ге- |
|
|
патиту А вводять досліджуваний матеріал че- |
|
|
рез рот. При виділенні вірусів з нейротропни- |
|
Рис. 84. Утворення бляшок на |
мивластивостями, такихякарбовіруси, віруси |
|
сказу, Коксакидоцільнозаражатибілихмишей |
||
хоріоналантоїсній оболонці після |
||
зараження вірусом вісповакцини. |
(1-2-денних сисунців) у мозок. Для цього ма- |
Розділ 12. Будова і класифікація вірусів |
325 |
теріал попередньо обробляють антибіотиками для деконтамінації від бактерій. Відбирають групу мишей-сисунців (6 штук) і вводять у мозок до 0,02 мл матеріалу дещо вище орбітального горбика. Тварин, які загинули протягом 24 год після введення матеріалу, бракують, вважаючи, що їх загибель настала внаслідок травматичних ушкоджень. За рештою тварин спостерігають до появи клінічних ознак захворювання(2-4 тижні). Їхзабивають, дотримуючись правилроботизінфікованими тваринами, а органи досліджують на наявність вірусів.
Репродукція вірусів у культурах клітин. Цей метод широко використову-
ють для лабораторної діагностики вірусних інфекцій. Цьому сприяла розробка методів культивування клітин в умовах in vitro і створення штучних живильних середовищ для них, відкриття антибіотиків, які використовуються для пригнічення розмноження сторонньої мікрофлори тощо. Тепер у будь-якій вірусологічній лабораторіїєспеціальнілініїкультурклітин, яківисокочутливідобільшостівірусів, здатнихвикликатизахворюванняулюдини. Донихналежатьперещеплюванікультури клітин HeLa, HЕp-2, Vero, KB, первинно-трипсинізовані культури ембріонів людини, нирок мавп, фібробластів ембріона курки тощо.
Первинно-трипсинізовані культури клітин отримують із будь-яких тканин твариниаболюдинишляхомїхдезинтеграціїферментативноюобробкою. Дляцього отримані тканини подрібнюють на невеликі шматочки і доливають до них 0,25 % розчин трипсину. Дезинтеграцію (руйнування зв’язків між клітинами) можна проводити при температурі 37 °С або 4 °С. Після цього суспензію центрифугують, отримані клітини поміщають у спеціальні середовища, а їх кількість визначають при підрахунку в камері Горяєва.
Живильнісередовища, яківикористовуютьсядляпідтриманнякультурклітин абоїхросту, буваютьприроднимиабосинтетичними(штучними). Природні середовища – сироватка крові великої рогатої худоби, рідини із серозних порожнин, продукти гідролізу молока, різноманітні гідролізати (5 % гемогідролізат, 0,5 % гідролізатлактальбуміну) абоекстрактитканин. Їххімічнийскладдопомагаєстворити умови, які подібні до тих, що існують в організмі людини. Суттєвим недоліком таких середовищ вважається їх нестандартність, адже якісний і кількісний склад компонентів, які входять до їх складу, може змінюватися.
Синтетичні живильні середовища не мають цього недоліку, адже їх хімічний склад стандартний, тому що їх одержують, комбінуючи різноманітні сольові розчини (вітаміни, амінокислоти) в штучних умовах. До таких найбільш вживаних розчинів належать середовище 199 (культивування первинно-трипсинізованих і перещеплюваних культур клітин), середовище Ігла (містить мінімальний набір амінокислотівітамінівтавикористовуєтьсядлякультивуваннярізнихлінійклітин), середовищеІглаМЕМ(культивуванняособливовимогливихлінійклітин), розчин Хенкса, щовикористовуєтьсядлявиготовленняживильнихсередовищ, відмивання клітин тощо.
Дляодержанняпервинно-трипсинізованихкультурнайчастішевлабораторі- ях використовують нирки ембріонів людини (для виділення вірусів кору, аденовірусів), ниркимакаки-резус(длявиділенняполіовірусів, аденовірусів, вірусівкору,
326 |
Частина ІV. Вірусологія |
паротиту, гепатиту А), нирки африканської зеленої мавпи (культивування поліовірусів, тогавірусів, флавівірусів), клітинкурячихембріонів(культивуваннярізноманітних арбовірусів), нирки ембріона свині (виділення вірусів грипу, аденовірусів, пікорнавірусів, реовірусів) та інші.
Важливоюумовоюкультивуваннялінійклітинєдотриманнясуворихправил асептики. Це робиться для запобігання їхконтамінування мікроорганізмами, грибами. Адже попадання бактерій в культури клітини із досліджуваного матеріалу або повітря спричиняє їх загибель. Тоді неможливо оцінити цитопатичний ефект вірусів, оскільки у цьому випадку невідома причина загибелі клітин. Для запобіганняцьогодоживильнихсередовищідосліджуваного матеріалу додаютьрозчини антибіотиків з різними механізмами дії: пеніциліну (100 ОД/мл, стрептоміцину (100 мкг/мл), неоміцину, канаміцину, гентаміцину, лінкоміцину, протигрибкових препаратів ністатину (50 ОД/мл), афотерицину В або інших.
Одним з недоліків первинно-трипсінізованих ліній культур клітин є неможливість тривалий час підтримувати їх у лабораторних умовах, адже вони здатні витримувати тільки до 10 пасажів in vitro.
Іншою групою культур клітин є перещеплювані клітини. Вони представляють собоюкультуриклітин, якінабулиздатностідонеобмеженогоростуірозмноження. Їх одержують із злоякісних пухлин або з нормальних людських чи тваринних тканин, що мають змінений каріотип. Вони широко використовуються в лабораторній практиці, оскільки здатні швидко та інтенсивно розмножуватись у пробірках і чутливі до багатьох вірусів. Їх отримують із центральних банків тканинних культур.
Цікультуривирощують, якправило, увиглядіодношаровихкультур, прикріплених до поверхні скла, у спеціальних матрацах, флаконах або пробірках. НайчастішевикористовуютьлініїкультурклітинHeLa (карциномашийкиматки), HЕp-2 (карциномагортанілюдини), КВ(карциномаротовоїпорожнинилюдини), RD (рабдоміосаркома людини), RH (нирка ембріона людини), Vero (нирка зеленої мавпи), СПЭВ (нирка ембріона свині), ВНК-32 (нирка сирійського хом’яка) та інші.
Для підтримання ліній клітин відбирають ті з них, які мають типову морфологію, чітко відмежовані одна від іншої, не мають вакуолей і включень.
Третьою групою є диплоїдні клітини. Вони представляють собою культури клітин одного типу, мають диплоїдний набір хромосом і здатні витримувати при цьому до 100 пересівів в умовах лабораторії. Вони є зручною моделлю для отримання вакцинних препаратів вірусів, оскільки вільні від контамінації чужорідними вірусами, зберігають вихідний каріотип під час пасажів, не мають онкогенної активності. У той же час вони надзвичайно вибагливі до умов культивування, черезщоїхрідковикористовуютьупрактицізвичайнихвірусологічнихлабораторій. Найчастішекористуютьсялініямикультур, якіодержаноізфібробластівембріона людини (WI-38, MRC-5, MRC-9, IMR-90), корів, свиней, овець тощо.
Культури клітин зберігають у замороженому стані. Для цього спочатку одержують моношар клітин 4-6-денного віку, а потім суспендують їх у живильному середовищі, щоб отримати концентрацію клітин до 106 в 1 мл. Для стабілізації клітиндоскладусередовищадодають10-20 % сироваткикровітагліцерин. Отри-
Розділ 12. Будова і класифікація вірусів |
327 |
манусуспензіюрозливаютьустерильнихумовахвампулиіпоступовозаморожують до –20 °С. Зберігають клітини у спеціальних посудинах з рідким азотом при температурі –196 °С. Доведено, що за таких умов життєздатність культур клітин не змінюєтьсяпротягом невизначеного часу. У разі потребикультури швидко розморожують, використовуючи водяну баню, при температурі 37-38 °С.
Деколи у вірусологічній практиці використовують культури органів. Вони представляють собою виготовлені у стерильних умовах зрізи органів тварин, які протягом певного часу (дні, тижні) зберігають свою життєдіяльність в особливих умовахкультивування.
Длязараженнятканиннихкультурвикористовуютьмоношаровікультури. Зцією метою культуриклітини вирощуютьуфлаконах, пробірках, матрацах, якірозташовуються горизонтально, щоб клітини могли прикріпитись до скла. Перед зараженнямїхпроглядаютьпідмікроскопом, відбираютьпробірки, деєгарносформований моношар клітин. Для зараження використовують 6-8 пробірок і таку саму кількість зберігають для контролю. Безпосередньо перед експериментом змінюють живильне середовище у пробірках, промиваючи їх розчином Хенкса. Інокулюють у кожну пробірку0,2 млдосліджуваногоматеріалу, апотімінкубуютьутермостатіпритемпературі 37 °С протягом 1-2 год для адсорбції вірусів на поверхні клітин. Після цього видаляють матеріал, знову промивають культуру розчином Хенкса для видалення неприкріплених вірусів і токсичних субстратів і додають живильне середовище (середовище 199 або середовище Ігла з 2 % сироватки крові великої рогатої худобичигідролізатлактальбуміну). Пробіркикультивуютьутермостатіпри37 °С протягом 1-2 тижнів, постійно проглядаючи їх і фіксуючи результати.
Внаслідок розмноження вірусів у культурі клітин у них виникають дегенеративнізміни, якіпозначаються якцитопатичнадіявірусів(ЦПД). Ступіньїхвираження визначається видом вірусів, їх інфікуючою дозою, фізіологічними особливостями клітин тощо. В одних випадках ці зміни виникають через декілька днів після зараження (віруси поліомієліту, ЕСНО, грипу), в інших – через декілька тижнів і навіть місяців (аденовіруси, віруси гепатиту А). Для зараження найчастіше використовують дози вірусів, які дорівнюють 1000-10 000 ЦПД50 (ЦПД50 – така цитопатична доза вірусів, яка викликає дегенеративні зміни в 50 % пробірок, що містять заражені культури клітин).
Виявляти віруси в культурі тканин можна за феноменом бляшкоутворення. Останнім часом досліджують утворення бляшок під бентонітовим живильним покриттям. Попередньо готують десятикратні розведення досліджуваного матеріалу, яким заражають відповідні культури клітин. Після 30-хвилинної інкубації їх відмивають стерильним фіpозчином і заливають бентонітовим покриттям, яке міститьбентонітовийгель, розчинЕрла, нативнубичачусироватку, гідрокарбонат натрію, дистильовану воду і розчини антибіотиків для пригнічення сторонньої мікрофлори. Адсорбуючись на поверхні клітин, бентоніт надає моношару клітин молочного кольору. Внаслідок такого покриття репродукція вірусів обмежується тількипервинноінфікованими клітинами, аЦПДпроявляєтьсяформуванням вогнищ клітинної дегенерації у вигляді бляшок (див. вкл., рис. 97).
328 |
Частина ІV. Вірусологія |
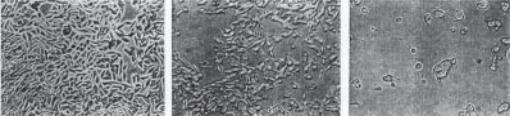
Заморфологічнимизмінамивкультуріклітинможнавиділитидекількатипів прояву цитопатичної дії. Її особливості дозволяють провести попередню діагностику захворювання (рис. 85).
При повній дегенерації клітинного моношару спостерігаються зміни в переважній більшості клітин. Вони гинуть, відокремлюються від скла. Окремі клітини, що залишаються живими, змінюють свою морфологію, в них помітний пікноз ядра і цитоплазми. Такий тип дії притаманний пікорнавірусам – вірусам поліомієліту, Коксаки, ЕСНО. Длячастковоїдегенераціїнехарактерневідокремленнявсіх клітин від скла.
Для збудників кору, епідемічного паротиту, парагрипу, респіраторно-синци- тіальних вірусів характернийсимпластоутворюючийтип ЦПД. При цьому виникають багатоядерні гігантські клітини (симпласти або синцитії). Аденовіруси викликаютьутворенняскупченьвеликихокруглихклітин, якінагадуютьгрона(круглоклітинна дегенерація). При репродукції риновірусів утворюються округлі клітини, які мають відростки, а при розмноженні герпесвірусів спостерігається формування подібних клітин однакового розміру, які розкидано по всьому моношарі. Онкогенні віруси стимулюють клітинну проліферацію (проліферативний тип змін), при якій спостерігається формування декількох шарів клітин.
Окремі віруси (віруси краснухи, кримської геморагічної гарячки) не здатні викликати видимих дегенеративних проявів з боку клітин. У таких випадках для їх виявлення використовують феномен інтерференції, при якому клітинні культури паралельно заражають іншими вірусами, здатними викликати ЦПД.
Ступіньвираженнядегенеративнихзміноцінюютьзачотири-плюсовоюсис- темою: (4+) – означає, що відбувається деструкція всіх клітин, (3+) – у 75 % їх, (2+) – у 50 %, (+) – до 25 % клітин, (+) – ЦПД проявляється в окремих клітинах.
Досить часто як прояв цитопатичної дії віруси утворюють внутрішньоклітинні включення. Вони можуть локалізуватись як внутрішньоядерно, так і в цитоплазмі клітин. Їх утворення, форма, величина, наявність у них вірусних нуклеїнових кислот є важливим моментом при проведенні вірусологічної діагностики захворювань. Такі включення утворюють віруси сказу (тільця Бабеша-Негрі), натуральної віспи (тільця Гварнієрі), простого герпесу (тільця Ліпшютца), аденовіруси, віруси грипу та інші.
1 2 3
Рис. 85. Цитопатична дія аденовірусів на клітини амніона людини:
1 – моношар клітин до зараження; 2 – початкова фаза дегенерації; 3 – кінцева фаза дегенерації.
Розділ 12. Будова і класифікація вірусів |
329 |
Включення виявляють при світловій мікроскопії, фарбуючи препарати за допомогою методу Романовського-Гімзи. З цією метою культури клітин спочатку вирощують на спеціальних скляних пластинках або пластинках із прозорої слюди. Пізніше, після одержання моношару клітин, їх заражують досліджуваним матеріалом, що містить віруси, і через деякий час забарвлюють отримані культури.
Часто для виявлення включень використовують метод імунофлуоресценції. При цьому препарати обробляють специфічними противірусними сироватками, кон’югованими з флуорохромами. В ультрафіолетових променях люмінесцентного мікроскопа включення світяться характерним кольором. Можна довести наявність включень у матеріалі (біоптати) за допомогою електронної мікроскопії, яка дозволяє дослідити тонку структуру цих утворень, виявити окремі віріони.
Часто для виявлення внутрішньоядерних або внутрішньоцитоплазматичних включеньвикористовуютьвідбиткитканинабоорганів, зскрібкиклітинабогістологічні зрізи із тканин загиблих.
Методи ідентифікації вірусів
Важливим етапом лабораторної діагностики будь-якої вірусної інфекції є виявленнятатипуваннявірусівудосліджуваному матеріалі, якепередбачаєвикористання специфічних противірусних сироваток.
Реакціягальмуваннягемаглютинації(РГГА). Реакціябазуєтьсяназдатності блокуватигемаглютинуючівластивостівірусівзадопомогоюспецифічнихантитіл. У результаті цього спостерігається затримка аглютинації еритроцитів.
Компонентамиреакціїєневідоміантигени(вірусмісткийматеріал), якийможе бути збагачений пасажами в культурі клітин, лабораторних тваринах або курячому ембріоні, специфічні імунні противірусні (або проти окремих вірусних антигенів) сироватки, еритроцити. Для розведення компонентів реакції використову- ютьзабуференийфізіологічнийрозчин(рН7,2-7,4). Еритроцитиотримуютьізкрові птахів(кури, гуси), ссавців(гвінейськісвинки), людини(0 група). Їхтричіпромивають у стерильному фізіологічному розчині та зберігають у вигляді 0,5-1,0 % суспензії. З метою їх стабілізації еритроцити попередньо обробляють формаліном або глутаровим чи акриловим альдегідом.
Імунні сироватки попередньо позбавляють неспецифічних інгібіторів, прогріваючи при температурі 56 °С протягом 30 хв (для видалення термолабільних інгібіторів) або обробляючи розчинами перйодату калію чи натрію, бентонітом, каоліном, етакридину лактатом та іншими.
Реакцію ставлять у пробірках або спеціальних полістиролових планшетах з луночками. Постановці реакції передує визначення активності вірусного антигена, який титрують за допомогою РГА. У досліді використовують робочу дозу антигена, яка дорівнює від 4 до 8 ГАО (ГАО – гемаглютинуюча одиниця – максимальнерозведенняантигена, якеповністюаглютинуєстандартнусуспензіюеритроцитів). Позитивною реакцією вважають утворення червоного зернистого з нерівними краями осаду, який дифузно розташовується на дні пробірки. Про не-
330 |
Частина ІV. Вірусологія |
гативний результат свідчить наявність компактного осаду у вигляді “ґудзика” на дні пробірки або лунки, який може стікати при її нахиленні. При частковій аглютинації утворюється осад у вигляді кільця (див. вкл., рис. 27).
Дляпостановкиреакціїзметоювизначенняневідомоговірусуабойогоантигенів у буферному розчині (0,2) роблять двократні розведення імунної сироватки (вихідне розведення 1:10), а потім додають невідомий антиген в об’ємі 0,2 мл (4-8 ГАО). Систему інкубують залежно від властивостей вірусу при температурі 4 °С, 18 °С, 37 °С 1-18 год. Потім до комплексу додають подвійний об’єм зависі еритроцитів. Пробірки або пластини інкубують протягом 1-3 год при тій самій температурідоповногоосіданняеритроцитівіоцінюютьрезультати. Реакціювважають позитивною при відсутності аглютинації еритроцитів. РГГА широко використовують для ідентифікації вірусів грипу, паротиту, енцефалітів та ін.
Реакція гальмування гемадсорбції (РГГадс ). Принцип реакції базується на явищі гемадсорбції. Воно полягає в тому, що еритроцити набувають здатності адсорбуватись на поверхні культур клітин, які зазнали модифікації внаслідок появи в оболонці глікопротеїнів вірусів. Антитіла імунної сироватки при взаємодії з поверхневими антигенами вірусів, представленими воболонці, зв’язуютьїх, внаслідок чого гальмується адсорбція еритроцитів на клітинах.
Компонентами реакції є віруси, здатні до гемадсорбції, культура клітин, в якій вони розвиваються, противірусна сироватка з розведенням 1:10 і більше, 0,4-1,0 % зависьеритроцитівпівня, гвінейськоїсвинкиаболюдини, тричівідмита фізіологічним розчином або розчином Хенкса. Специфічні сироватки, які використовують у досліді, попередньо обробляють ферментами, які руйнують рецептори, піддають температурному впливу, щоб звільнити від неспецифічних інгібіторів гемаглютинації.
Реакціюставлятьупробіркахабонаспеціальнихсклянихпластинах, наяких є моношар культури клітин. Одна з переваг РГГадс полягає в тому, що її можна ставити до появи цитопатичного ефекту.
Попередньо заражають культуру клітин вірусмістким матеріалом та інкубують протягом деякого часу залежно від властивостей вірусу. Як контроль використовуютькультуру клітин, неінфіковану вірусами. Безпосередньо переддослідом з пробірок видаляють живильне середовище, відмивають клітини від баластних речовин (білків) розчином Хенкса. У кожну дослідну пробірку додають по 0,6 мл розчину Хенкса і по 0,2 мл противірусної сироватки. У контрольні пробірки вносятьпо0,8 млрозчинуХенксатанеімуннусироватку тварин. Пробіркиінкубують нахиленими, щобживильнесередовищеісироваткаомиваликлітини, прикімнатній температурі протягом 15-30 хв. Потім в усі пробірки додають по 0,2 мл 0,4 % зависі еритроцитів, інкубують ще 20-30 хв при кімнатній температурі. Після цього пробірки обережно обертають в долонях 5-10 разів для ресуспендування еритроцитів та видалення їх з моношару культур клітин. Розглядаючи пробірки під малим збільшенням мікроскопа, звертають увагу на наявність чи відсутність адсорбціїеритроцитівнаповерхніклітин. ПрипозитивнійРГГадс еритроцитивільно плаваютьуживильномусередовищі, принегативній– вониадсорбуютьсянакліти-
