
- •Органічний синтез навчальна практика
- •Імені івана кожедуба
- •2 Тематичний план.
- •Тема 1.1 Організація роботи і техніка безпеки.
- •1 Тематичний план
- •2 Зміст робочої навчальної програми дисципліни
- •Лист-погодження робочої навчальної програми з іншими дисциплінами спеціальності
- •Індивідуальні завдання студентам
- •Зведені дані
- •Список літератури Основна
- •Додаткова
- •Доповнення та зміни до робочої навчальної програми дисципліни на 2008 /2009 навчальний рік
- •1 Вступ
- •2 Розділ 1 Методи роботи з органічного синтезу. Значення практичних знань з органічного синтезу. Значення органічного синтезу при вивченні профілюючих предметів
- •3 Тема 1.1 Організація роботи і техніка безпеки
- •3.1 Загальні правила роботи в лабораторії органічного синтезу
- •3.2 Перша допомога при опіках, отруєні та уражені електричним струмом
- •3.2 Тушіння місцевих загорянь та спалахнулого одягу
- •3.3 Робота з токсичними речовинами
- •3.3 Робота з легкоспалахуючими та вибухонебезпечними речовинами
- •3.4 Правила користування склом
- •3. 5 Основний лабораторний хімічний посуд
- •3.5 Збирання приладів
- •3.6 Правила оформлення звіту
- •3.7 Користування літературою
- •4 Тема 1.2 Основні методи очищення і розділення органічних речовин.
- •4.1 Кристалізація. Вибір розчинників. Перекристалізація. Відділення кристалів
- •4.2 Сублімація.
- •4.3 Перегонка, її види. Перегонка за атмосферного тиску
4.2 Сублімація.
Сублімація (возгонка)- це процес випаровування твердої речовини з наступною конденсацією її пари у твердий стан, минаючи рідкий.
Цим способом користуються для очищення твердих речовин, маючих достатньо великий тиск пара при порівняно невеликій температурі. Возгонка приміняється особливо у тих випадках, коли очищення твердої органічної речовини від смольних сумішей шляхом кристалізації не досягає мети. Частіше всього возгонка - відносно повільний процес. Швидкість возгонки прямопропорційна тиску пара речовини при даній температурі і зворотньопропорційна зовнішньому тиску в приборі. Чим менша різниця між зовнішнім тиском і тиском пари речовини, тим швидше возгонка. Крім того швидкість возгонки прямо пропорційна величині поверхні випаровуваної речовини і тому препарат треба дуже тонко змільчувати.
Речовини, що мають відносно високий тиск пара, при нагріванні можуть набувати тиск пара, що рівний атмосферному, при температурі, яка знаходиться нижче температури плавлення. Температура плавлення при нагріванні цих речовий не досягається, вони переходять в пароподібний стан. Температура, при якій тиск пара над твердою речовиною дорівнює зовнішньому тиску, називається температурою возгонки.
Возгонка проводиться як при атмосферному тиску, так і у вакуумі. Для возгонки при атмосферному тиску речовини помішують в невелику фарфорову чашку, покривають її шматком фільтрувального паперу з отвором, потім накривають фарфорову чашку перевернутою скляною воронкою. Відвідну трубку воронки закривають тампоном з скляної вати. Чашку з речовиною нагрівають на маленькому полум'ї горілки чи на піщаній бані. Для охолодження на зовнішню поверхню воронки розміщують кусочок вологої вати або тканини.
При возгонці у вакуумі, знижуючи тиск, можна добитися, щоб і в тих речовин, які при звичайному тиску плавляться, температура возгонки була нижче температури плавлення.
Рекомендується очищати возгонкою у вакуумі бензойну, щавелеву кислоти, алізарин тощо.
4.3 Перегонка, її види. Перегонка за атмосферного тиску
Одним з найважливіших методів очищення й внделения органічних речовин є перегонка, що є процесом розділенням рідкої суміші речовин, що відрізняються за температурами кипіння, на складові частини шляхом нагрівання рідини до кипіння й конденсації її пари у вигляді дистиляту в холодильнику.
Перегонка - це процес розділення рідкої суміші на окремі компоненти, внаслідок нагрівання суміші до кипіння і конденсації її парів у холодильнику у вигляді дистиляту.
Над всіма рідинами в результаті їх випаровування установлюється рівновага між рідиною й парою, а відповідно, й певний тиск пари. Величина цього тиску залежить від природи рідини й температури.
З підвищеннямтемператури тиск пари над рідиною сильно зростає.
Температуру, при який тиск пари стає рівнимзовнішньомутиску, назнваютьтемпературою кипіння. Будь-яка рідина, що не розкладається при нагріванні до температури, при якій тиск пари стає рівним 0,1 МПа, має свою характерну температуру кипіння. Оскільки температура кипіння сильно залежить відтиску, завжди требавказивати тиск, при якомуцятемпературакипіння спостерігалася. Якщо тиск не вказаний, то мається на увазі атмосфернийтиск.
Домішки, що містяться в речовині, можуть по-різному впливати на температуру кипіння, тому вона менш придатна для ідентификаціїрідин й характеристики їх чистоти, чим температура плавлення для твердих речовин.
Проста перегонка при атмосферному тиску
У тих випадках, коли речовина, що перегоняється, достатньостійкадо нагрівання й практично не розкладається при температурікипіння, для очищення користуються простою перегонкою при атмосферному тиску.
Вона застосовується в наступних випадках:
для перевірки чистоти речовини за допомогою визначення температури кипіння й інтервалу температури кипіння. Чисті речовини перегоняться в інтервалі 1—2°. Для ідентифікації речовини знайдене значення температури кипіння порівнюють з температурою кипіння (при тому ж тиску)цієїречовини, приведеною в довідковій або оригінальній літературі;
для відділення рідини від розчиненихуній твердих або нелетких речовин;
для розділення сумішей рідин, температури кипіння якихрозрізняються більш, чим на 80 °С.
Звичайноцейспосіб перегонки доцільно застосовувати для рідин з температурою кипіння до 180 °С, оскільки вище 180 °С багато речовин помітно розкладаються. Часто при перегонці температура киплячої рідини у наслідок перегрівудещовище,ніжтемпература пари. Перегріви, виникаючі за відсутності центрів кипіння в рідині, що перегоняється, призводятьдо сильнихпоштовхів, в результатіякихречовинаразомз домішками й забрудненнями може бути перекинутав приймач. Існують різніспособи запобігання абопослаблення поштовхів при кипінні. Найчастішеуколбу з рідиною, що піддається перегонці, вносять такзвані«кіпелки». Як перегіннусудинузвичайновживають круглодонніколби для перегонки. Для перегонки низькокиплячих рідин беруть колбу з високо припаяною відвідною трубкою, для висококиплячих — з низько припаяною. Температура кипіннязвичайноконтролюється термометром, ртутний кулька якого винна повністю омиваться парами киплячоїречовини, тобто верхній край кульки слід встановлювати приблизно на 0,5 см нижче отвори відвідної трубки колби.
Величину перегінної колби вибирають залежно від кількості рідини, що перегониться, і від температури її кипіння. Рідина повинна займати не більше 2/3об'єму колби. Колба не повинна бути дуже великою, особливо при перегонці висококиплячих рідин, оскільки в ній залишається велика кількість речовини, що перегониться.
Колбу укріплюють в штативі, затискаючи її лапкою вище за відвідну трубку. Щоб уникнути забруднення речовини дистилят повинен по можливості менше стикатися з пробками, тому відвідну трубку перегінної колби сполучають з холодильником так, щоб кінець її виступав з пробки в холодильник не менше ніж на 4—5 см і доходив до тієї частини холодильника, яка охолоджується водою. Розмір холодильника вибирають залежно від швидкості перегонки і температури кипіння рідини, що відгониться.
Пари речовин, що легко кристалізуються закімнатноїтемператури, не повинні охолоджуватися в холодильнику до температури твердіння. Для цього холодильник можна періодично відключати від проточної води.
Рідини, киплячі в межах 200—300°С, перегонять без холодильника, функцію якого в цьому випадку може виконувати відвідна трубка колби для перегонки. Холодильник сполучають з приймачем за допомогою алонжа. Як приймач звичайно вживають конічні або плоскодонні колби. Для повнішої конденсації пари низькокиплячих рідин приймач поміщають в судину з охолоджуваною сумішшю.
Коли весь прилад зібраний, його ретельно перевіряють і лише тоді починають нагрівання. Залежно від температури кипіння нагрівання ведуть газовим пальником через азбестову сітку, на закритому електронагрівальному приладі або на лазні. Швидкість перегонки звичайно вибирають таку, щоб стікали не більше 1—2 крапель дистиляту в секунду.
У багатьох роботах часто доводиться спочатку відігнати легкокиплячий розчинник. Цю операцію слід проводити на водяній лазні, оскільки більшість розчинників вогненебезпечні, а також для того, щоб речовину не піддавати зайвий раз термічній дії, якщо в цьому немає необхідності. Після отгонки розчинника кидають в охолоджену колбу декілька «кипілок» і проводять перегонку речовини звичайним способом.
Фракційна (дрібна) перегонка
При простій перегонці у міру випаровування суміші (якщо суміш складається з двох компонентів) вміст низькокиплячого компоненту упарах, що відходять, безперервно зменшується, максимальнийвміст низькокиплячого компоненту в них — в початковий момент перегонки. При цьому можна одержати декілька фракцій різного складу, роздільно збираючиїх.
Способ перегонки з розділенням суміші на декілька фракцій, в різному ступені збагачених низькокиплячим компонентом, називається фракційною перегонкою.
У основі теорії фракційної перегонки лежать два закони фазової рівноваги в системі рідина — пара, розроблені в 1881—1884 рр. Д. П. Коноваловим.
Закони Коновалова в сучасному формулюванні читаються так:
У подвійній рідкій системі пар відносно багатше тим компонентом, збільшення якого підвищує загальний тиск пари.
Максимуму або мінімуму тиску пара подвійної рідкої системи відповідає рідка суміш, насичена пара якої володіє однаковим з нею складом.
Із законів Коновалова витікають два слідства:
У подвійній рідкій системі пар відносно багатшийтим компонентом, збільшення якого знижує температуру кипіння.
Максимуму або мінімуму температури кипіння подвійної рідкої системи відповідають рідина і пара з однаковим якісним і кількісним складом.
Суміші рідин, що повністю змішуються, розділяються на два класи. Суміші першого класу можуть бути розділені на чисті компоненти, вони не утворюють нероздільно киплячих сумішей.
Суміші другого класу утворюють нероздільно киплячі суміші, які, не дивлячись на різні температури кипіння чистих речовин, не можуть бути розділені перегонкою на чисті компоненти.
Для збільшення ефективності розділення суміші і зменшення числа перегонок слід користуватися дефлегматорами.
Як проста, так і фракційна, перегонки не дають можливості провести повне розділення компонентів суміші й отримати їх у чистому вигляді. Для досягнення найбільш повного розділення компонентів використовують ректифікацію.
Ректифікація– багаторазова дистиляція, що проводиться при протитоці пари й рідини.
Для ректифікації використовуються лабораторні ректифікаційні колонки різних конструкцій, що приєднуються до перегонної колби.
Також використовуються інші методи очищення органічних речовин:
Екстракція - процес, заснований на різному розчинені речовин в обраному розчиннику або в двох не змішуваних розчинниках, внаслідок чого очищена речовина екстрагується із суміші.
Для екстракції органічних речовин з водних розчинів та розділення рідин, що не змішуються, використовується ділильна воронка різноманітної форми.
Для екстракції твердих речовин використовується апарат Сокслета.
У лабораторії досить часто доводиться проводити екстрагуваннятвердихречовин. Дляцієїметивикористовуютьтакзвані апаратиСокслета.Апарат складається з круглодонної колби, екстрактора й оборотного холодильника. До колби з розчинником приєднують екстрактор, в которийвводятьекстрагуємуречовину,щільнозавернутуу фільтрувальний папір або поміщенууспеціальну гільзу. Розчинникуколбі нагрівають на водяній лазні до кипіння. Парайого через паровідвідну трубкунадходитьуекстрактор, а потімухолодильник, де конденсується. Конденсат стікаєугільзу ізекстрагуємоюречовиною,видаляєнеобхідне з'єднання й через трубку для відведенняекстрактупереливається назадуколбу. Прицьомувідбувається поступове накопичення витягнутої речовини в колбі, причому кількість рідини практично не змінюється.Цедозволяєобмеженимобє’мом розчинника витягнути необмежену кількістьекстрагуємоїречовини, оскільки воно весь час обробляється чистим розчинником. Після закінченняекстракции відгонять розчинник.

Рисунок – Апарат Сокслета
1 — круглодонная колба; 2— гильза; З — трубка для стоку екстракта; 4 — екстрактор; 5 — пароовідводна трубка; 6—обратний холодильник

Рисунок – Прибор для непрерервної екстракції розчинів
1 – круглодонна колба, 2 – пробірка, 3 – паравідводна трубка, 4 – воронка, 5 – оборотний холодильник,
А – розчинник, В – розчин, що екстрагується.
Хроматографія- процес розділення компонентів суміші на основі різниці у рівномірному розподіленні їх руху поміж двох фаз, що не змішуються; де одна рухома, а інша - нерухома.
Хроматографічне розділення можливе лише у тому випадку, якщо компоненти зразка будуть розчинятися у рухомій фазі та будуть взаємодіяти з нерухомою фазою. В основі цієї взаємодії лежать сорбційні процеси. Хроматографічні методи розділяються за механізмом взаємодії між фазами, за технікою експерименту, агрегатному стану рухомої та нерухомої фаз. За агрегатним станом рухомої фази хроматографію ділять на газову та рідинну.
ЛІТЕРАТУРА:
1. Храмкииа М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. С 9 – 82.
2. Храмкииа М.Н. Практикум по органическому синтезу.- М.: Химия, 1974.
3. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
4. Потапов В.М., Татаринчик С.Н. Органическая химия. М.: Химия,1980.
5. Аверина А.В. Лабораторный практикум по органической химии.- М.: Высш.шк., 1980.
6. Березан О.М.Органічна хімія.- К.: Абрис, 2000.
7. Липатников В.Е. Лабораторные работы по неорганической и органической химии.- М.: Высш.шк., 1981.
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ХІМІКО-ТЕХНОЛОГІЧНИЙ КОЛЕДЖ ІМЕНІ ІВАНА КОЖЕДУБА
ШОСТКИНСЬКОГО ІНСТИТУТУ
СУМСЬКОГО ДЕРЖАВНОГО УНІВЕРСИТЕТУ
ЗАТВЕРДЖУЮ
Заступник директора
з навчальної роботи
_______О.О.Лапінська
«___»_______ 200 р.
МЕТОДИЧНЕ ЗАБЕЗПЕЧЕННЯ
НАВЧАЛЬНА ПРАКТИКА
ОРГАНІЧНИЙ СИНТЕЗ
СПЕЦІАЛЬНОСТІ: 5.091617, 5.091618
Розглянуто і схвалено на засіданні Складено викладачем
Циклової комісії загально-хімічних дисциплін
Протокол №____від_______________200 р. ____ Г.І.Кокшайкиною
Голова циклової комісії
_____________ Г.І.Кокшайкина
ПЕРЕЛІК ЛАБОРАТОРНИХ РОБІТ З ОРГАНІЧНОГО СИНТЕЗУ
Методи очищення і розділення органічних речовин
Лабораторна робота 1 Очищення фталевої кислоти методом перекристалізації 4
Лабораторна робота 2 Очищення бензойної кислоти методом возгонки 6
Реакції галогенування
Лабораторна робота 3 Одержаннябромистого етилу 8
Реакції ацілювання
Лабораторна робота 4 Одержання етилацетату 11
Лабораторна робота 5 Одержанняетилбензоату 13
Лабораторна робота 6 Одержанняетилхлорацетату 15
Реакції окиснення
Лабораторна робота 7 Одержання бензойної кислоти 17
Лабораторна робота 8 Одержанняацетальдегіду 20
Реакції нітрування
Лабораторна робота 9 Одержання нітробензолу 22
Лабораторна робота 10 Одержання α – нітронафталіну 24
Реакції сульфування
Лабораторна робота 11 Одержання п – толуолсульфокислоти 26
Лабораторна робота 12 Одержання сульфанілової кислоти 29
Реакції діазотування і азосполучення.
Лабораторна робота 13 Одержання діазобензолу 31
Лабораторна робота 14 Одержання п – аміноазобензолу 34
Лабораторна робота 15 Одержання фенолфталеїну та флуоресцеїну 37
Реакції алкілування
Лабораторна робота 16 Одержання нероліну 40
Лабораторна робота 17 Одержаннядіізоамілового етеру 43
Реакції конденсації карбонільних сполук
Лабораторна робота 18 Одержання ацетооцтового естеру 46
Лабораторна робота 19 Одержання бензойної кислоти та бензилового спирту 49
Реакції полімеризації і поліконденсації
Лабораторна робота 20 Одержання фенолоформальдегідної смоли 52
Лабораторна робота 20 Одержання гліфталевої смоли 54
Звіт з лабораторної роботи повинен містити:
Тему роботи – у відомості документів
Мету роботи
Питання техніки безпеки – правила охорони праці
Опорні теоретичні питання теми
Зміст і послідовність виконання завдань – рисунок, короткий зміст роботи, розрахунки, рівняння реакції, спостереження, таблиці, графіки тощо
Висновки з роботи
Критерії оцінювання лабораторної роботи:
Оцінка «3» – оформлення лабораторної роботи згідно вимог, задовільна оцінка тематичного оцінювання;
Оцінка «4» – оформлення лабораторної роботи згідно вимог, добра оцінка тематичного оцінювання,
85% правильних відповідей на питання захисту роботи;
Оцінка «5» – оформлення лабораторної роботи згідно вимог, відмінна оцінка тематичного оцінювання, 85% правильних відповідей на питання захисту роботи, 85% правильних відповідей на питання завдань для самостійної роботи.
ВСТУПНИЙ ІНСТРУКТАЖ З БЕЗПЕКИ ЖИТТЄДІЯЛЬНОСТІ
ПРИ ПРОВЕДЕННІ ЛАБОРАТОРНИХ РОБІТ
При всіх роботах необхідно дотримуватись обережності, пам’ятаючи, що неуважність, неохайність, недостатнє знання властивостей речовин, з якими ведеться робота, може призвести до нещасних випадків.
При роботі з металічним натрієм необхідно брати його пінцетом; різати натрій на фільтровальному папері сухим ножем, одразу прибирати його в спеціальні склянки, де він зберігається під шаром гасу.
Якщо при проведенні досліду розбився термометр та розлилась ртуть, її необхідно зібрати ловушкою. Поверхню, на якій була ртуть, змочують 20% розчином хлориду феруму (ІІІ).
Нагрівати рідину в пробірці необхідно поступово, при цьому направляти отвір пробірки в сторону від себе і від працюючих поряд, тому що внаслідок часткового перегріву може відбутися викид рідини.
Не нахилятись над пробіркою, в якій кипить рідина.
Нюхати будь – які речовини в лабораторії необхідно, направляючи до себе пари або гази рухом руки.
Ніяких речовин в лабораторії не пробувати на смак.
Всі досліди з речовинами, які мають неприємний запах, а також отруйними (анілін, бром тощо) проводити в витяжній шафі.
Розчиняти сульфатну кислоту в воді, доливаючи кислоту до води по краплям, весь час перемішуючи розчин.
Розлиті кислоти або основи засипати піском, нейтралізувати і тільки після цього проводити прибирання.
Осколки розбитого скла збирати за допомогою щітки та совка.
Роботу з легкозаймистими речовинами (етер, бензол, етанол тощо) проводити далі від полум’я.
При роботі з газовідводною трубкою прибирати пальник з – під пробірки можна лише тоді, коли кінець газовідводної трубки, який занурений у рідину, видалений з неї. Якщо прибрати пальник передчасно, то рідина засмокчеться в реакційну пробірку і може відбутися розбризкування реакційної суміші на обличчя та руки.
ЗАХОДИ ПЕРШОЇ ДОПОМОГИ ПРИ НЕЩАСНИХ ВИПАДКАХ
При термічних опіках місце необхідно змочити 2% розчином калій перманганату.
При хімічних опіках необхідно видалити зі шкири речовини, які визивають опіки та обробити місце таким чином:
при опіках кислотами або основами промивають опечене місце сильним струменем води, а потім нейтралізують кислоту 1% розчином гідрокарбонату натрію, а основу – 1% розчином оцтової кислоти,
при опіках рідким фенолом побілілу ділянку шкіри розтирають гліцерином, поки не відновиться її нормальний колір, обмивають водою, накладають марлю, змочену гліцерином.
При хімічних опіках очей кислотами або основами необхідно промити очі водою, використовуючи спеціальну ванночку, потім 1% NaHCO3 або 2% СН3СООН.
При порізах видаляють пінцетом із рани осколки скла, змазують краї рани спиртовим розчином йоду та, положивши на рану стерильну пов’язку, забинтовують рану.
Про будь – який самий незначний нещасний випадок необхідно сказати викладачу.
ІНСТРУКЦІЙНА КАРТКА ДЛЯ ПРОВЕДЕННЯ ЛАБОРАТОРНОГО ЗАНЯТТЯ
З НАВЧАЛЬНОЇ ПРАКТИКИ «ОРГАНІЧНИЙ СИНТЕЗ»
ТЕМА:Очищення фталевої кислоти С6Н4(СООН)2 методом перекристалізації
РОБОЧЕ МІСЦЕ: ХІМІЧНІ ЛАБОРАТОРІЇ ХТК ТРИВАЛІСТЬ ЗАНЯТТЯ: 1 ГОДИНА
МЕТА ПРОВЕДЕННЯ ЗАНЯТТЯ:
ЗАКРІПЛЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ З ТЕМИ,
ПІДТВЕРДЖЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ ПРИ ВИКОНАННІ ЛАБОРАТОРНИХ ДОСЛІДІВ;
ОВОЛОДІННЯ МЕТОДОМ ОЧИЩЕННЯ.
МАТЕРІАЛЬНО-ТЕХНІЧНЕ ОСНАЩЕННЯ РОБОЧОГО МІСЦЯ:
Неочищена фталева кислота, 2 н розчин їдкого натру, 2 н розчин сульфатної кислоти, склянки, колби, палички, воронки, чашки Петрі,технічні ваги, мікроскоп.
ПРАВИЛА ОХОРОНИ ПРАЦІ:
Дотримуватися обережності при поводженні з хімічними реактивами, скляним посудом, електричним нагрівальним приладом.
Методи очищення органічних речовин
Головним завданням органічного синтезу є одержання чистих речовин.
Для цього використовують основні методи очищення:
перекристалізація; перегонка; сублімація; екстракція; хроматографія.
Перекристалізація- процес розчинення неочищеної речовини в гарячому розчиннику, відфільтровуванні гарячого розчину від зважених частин і охолодженні його, внаслідок чого очищена речовина викристалізовується. Цей метод економічно невигідний, так як дає великі втрати речовини.
Перегонка - це процес розділення рідкої суміші на окремі компоненти, внаслідок нагрівання суміші до кипіння і конденсації її парівухолодильнику у вигляді дистиляту.
Сублімація (возгонка)- це процес випаровування твердої речовини знаступноюконденсацією її париу твердий стан, минаючи рідкий.
Екстракція - процес, заснований на різному розчинені речовин в обраному розчиннику або в двох не змішуваних розчинниках, внаслідок чого очищена речовина екстрагується із суміші. Для екстракції використовується апарат Сокслета.
Хроматографія- процес розділення компонентів суміші на основі різниці у рівномірному розподіленні їх руху поміж двох не змішуваних фаз, де одна рухома, а інша - нерухома.
ЗМІСТ І ПОСЛІДОВНІСТЬ ВИКОНАННЯ ЗАВДАНЬ:
На технічних вагах береться наважка неочищеної фталевої кислоти в кількості 3 грам. Переноситься кислота до склянки та додається 20 мл 2н розчину їдкого натру.
Відфільтровується розчин від механічних домішок.
До отриманого фільтрату додається 20 мл 2 н розчину сульфатної кислоти.
Кристали, шо випали, відфільтровуються та переносяться до склянки з 30 мл води.
Отриманий розчин доводиться до кипіння та залишається на повільну кристалізацію.
Кристали, шо випали, відфільтровуються, сушаться на повітрі та підраховується відсоток домішок у цьому зразку фталевої кислоти, та робиться висновок.
Основні реакції



 СООН + 2NaOH
---► COONa
+ 2H2O
СООН + 2NaOH
---► COONa
+ 2H2O
СООН COONa



 СООNa
+ H2SO4---►
COOН
+ Na2SO4
СООNa
+ H2SO4---►
COOН
+ Na2SO4
СООNa COOН
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ЩОДО ВИКОНАННЯ Й ОФОРМЛЕННЯ:
При виконанні дослідів строго дотримуватися кількості реагентів та методики виконання роботи, які вказані в інструкції, а також заходів техніки безпеки.
Розрахувати процент домішок у фталевій кислоті.
По закінченню роботи зробити загальний висновок.
ПІСЛЯ ВИКОНАННЯ ЛАБОРАТОРНОЇ РОБОТИ СТУДЕНТ ПОВИНЕН:
ЗНАТИ:
Основні методи очищення органічних речовин
Умови проведення процесу
Обладнання, що використовується для очищення
Рівняння хімічних процесів, що відбуваються при очищенні
Фізико – хімічні властивості та використання речовин
УМІТИ:
Провести необхідні досліди.
Працювати самостійно згідно інструкції.
Невідступно дотримуватись заходів техніки безпеки.
Провести розрахунок домішок
Знайти необхідні довідникові дані в довіднику
ЗАХИСТ РОБОТИ:
Визначити методи очищення і розділення органічних речовин.
Визначити метод перекристалізації.
Хід проведення процесу. Техніка безпеки
Визначити умови до проведення перекристалізації, вибору розчинників, та відділення кристалів.
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ:
Пояснити вибір умов охолодження гарячого розчину при проведенні перекристалізації.
Як визначається чистота одержаної при кристалізації речовини?
Пояснити вимоги до вибору розчинника.
ЛІТЕРАТУРА
1. Храмкина М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. С 51 – 55.
2. Храмкина М.Н. Практикум по органическому синтезу.- М.: Химия, 1974.
3. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
4. Потапов В.М., Татаринчик С.Н. Органическая химия. М.: Химия,1980.
5. Аверина А.В. Лабораторный практикум по органической химии.- М.: Высш.шк., 1980.
6. Березан О.М.Органічна хімія.- К.: Абрис, 2000.
ІНСТРУКЦІЙНА КАРТКА ДЛЯ ПРОВЕДЕННЯ ЛАБОРАТОРНОГО ЗАНЯТТЯ
З НАВЧАЛЬНОЇ ПРАКТИКИ «ОРГАНІЧНИЙ СИНТЕЗ»
ТЕМА:Очищення бензойної кислоти С6Н5СООН методом возгонки
РОБОЧЕ МІСЦЕ: ХІМІЧНІ ЛАБОРАТОРІЇ ХТК ТРИВАЛІСТЬ ЗАНЯТТЯ: 1 ГОДИНА
МЕТА ПРОВЕДЕННЯ ЗАНЯТТЯ:
ЗАКРІПЛЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ З ТЕМИ,
ПІДТВЕРДЖЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ ПРИ ВИКОНАННІ ЛАБОРАТОРНИХ ДОСЛІДІВ;
ОВОЛОДІННЯ МЕТОДОМ ОЧИЩЕННЯ.
МАТЕРІАЛЬНО-ТЕХНІЧНЕ ОСНАЩЕННЯ РОБОЧОГО МІСЦЯ:
Неочищена бензойнакислота, 2 н розчин їдкого натру, 2 н розчин сульфатної кислоти, склянки, колби, палички, воронки, чашки Петрі,технічні ваги, мікроскоп.
ПРАВИЛА ОХОРОНИ ПРАЦІ:
Дотримуватися обережності при поводженні з хімічними реактивами, скляним посудом, електричним нагрівальним приладом.
Методи очищення органічних речовин
Головною задачею органічного синтезу є одержання чистих речовин.
Для цього використовують основні методи очищення:
перекристалізація; перегонка; сублімація; екстракція; хроматографія.
Перекристалізація- процес розчинення неочищеної речовини в гарячому розчиннику, відфільтровуванні гарячого розчину від зважених частин і охолодженні його, внаслідок чого очищена речовина викристалізовується. Цей метод економічно невигідний, так як дає великі втрати речовини.
Перегонка - це процес розділення рідкої суміші на окремі компоненти, внаслідок нагрівання суміші до кипіння і конденсації її парівухолодильнику у вигляді дистиляту.
Сублімація (возгонка)- це процес випаровування твердої речовини знаступноюконденсацією її париу твердий стан, минаючи рідкий.
Екстракція - процес, заснований на різному розчинені речовин в обраному розчиннику або в двох не змішуваних розчинниках, внаслідок чого очищена речовина екстрагується із суміші. Для екстракції використовується апарат Сокслета.
Хроматографія- процес розділення компонентів суміші на основі різниці у рівномірному розподіленні їх руху поміж двох не змішуваних фаз, де одна рухома, а інша - нерухома.
ЗМІСТ І ПОСЛІДОВНІСТЬ ВИКОНАННЯ ЗАВДАНЬ:
1. Для возгонкизаатмосферноготиску на технічних вагах беретьсянаважканеочищеної бензойної кислоти в кількості 1 грам.
2 Поміщаєтьсянаважкав невелику фарфорову чашку (рис.1), накриваєтьсяшматком фільтрувального паперу з отвором, потім накриваєтьсяперевернутою скляною воронкою.
Трубкаворонки накриваєтьсятампоном зімокроївати або фільтрувального паперу.
3 Чашказ речовиною нагріваєтьсяна полум'їпальникаабо пісчаної бані.
4 Очищенаречовиназважується, робитьсярозрахунок та висновок.

пальник;
фарфорова чашка;
воронка.
Рисунок 1 – Прилад для возгонки за атмосферного тиску
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ЩОДО ВИКОНАННЯ Й ОФОРМЛЕННЯ:
При виконанні дослідів строго дотримуватися кількості реагентів та методики виконання роботи, які вказані в інструкції, а також заходів техніки безпеки.
Розрахувати процент домішок у бензойній кислоті.
По закінченню роботи зробити загальний висновок.
ПІСЛЯ ВИКОНАННЯ ЛАБОРАТОРНОЇ РОБОТИ СТУДЕНТ ПОВИНЕН:
ЗНАТИ:
Основні методи очищення органічних речовин
Умови проведення процесу
Обладнання, що використовується для очищення
Фізико – хімічні властивості та використання речовин
УМІТИ:
Провести необхідні досліди.
Працювати самостійно згідно інструкції.
Невідступно дотримуватись заходів техніки безпеки.
Провести розрахунок домішок
Знайти необхідні довідникові дані в довіднику
ЗАХИСТ РОБОТИ:
Визначити методи очищення і розділення органічних речовин.
Визначити метод возгонки.
Визначити умови до проведення возгонки за атмосферного тиску та у вакуумі.
Заходи техніки безпеки процесу.
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ:
Пояснити використання процесу перегонки.
Назвати види перегонки.
Коли використовується проста перегонка при атмосферному тиску?
Яку частину об’єму колби повинна займати рідина при перегонці?
ЛІТЕРАТУРА
1. Храмкина М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. С 55 – 56.
2. Храмкина М.Н. Практикум по органическому синтезу.- М.: Химия, 1974.
3. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
4. Потапов В.М., Татаринчик С.Н. Органическая химия. М.: Химия,1980.
5. Аверина А.В. Лабораторный практикум по органической химии.- М.: Высш.шк., 1980.
6. Березан О.М.Органічна хімія.- К.: Абрис, 2000.
7. Липатников В.Е. Лабораторные работы по неорганической и органической химии.- М.: Высш.шк., 1981.
ІНСТРУКЦІЙНА КАРТКА ДЛЯ ПРОВЕДЕННЯ ЛАБОРАТОРНОГО ЗАНЯТТЯ
З НАВЧАЛЬНОЇ ПРАКТИКИ «ОРГАНІЧНИЙ СИНТЕЗ»
ТЕМА:Одержання бромистого етилу (брометану) C2H5Br
РОБОЧЕ МІСЦЕ: ХІМІЧНІ ЛАБОРАТОРІЇ ХТК ТРИВАЛІСТЬ ЗАНЯТТЯ: 6 ГОДИН
МЕТА ПРОВЕДЕННЯ ЗАНЯТТЯ:
ЗАКРІПЛЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ З ТЕМИ,
ПІДТВЕРДЖЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ ПРИ ВИКОНАННІ ЛАБОРАТОРНИХ ДОСЛІДІВ;
ОВОЛОДІННЯ МЕТОДОМ СИНТЕЗУ.
МАТЕРІАЛЬНО-ТЕХНІЧНЕ ОСНАЩЕННЯ РОБОЧОГО МІСЦЯ:
Етиловий спирт, бромистий калій, концентрована сульфатна кислота, колбаВюрца, воронки, прилади для перегонки, мірні циліндри.
ПРАВИЛА ОХОРОНИ ПРАЦІ:
Дотримуватися обережності при поводженні з хімічними реактивами, скляним посудом, електричним нагрівальним приладом. При підвищених концентраціях брометан викликає ураження нервової системи.
Реакція галогенування- це процес введення в молекулу органічних сполук атому галогену, при цьому відбувається заміщення деяких функціональних груп на атом галогену.
Речовини, до складу яких входить атом галогену,називаються галогенуючими агентами.
Це галоген водневі кислоти (НСІ, НВг), їх солі (КВг, КСІ) та інші.
Речовини, в молекулу яких вводиться атом галогену - галогенуються.
Це спирти, карбонові кислоти, феноли, альдегіди, кетони.
t, H2 SO4
Наприклад: R - OH + HX -------------> RX + H2O,
де Х- галоген ( Cl, Br, I )
Основні реакції:
KBr + H2SO4 —> KHSO4 + HBr
C2H5OH + HBr —> C2H5Br + H2O
Побічні реакції
2НВг + H2SO4 —> Вг2+ 2H2O+SO2
СН3СН2 -О–SO2 - ОН + НО – СН2СН3 —>H2SO4+ СН3- СН 2-О– СН2СН3
ЗМІСТ І ПОСЛІДОВНІСТЬ ВИКОНАННЯ ЗАВДАНЬ:
1 У колбі Вюрца з кипілками змішують 2,8 мл етилового спирту та 2,0 мл води, при постійному перемішуванні реакційної суміші і охолодженні колби водою, обережно додають 3,0 мл концентрованої сульфатної кислоти, а потім 3,0 г дрібнорозтертого бромистого калію.
2 Збирають прилад для перегонки і нагрівають реакційну суміш на піщаній бані.
3 Відгоняємий бромистий етилзбирають у колбу - приймач під шаром води.
4. Після закінчення реакції отриманий бромистий етилз водою виливають у мірний циліндр.

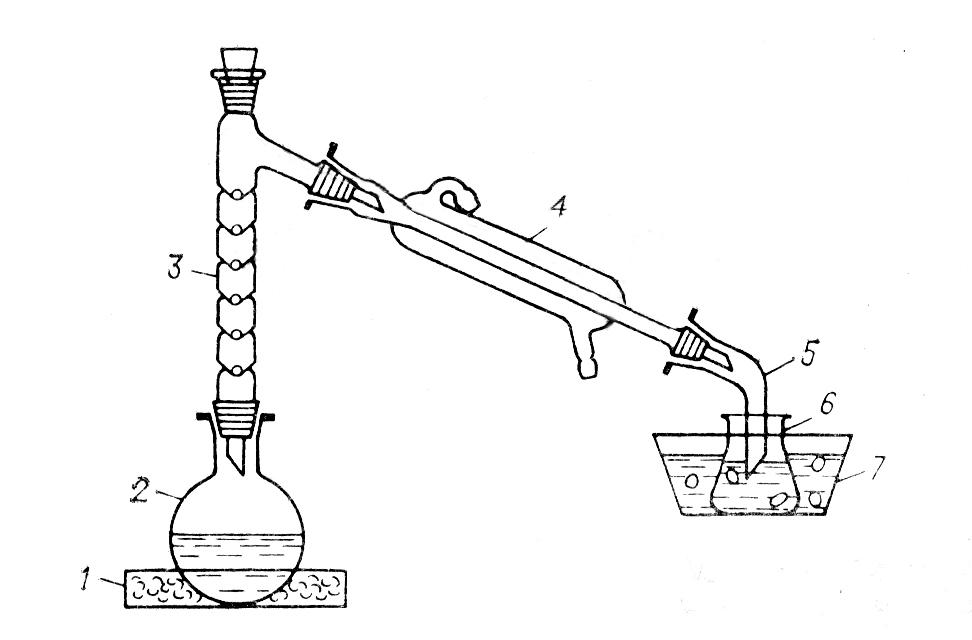
пісчана баня;
круглодонна колба;
дефлегматор;
холодильник;
алонж:
колба – приймач;
льодяна баня.
Рисунок 2 – Прилад для одержання брометану
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ЩОДО ВИКОНАННЯ Й ОФОРМЛЕННЯ:
При виконанні дослідів строго дотримуватися кількості реагентів та методики виконання роботи, які вказані в інструкції, а також заходів техніки безпеки.
Розрахувати практичний вихід (%) брометану.
По закінченню роботи зробити загальний висновок.
ПІСЛЯ ВИКОНАННЯ ЛАБОРАТОРНОЇ РОБОТИ СТУДЕНТ ПОВИНЕН:
ЗНАТИ:
Рівняння хімічних реакцій, що відбуваються при синтезі
Умови проведення процесу
Обладнання, що використовується для синтезу
Фізико – хімічні властивості та використання речовин
УМІТИ:
Провести необхідні синтези
Зібрати установку для синтезу
Працювати самостійно згідно інструкції
Невідступно дотримуватись заходів техніки безпеки
Провести розрахунок практичного та теоретичного виходів продукту
Знайти необхідні довідникові дані у довіднику
ЗАХИСТ РОБОТИ:
Визначити реакції галогенування.
Навести основні і побічні реакції, які відбуваються при бромуванні етанолу.
Навести схему приладу для отримання брометану.
Пояснити основні етапи синтезу брометану.
Пояснити розрахунок виходу продукту.
Яких заходів техніки безпеки необхідно додержуватись при синтезі брометану?
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ:
Привести приклади використання галогенпохідних вуглеводнів.
Пояснити які реагенти використовуються для заміщення гідроксильної групи в спиртах.
В хімічній лабораторії із 100 г етанолудобули 90 г брометану. Визначити практичний вихід.
Пояснити фізико-хімічні властивості бромистого етилу.
Пояснити застосування брометану.
ЛІТЕРАТУРА
1. Храмкина М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. С 105 – 111.
2. Храмкина М.Н. Практикум по органическому синтезу.- М.: Химия, 1974.
3. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
4. Потапов В.М., Татаринчик С.Н. Органическая химия. М.: Химия,1980.
5. Аверина А.В. Лабораторный практикум по органической химии.- М.: Высш.шк., 1980.
6. Березан О.М.Органічна хімія.- К.: Абрис, 2000.
7. Липатников В.Е. Лабораторные работы по неорганической и органической химии.- М.: Высш.шк., 1981.
ІНСТРУКЦІЙНА КАРТКА ДЛЯ ПРОВЕДЕННЯ ЛАБОРАТОРНОГО ЗАНЯТТЯ
З НАВЧАЛЬНОЇ ПРАКТИКИ «ОРГАНІЧНИЙ СИНТЕЗ»
ТЕМА:Одержання оцтовоетилового естеру (етилацетату) CH3СООC2H5
РОБОЧЕ МІСЦЕ: ХІМІЧНІ ЛАБОРАТОРІЇ ХТК ТРИВАЛІСТЬ ЗАНЯТТЯ: 2 ГОДИНИ
МЕТА ПРОВЕДЕННЯ ЗАНЯТТЯ:
ЗАКРІПЛЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ З ТЕМИ,
ПІДТВЕРДЖЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ ПРИ ВИКОНАННІ ЛАБОРАТОРНИХ ДОСЛІДІВ;
ОВОЛОДІННЯ МЕТОДОМ СИНТЕЗУ.
МАТЕРІАЛЬНО-ТЕХНІЧНЕ ОСНАЩЕННЯ РОБОЧОГО МІСЦЯ:
Етиловий спирт, концентрованаоцтова кислота, концентрованасульфатна кислота,кальцій хлорид, натрій карбонат 2% розчин; колби Вюрця, воронки, зворотні холодильники, термометри,алонжи,воронки розподільні, колби конічніта плоскодонні, мірні циліндри.
ПРАВИЛА ОХОРОНИ ПРАЦІ:
Дотримуватися обережності при поводженні з хімічними реактивами, скляним посудом, електричним нагрівальним приладом. Етилацетат токсичний, подразнює слизові оболонки.
Реакція ацілювання - процес заміщення атому гідрогену у деяких функціональних групах (гідроксильна ОН, аміногрупа NH2 ) на залишок карбонових кислот (ацилгрупу) R ─ C = О
|

Речовини, що містять у своєму складі ацилгрупу – ацилюючі агенти.
Це карбонові кислоти, їх ангідриди, аміди.
Речовини, в склад яких вводиться ацилгрупа - ацилюються. Це спирти, аміни, феноли.
O O
║ t, H2SO4 ║
R ─ C ─ OH + HOR1 -----------→ R ─ C ─ O ─ R1 + H2O
Карбонова Спирт
кислота
Основна реакція: t, H2SO4
CH3СОOH + C2H5OH —> CH3СООC2H5 + H2O
Побічна реакція t, H2SO4
2СН3СН2 ОН —> СН3СН 2 – О – СН2СН3 + H2O
ЗМІСТ І ПОСЛІДОВНІСТЬ ВИКОНАННЯ ЗАВДАНЬ:
1. В колбу Вюрця з кипілками поміщають 11 мл етилового спирту, 2,5мл концентрованої сульфатної кислоти та 10 мл концентрованої оцтової кислоти.
2. Збирать прилад для перегонки,суміш нагріваютьна пісочній бані та перегоняють.
З. Після закінчення реакції одержаний неочищений етилацетат переливають у розподільчу воронку і до нього додають25мл 2% розчину карбонату натрію.
4. Нижнійшар, який складається з оцтової кислоти, що не прореагувала, зливають, а до верхнього шару додають розчин з 4г хпоріду кальцію у 4 мл води.
5. Нижній шар, який містить вологу,зливають, а чистий естерпереливають у мірний циліндр.
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ЩОДО ВИКОНАННЯ Й ОФОРМЛЕННЯ:
При виконанні дослідів строго дотримуватися кількості реагентів та методики виконання роботи, які вказані в інструкції, а також заходів техніки безпеки.
Розрахувати практичний вихід (%) етилацетату.
По закінченню роботи зробити загальний висновок.
ПІСЛЯ ВИКОНАННЯ ЛАБОРАТОРНОЇ РОБОТИ СТУДЕНТ ПОВИНЕН:
ЗНАТИ:
1 Рівняння хімічних реакцій, що відбуваються при синтезі
2 Умови проведення процесу
3 Обладнання, що використовується для синтезу
4 Фізико – хімічні властивості та використання речовин
УМІТИ:
1 Провести необхідні синтези
2 Зібрати установку для синтезу
3 Працювати самостійно згідно інструкції
4 Невідступно дотримуватись заходів техніки безпеки
5 Провести розрахунок практичного та теоретичного виходів продукту
6 Знайти необхідні довідникові дані у довіднику
ЗАХИСТ РОБОТИ:
Дати визначення реакції ацілювання.
Пояснити які ацілюючі агенти використовуються.
Навести основні і побічні реакції синтезуетилацетату.
Пояснити схемуприладудля синтезуетилацетату.
Пояснити розрахунок виходу етилацетату.
Яких заходів техніки безпеки необхідно додержуватись при синтезіетилацетату.
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ:
Пояснити умови реакції прямої етерифікації та дію ангідриду кислоти на спирт.
Пояснити чому саме сульфатна кислота використовуються при синтезі етилацетату.
Як залежить швидкість етерифікації від властивостей карбонової кислоти та спирту.
Пояснити фізико-хімічні властивості етилацетату.
Пояснити області застосування етилацетату.
ЛІТЕРАТУРА
1. Храмкина М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. С 142 – 151.
2. Храмкина М.Н. Практикум по органическому синтезу.- М.: Химия, 1974.
3. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
4. Потапов В.М., Татаринчик С.Н. Органическая химия. М.: Химия,1980.
5. Аверина А.В. Лабораторный практикум по органической химии.- М.: Высш.шк., 1980.
6. Березан О.М.Органічна хімія.- К.: Абрис, 2000.
7. Липатников В.Е. Лабораторные работы по неорганической и органической химии.- М.: Высш.шк., 1981.
ІНСТРУКЦІЙНА КАРТКА ДЛЯ ПРОВЕДЕННЯ ЛАБОРАТОРНОГО ЗАНЯТТЯ
З НАВЧАЛЬНОЇ ПРАКТИКИ «ОРГАНІЧНИЙ СИНТЕЗ»
ТЕМА:Одержання етилового естеру бензойної кислоти (етилбензоату) С6Н5СООС2Н5
РОБОЧЕ МІСЦЕ: ХІМІЧНІ ЛАБОРАТОРІЇ ХТК ТРИВАЛІСТЬ ЗАНЯТТЯ: 2 ГОДИНИ
МЕТА ПРОВЕДЕННЯ ЗАНЯТТЯ:
ЗАКРІПЛЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ З ТЕМИ,
ПІДТВЕРДЖЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ ПРИ ВИКОНАННІ ЛАБОРАТОРНИХ ДОСЛІДІВ;
ОВОЛОДІННЯ МЕТОДОМ СИНТЕЗУ.
МАТЕРІАЛЬНО-ТЕХНІЧНЕ ОСНАЩЕННЯ РОБОЧОГО МІСЦЯ:
бензойна кислота, етанол, концентрованасульфатна кислота, натрію карбонат, насичений розчин; кальція хлорид, діетиловий етер. Колба круглодонна на 100мл, холодильник Лібіха, холодильник повітряний, трубка хлоркальцієва, воронка ділильна, колба Вюрца, термометр, алонж, стакан, колба конічна плоскодонна.
ПРАВИЛА ОХОРОНИ ПРАЦІ:
Дотримуватися обережності при поводженні з хімічними реактивами, скляним посудом, електричним нагрівальним приладом.Дотримуватись обережності при роботі з хімічними реактивами, скляним посудом. Працювати з етиловим естером обережно, тому що він роздратовує слизові оболонки. Бензойна кислота подразнює шкіру.
Реакція ацілювання
- процес заміщення атому гідрогену у
деяких функціональних групах (гідроксильна
ОН, аміногрупа NH2
) на залишок карбонових кислот (ацилгрупу)
R ─ CО ─

Речовини, що містять у своєму складі ацилгрупу – ацилюючі агенти.
Це карбонові кислоти, їх ангідриди, аміди.
Речовини, в склад яких вводиться ацилгрупа - ацилюються. Це спирти, аміни, феноли.
O O
║ t, H2 SO4 ║
R ─ C ─ ОН + HOR1 -----------→ R ─ C ─ O ─ R1 + H2О
Карбонова Спирт
кислоти
В реакцію ацілювання спиртів хлорангідридами кислот з утворенням естерів легко вступають первинні і вторинні спирти. Якщо реакція відбувається бурхливо, необхідно охолоджувати суміш водою з льодом. реакція взаємодії ароматичних сполук з ацілюючими агентами екзотермічна, і тому його вводять в суміш по краплям. Отриманий естер очищують перегонкою або кристалізацією.
Основна реакція:
H2SO4
С6Н5СООН + С2Н5ОН <======> С6Н5СООС2Н5 + Н2О
ЗМІСТ І ПОСЛІДОВНІСТЬ ВИКОНАННЯ ЗАВДАНЬ:
1 Круглодонну колбу ємністю 100мл з’єднують з оборотним (шариковим) водянимхолодильником.
2 В колбу поміщують 1,2г бензойної кислоти; 3,5мл етанолу; 0,4мл концентрованої сульфатної кислоти та нагрівають суміш на водяній бані протягом 2 годин.
3 По закінченні реакції відганяють надлишок етанолу на приладі для фракційної перегонки, для чого колбу з’єднують з прямим водяним холодильником з алонжем, кінець якого опускають в приймач.
4 Залишок охолоджують і ,для розчинення спирту та бензойної кислоти, що залишилися, виливають в стакан з 6мл холодної води. Додають порціями натрія карбонат до слаболужної реакції.
5 Бензойна кислота екстрагується діетиловим етером.
6 Етилбензоат, що виділяється у вигляді масла, відокремлюють за допомогою ділильної воронки
7 Потім сирий естер сушиться протягом декількох годин безводним кальцій хлоридом.
8 Після відгонки етеру залишок етилбензоату перегоняють, збираючи фракцію при 2100С
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ЩОДО ВИКОНАННЯ Й ОФОРМЛЕННЯ:
При виконанні дослідів строго дотримуватися кількості реагентів та методики виконання роботи, які вказані в інструкції, а також заходів техніки безпеки.
Розрахувати практичний вихід (%) етилбензоату.
По закінченню роботи зробити загальний висновок.
ПІСЛЯ ВИКОНАННЯ ЛАБОРАТОРНОЇ РОБОТИ СТУДЕНТ ПОВИНЕН:
ЗНАТИ:
1 Рівняння хімічних реакцій, що відбуваються при синтезі
2 Умови проведення процесу
3 Обладнання, що використовується для синтезу
4 Фізико – хімічні властивості та використання речовин
УМІТИ:
1 Провести необхідні синтези
2 Зібрати установку для синтезу
3 Працювати самостійно згідно інструкції
4 Невідступно дотримуватись заходів техніки безпеки
5 Провести розрахунок практичного та теоретичного виходів продукту
6 Знайти необхідні довідникові дані у довіднику
ЗАХИСТ РОБОТИ:
Дати визначення реакції ацілювання.
Пояснити які ацілюючі агенти використовуються.
Навести основні і побічні реакції синтезуетилбензоату.
Пояснити схемуприладудля синтезуетилбензоату.
Пояснити розрахунок виходу етилбензоату.
Яких заходів техніки безпеки необхідно додержуватись при синтезі етилбензоату.
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ:
Пояснити фізико-хімічні властивості етилбензоату.
Пояснити області застосування етилбензоату.
ЛІТЕРАТУРА
1. Храмкина М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. С 142 – 149, 156 - 157.
2. Храмкина М.Н. Практикум по органическому синтезу.- М.: Химия, 1974.
3. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
4. Потапов В.М., Татаринчик С.Н. Органическая химия. М.: Химия,1980.
5. Аверина А.В. Лабораторный практикум по органической химии.- М.: Высш.шк., 1980.
6. Березан О.М.Органічна хімія.- К.: Абрис, 2000.
ІНСТРУКЦІЙНА КАРТКА ДЛЯ ПРОВЕДЕННЯ ЛАБОРАТОРНОГО ЗАНЯТТЯ
З НАВЧАЛЬНОЇ ПРАКТИКИ «ОРГАНІЧНИЙ СИНТЕЗ»
ТЕМА:Одержання етилового естеру хлороцтової кислоти (етилхлорацетату)СН2СlСОС2Н5
РОБОЧЕ МІСЦЕ: ХІМІЧНІ ЛАБОРАТОРІЇ ХТК ТРИВАЛІСТЬ ЗАНЯТТЯ: 4 ГОДИНИ
МЕТА ПРОВЕДЕННЯ ЗАНЯТТЯ:
ЗАКРІПЛЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ З ТЕМИ,
ПІДТВЕРДЖЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ ПРИ ВИКОНАННІ ЛАБОРАТОРНИХ ДОСЛІДІВ;
ОВОЛОДІННЯ МЕТОДОМ СИНТЕЗУ.
МАТЕРІАЛЬНО-ТЕХНІЧНЕ ОСНАЩЕННЯ РОБОЧОГО МІСЦЯ:
хлороцтова кислота, етанол, конц. сульфатна кислота, натрію гідрокарбонат натрію, насичений розчин; кальція хлорид. Колба круглодонна на 100мл, холодильник Лібіха, трубка хлоркальцієва, воронка дилільна, стакан,колба конічна плоскодонна.
ПРАВИЛА ОХОРОНИ ПРАЦІ:
Дотримуватися обережності при поводженні з хімічними реактивами, скляним посудом, електричним нагрівальним приладом.Дотримуватись обережності при роботі з хімічними реактивами, скляним посудом. Працювати з етиловим естером обережно, тому що він роздратовує слизові оболонки. Хлороцтова кислота викликає опіки шкіри.
Реакція ацілювання
- процес заміщення атому гідрогену у
деяких функціональних групах (гідроксильна
ОН, аміногрупа NH2
) на залишок карбонових кислот (ацилгрупу)
R ─ СО ─
Речовини, що містять у своєму складі ацилгрупу – ацилюючі агенти.
Це карбонові кислоти, їх ангідриди, аміди.
Речовини, в склад яких вводиться ацилгрупа - ацилюються. Це спирти, аміни, феноли.
O O
║ t, H2 SO4 ║
R ─ C ─ C1 + HOR1 -----------→ R ─ C ─ O ─ R1 + H2O
Хлорангідрид карбонової Спирт
кислоти
В реакцію ацілювання спиртів хлорангідридами кислот з утворенням естерів легко вступають первинні і вторинні спирти. Якщо реакція відбувається бурхливо, необхідно охолоджувати суміш або використовувати розчинники. Залишок непрореагувавшого хлорангідриду видаляють, оброблюючи суміш розчином натрій карбонату. Отриманий естер очищують перегонкою або кристалізацією.
Основна реакція:
H2SO4
СН2СlСООН + С2Н5ОН <======> СН2СlСОС2Н5
ЗМІСТ І ПОСЛІДОВНІСТЬ ВИКОНАННЯ ЗАВДАНЬ:
1 Круглодонну колбу ємністю 100мл з’єднують з оборотним (шариковим) водяним холодильником, до якого приєднується хлоркальцієва трубка, необхідна для захисту реакційного середовища від доступу повітря.
2 В колбу поміщують 2г хлороцтової кислоти; 1,5мл етанолу; 0,1мл концентрованої сульфатної кислоти та нагрівають суміш на піщаній бані протягом 4 годин.
3 По закінченні реакції суміш охолоджують, а потім виливають у стакан з 10мл льодяної води.
4 Із стакану суміш переноситься у ділильну воронку, відокремлюють нищий водний шар, а естерний шар нейтралізують 1мл насиченого розчину Na2CO3та промивають водою до нейтральної реакції.
5 Потім сирий естер сушиться протягом 10 – 12 годин безводним кальцій хлоридом.
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ЩОДО ВИКОНАННЯ Й ОФОРМЛЕННЯ:
При виконанні дослідів строго дотримуватися кількості реагентів та методики виконання роботи, які вказані в інструкції, а також заходів техніки безпеки.
Розрахувати практичний вихід (%)етилхлорацетату.
По закінченню роботи зробити загальний висновок.
ПІСЛЯ ВИКОНАННЯ ЛАБОРАТОРНОЇ РОБОТИ СТУДЕНТ ПОВИНЕН:
ЗНАТИ:
1 Рівняння хімічних реакцій, що відбуваються при синтезі
2 Умови проведення процесу
3 Обладнання, що використовується для синтезу
4 Фізико – хімічні властивості та використання речовин
УМІТИ:
1 Провести необхідні синтези
2 Зібрати установку для синтезу
3 Працювати самостійно згідно інструкції
4 Невідступно дотримуватись заходів техніки безпеки
5 Провести розрахунок практичного та теоретичного виходів продукту
6 Знайти необхідні довідникові дані у довіднику
ЗАХИСТ РОБОТИ:
Дати визначення реакції ацілювання.
Пояснити які ацілюючі агенти використовуються.
Навести основні і побічні реакції синтезуетилхлорацетату.
Пояснити схемуприладудля синтезуетилхлорацетату.
Пояснити розрахунок виходу етилхлорацетату.
Яких заходів техніки безпеки необхідно додержуватись при синтезі етилхлорацетату.
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ:
Визначити масу практичного виходу продукту з 10г етанолу, якщо практичний вихід складає 80% (мас. часток).
Пояснити фізико-хімічні властивості етилхлорацетату.
Пояснити області застосування етилхлорацетату.
ЛІТЕРАТУРА
1. Храмкина М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. С 142 – 149, 153 - 154.
2. Храмкина М.Н. Практикум по органическому синтезу.- М.: Химия, 1974.
3. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
4. Потапов В.М., Татаринчик С.Н. Органическая химия. М.: Химия,1980.
5. Аверина А.В. Лабораторный практикум по органической химии.- М.: Высш.шк., 1980.
6. Березан О.М.Органічна хімія.- К.: Абрис, 2000.
ІНСТРУКЦІЙНА КАРТКА ДЛЯ ПРОВЕДЕННЯ ЛАБОРАТОРНОГО ЗАНЯТТЯ
З НАВЧАЛЬНОЇ ПРАКТИКИ «ОРГАНІЧНИЙ СИНТЕЗ»
ТЕМА:Одержання бензойної кислоти С6Н5ОН
РОБОЧЕ МІСЦЕ: ХІМІЧНІ ЛАБОРАТОРІЇ ХТК ТРИВАЛІСТЬ ЗАНЯТТЯ: 4 ГОДИНИ
МЕТА ПРОВЕДЕННЯ ЗАНЯТТЯ:
ЗАКРІПЛЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ З ТЕМИ,
ПІДТВЕРДЖЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ ПРИ ВИКОНАННІ ЛАБОРАТОРНИХ ДОСЛІДІВ;
ОВОЛОДІННЯ МЕТОДОМ СИНТЕЗУ.
МАТЕРІАЛЬНО-ТЕХНІЧНЕ ОСНАЩЕННЯ РОБОЧОГО МІСЦЯ:
перманганат калію, толуол, хлоридна кислота, воронки, колби з зворотним холодильником, фарфорові чашки, склянки, палички, чашки Петрі.
ПРАВИЛА ОХОРОНИ ПРАЦІ:
Дотримуватися обережності при поводженні з хімічними реактивами, скляним посудом, електричним нагрівальним приладом. Дихання парою толуолу діє на нервову систему.
Реакція окиснення - це процес віддачі атомів гідрогену або приєднання атому оксигену.
Окисненню підлягають більшість органічних сполук. Найважливіші окиснювачі: кисень повітря, перманганат калію, хромовий ангідрид, біхромат калію, хромова суміш. Реакція використовується для одержанняоксигенвмісних сполук.
t, (О)
Наприклад: R --- OH --------→ R – COH + H2O
спирт альдегід
Одержання бензойної кислоти — це процес окиснення толуолу в присутності окиснювача перманганату калію.
Основна реакція:
СН3 COOH




+ 2KMnO4 ---► + KOH + H2 O + 2MnO2
ЗМІСТ І ПОСЛІДОВНІСТЬ ВИКОНАННЯ ЗАВДАНЬ:
1 У круглодонній колбі з зворотнім холодильником кип'ятять впродовж 3 годин на водяній бані
1,15 мл толуолу з 70 мл води і1,7г дрібнорозтертого перманганату калію. Для рівномірного кипіння реакційної суміші до колби додають декілька шматочків фарфору.
2 Якщо не відбулосьзнезбарвлення до розчину додають 0,5 - 1 мл етилового спирту або 0,1 - 0,2 г щавелевой кислоти і нагрівають.
3 Після закінчення реакціїзнебарвлений розчин охолоджують, випавший діоксид мангану відфільтровують і двічи промивають теплою водою (по 2,5 мл)
4 Фільтрат упарюють до об'єму 12,5 - 20 мл і підкислюють концентрованою соляною кислотою до кислої реакції по Конго-індікатору. При цьому осаждується бензойна кислота у вигляді білих кришталів.
5 Її відфільтровують, промивають невеликою кількістю холодної води і сушать.

1 – водяна баня;
2 – круглодонна колба;
3 – дефлегматор.
Рисунок 3 – Прилад для одержання бензойної кислоти
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ЩОДО ВИКОНАННЯ Й ОФОРМЛЕННЯ:
При виконанні дослідів строго дотримуватися кількості реагентів та методики виконання роботи, які вказані в інструкції, а також заходів техніки безпеки.
Розрахувати практичний вихід (%) кислоти.
По закінченню роботи зробити загальний висновок.
ПІСЛЯ ВИКОНАННЯ ЛАБОРАТОРНОЇ РОБОТИ СТУДЕНТ ПОВИНЕН:
ЗНАТИ:
1 Рівняння хімічних реакцій, що відбуваються при синтезі
2 Умови проведення процесу
3 Обладнання, що використовується для синтезу
4 Фізико – хімічні властивості та використання речовин
УМІТИ:
1 Провести необхідні синтези
2 Зібрати установку для синтезу
3 Працювати самостійно згідно інструкції
4 Невідступно дотримуватись заходів техніки безпеки
5 Провести розрахунок практичного та теоретичного виходів продукту
6 Знайти необхідні довідникові дані у довіднику
ЗАХИСТ РОБОТИ:
Дати визначення реакції окиснення.
Від чого залежить дія окисника на органічну речовину.
Пояснити вибір умов для проведення окиснення.
Навести рівняння основних і побічних реакцій, які відбуваються при одержанні бензойної кислоти.
Пояснити схеми приладів для синтезубензойної кислоти.
Пояснити розрахунок виходу продуктів окиснення.
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ:
Які окисники використовуються для проведення окиснення?
Пояснити фізико-хімічні властивості бензойної кислоти.
Пояснити області застосування бензойної кислоти.
Яких заходів техніки безпеки необхідно додержуватись при синтезібензойної кислоти?
ЛІТЕРАТУРА
1. Храмкина М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. С 166 – 170, 183 - 184.
2. Храмкина М.Н. Практикум по органическому синтезу.- М.: Химия, 1974.
3. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
4. Потапов В.М., Татаринчик С.Н. Органическая химия. М.: Химия,1980.
5. Аверина А.В. Лабораторный практикум по органической химии.- М.: Высш.шк., 1980.
6. Березан О.М.Органічна хімія.- К.: Абрис, 2000.
ІНСТРУКЦІЙНА КАРТКА ДЛЯ ПРОВЕДЕННЯ ЛАБОРАТОРНОГО ЗАНЯТТЯ
З НАВЧАЛЬНОЇ ПРАКТИКИ «ОРГАНІЧНИЙ СИНТЕЗ»
ТЕМА:Одержання ацетальдегіду СН3СНО
РОБОЧЕ МІСЦЕ: ХІМІЧНІ ЛАБОРАТОРІЇ ХТК ТРИВАЛІСТЬ ЗАНЯТТЯ: 4 ГОДИНИ
МЕТА ПРОВЕДЕННЯ ЗАНЯТТЯ:
ЗАКРІПЛЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ З ТЕМИ,
ПІДТВЕРДЖЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ ПРИ ВИКОНАННІ ЛАБОРАТОРНИХ ДОСЛІДІВ;
ОВОЛОДІННЯ МЕТОДОМ СИНТЕЗУ.
МАТЕРІАЛЬНО-ТЕХНІЧНЕ ОСНАЩЕННЯ РОБОЧОГО МІСЦЯ:
Етиловий спирт, концентрована H2SO4, біхромат калію. Скляні та фарфорові склянки, воронки, прилади для перегонки, палички, колби, мірні ціліндри.
ПРАВИЛА ОХОРОНИ ПРАЦІ:
Дотримуватися обережності при поводженні з хімічними реактивами, скляним посудом, електричним нагрівальним приладом. Ацетальдегід подразнює слизові оболонки. Утворює з повітрям вибухонебезпечні суміші.
Реакція окиснення - це процес віддачі атомів гідрогену або приєднання атому оксигену.
Окисненню підлягають більшість органічних сполук. Найважливіші окиснювачі: кисень повітря, перманганат калію, хромовий ангідрид, біхромат калію, хромова суміш. Реакція використовується для одержанняоксигенвмісних сполук.
Одержання ацетальдегіду - це процес окиснення етилового спирту в присутності окиснювача - хромової суміші.
Основна реакція:
3СН3СН2ОН + K2Cr2О7 + 4H2SO4 --------► ЗСН3СНО + K2SO4 + Cr 2(SO4)3 + 7Н2О
ЗМІСТ І ПОСЛІДОВНІСТЬ ВИКОНАННЯ ЗАВДАНЬ:
На технічних терезах беруть наважку біхромату калія вагою 5 г та подрібнюють її у ступі та поміщують у фарфорову склянку.
До наважки додають 30 мл води і розчиняють її без нагрівання.
До отриманого розчину приливають 7,5 мл концентрованої сульфатної кислоти H2SO4 невеликими порціями при постійному перемішуванні та охолодженні.
До цієї окиснюючої хромової суміші приливають при постійному перемішуванні та охолодженні порціями 6-7 мм етилового спирту.
Коли розчин приймає темно-зелений колір, його ставлять на повільну кристалізацію (до наступного дня) в цій склянці.
Відділяють кристали від маточного розчину методом декантації, висушують на повітрі та зважують, а маточний розчин перегоняють на приладі для перегонки, збирають ацетальдегід та переливають у мірний ціліндр.
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ЩОДО ВИКОНАННЯ Й ОФОРМЛЕННЯ:
При виконанні дослідів строго дотримуватися кількості реагентів та методики виконання роботи, які вказані в інструкції, а також заходів техніки безпеки.
Розрахувати практичний вихід (%) ацетальдегіду.
По закінченню роботи зробити загальний висновок.
ПІСЛЯ ВИКОНАННЯ ЛАБОРАТОРНОЇ РОБОТИ СТУДЕНТ ПОВИНЕН:
ЗНАТИ:
1 Рівняння хімічних реакцій, що відбуваються при синтезі
2 Умови проведення процесу
3 Обладнання, що використовується для синтезу
4 Фізико – хімічні властивості та використання речовин
УМІТИ:
1 Провести необхідні синтези
2 Зібрати установку для синтезу
3 Працювати самостійно згідно інструкції
4 Невідступно дотримуватись заходів техніки безпеки
5 Провести розрахунок практичного та теоретичного виходів продукту
6 Знайти необхідні довідникові дані у довіднику
ЗАХИСТ РОБОТИ:
Дати визначення реакції окиснення.
Які окисники використовуються для проведення окиснення.
Від чого залежить дія окисника на органічну речовину.
Вибрати умови для окиснення первинних спиртів до альдегідів.
Пояснити схеми приладів для синтезів ацетальдегіду.
Пояснити розрахунок виходу продуктів окиснення.
Навести рівняння основних і побічних реакцій, які відбуваються при одержанні ацетальдегіду.
Яких заходів техніки безпеки необхідно додержуватись при синтезіацетальдегіду.
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ:
Пояснити вибір умов для проведення окиснення альдегідів до кислот.
Пояснити фізико-хімічні властивості ацетальдегіду.
Пояснити області застосування ацетальдегіду.
ЛІТЕРАТУРА
1. Храмкина М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. С 166 – 174.
2. Храмкина М.Н. Практикум по органическому синтезу.- М.: Химия, 1974.
3. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
4. Потапов В.М., Татаринчик С.Н. Органическая химия. М.: Химия,1980.
5. Аверина А.В. Лабораторный практикум по органической химии.- М.: Высш.шк., 1980.
6. Березан О.М.Органічна хімія.- К.: Абрис, 2000.
7. Липатников В.Е. Лабораторные работы по неорганической и органической химии.- М.: Высш.шк., 1981.
ІНСТРУКЦІЙНА КАРТКА ДЛЯ ПРОВЕДЕННЯ ЛАБОРАТОРНОГО ЗАНЯТТЯ
З НАВЧАЛЬНОЇ ПРАКТИКИ «ОРГАНІЧНИЙ СИНТЕЗ»
ТЕМА:Одержання нітробензолу С6Н5NO2
РОБОЧЕ МІСЦЕ: ХІМІЧНІ ЛАБОРАТОРІЇ ХТК ТРИВАЛІСТЬ ЗАНЯТТЯ: 4 ГОДИНИ
МЕТА ПРОВЕДЕННЯ ЗАНЯТТЯ:
ЗАКРІПЛЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ З ТЕМИ,
ПІДТВЕРДЖЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ ПРИ ВИКОНАННІ ЛАБОРАТОРНИХ ДОСЛІДІВ;
ОВОЛОДІННЯ МЕТОДОМ СИНТЕЗУ.
МАТЕРІАЛЬНО-ТЕХНІЧНЕ ОСНАЩЕННЯ РОБОЧОГО МІСЦЯ:
Концентрована сульфатна кислота, концентрована нітратна кислота, бензен, кальцій хлорид.
Колба конічна, колба Вюрца, воронка Бюхнера, пробірка.
ПРАВИЛА ОХОРОНИ ПРАЦІ:
Дотримуватися обережності при поводженні з хімічними реактивами, скляним посудом, електричним нагрівальним приладом.
Реакція нітрування- це процес введення в молекулу органічної сполуки функціональної групи –нітро (NO2.) При цьому відбувається заміщення рухомого атомугідрогенуабо деяких функціональних груп на нітрогрупу.
Речовини, що містять у своєму складі нітрогрупу називаються нітруючими агентами (нітратна кислота, нітруючи сіміш НNO3(к) + Н2SO4(к), оксиди нітрогену, нітрати металів, етери нітратної кислоти). Речовини, до складу молекул яких вводиться нітрогрупа - нітруються. Продукти реакції нітрування, нітросполуки, застосовуються в синтезі лікарських препаратів, фарбників, вибухових речовин, лаків, емалі та як розчинники.
Основна реакція: NO2 +
С6Н6 --------------------------------> С6Н5NO2 + H2O
HNO3 + H2SO4
ЗМІСТ І ПОСЛІДОВНІСТЬ ВИКОНАННЯ ЗАВДАНЬ:
1 Для приготування нітруючої суміші до 2,5 мл нітратної кислоти обережно, при перемішуванні і охолодженні, додають 3,1 мл сульфатної кислоти.
2 Нітруючу суміш поміщують у ділильну воронку та додають 1,7 мл бензолу.
3 Вміст воронки енергійно перемішують на протязі 10 хвилин. При цьому ділильну воронку охолоджують потоком проточної води.
4
Рідині дають отстоятися та зливають
нижній шар, який складається з
відпрацьованих кислот.
5 Отриманий нітробензол перемішують з 2 мп води, охолоджуючи ділильну воронку.
6 Післявідділення нітробензолу його промиваютьають 5% розчином лугута знову водою по2мп.
7 Вологий нітробензол переливають у коротку пробирку та додають кусочок хлористого кальцію, при цьому нітробензол стане прозорим.
8 Його переливають у колбу Вюрца та переганяють, збираючи фракцію з темп. кип. 206 - 207 °С.
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ЩОДО ВИКОНАННЯ Й ОФОРМЛЕННЯ:
При виконанні дослідів строго дотримуватися кількості реагентів та методики виконання роботи, які вказані в інструкції, а також заходів техніки безпеки.
Розрахувати практичний вихід (%) нітробензолу.
По закінченню роботи зробити загальний висновок.
ПІСЛЯ ВИКОНАННЯ ЛАБОРАТОРНОЇ РОБОТИ СТУДЕНТ ПОВИНЕН:
ЗНАТИ:
1 Рівняння хімічних реакцій, що відбуваються при синтезі
2 Умови проведення процесу
3 Обладнання, що використовується для синтезу
4 Фізико – хімічні властивості та використання речовин
УМІТИ:
1 Провести необхідні синтези
2 Зібрати установку для синтезу
3 Працювати самостійно згідно інструкції
4 Невідступно дотримуватись заходів техніки безпеки
5 Провести розрахунок практичного та теоретичного виходів продукту
6 Знайти необхідні довідникові дані у довіднику
ЗАХИСТ РОБОТИ:
Дати визначення реакції нітрування.
Які нітруючі агенти використовуються для проведення реакції нітрування.
Пояснити склад нітруючої суміші та призначення її компонентів.
Навести рівняння основних і побічних реакцій, які відбуваються при одержанні нітробензолу Пояснити схеми приладів для синтезунітробензолу.
Пояснити розрахунок виходу нітробензолу.
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ:
Пояснити фізико-хімічні властивості нітробензолу.
Пояснити області використання нітробензолу.
Яких заходів техніки безпеки необхідно додержуватись при синтезінітробензолу.
ЛІТЕРАТУРА
1. Храмкина М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. С 187 – 190.
2. Храмкина М.Н. Практикум по органическому синтезу.- М.: Химия, 1974.
3. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
4. Потапов В.М., Татаринчик С.Н. Органическая химия. М.: Химия,1980.
5. Аверина А.В. Лабораторный практикум по органической химии.- М.: Высш.шк., 1980.
6. Березан О.М.Органічна хімія.- К.: Абрис, 2000.
7. Липатников В.Е. Лабораторные работы по неорганической и органической химии.- М.: Высш.шк., 1981.
ІНСТРУКЦІЙНА КАРТКА ДЛЯ ПРОВЕДЕННЯ ЛАБОРАТОРНОГО ЗАНЯТТЯ
З НАВЧАЛЬНОЇ ПРАКТИКИ «ОРГАНІЧНИЙ СИНТЕЗ»
ТЕМА: Одержання α – нітронафталіну C10H7NO2 (1– нітронафталіну)
РОБОЧЕ МІСЦЕ: ХІМІЧНІ ЛАБОРАТОРІЇ ХТК ТРИВАЛІСТЬ ЗАНЯТТЯ: 4 ГОДИНИ
МЕТА ПРОВЕДЕННЯ ЗАНЯТТЯ:
ЗАКРІПЛЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ З ТЕМИ,
ПІДТВЕРДЖЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ ПРИ ВИКОНАННІ ЛАБОРАТОРНИХ ДОСЛІДІВ;
ОВОЛОДІННЯ МЕТОДОМ СИНТЕЗУ.
МАТЕРІАЛЬНО-ТЕХНІЧНЕ ОСНАЩЕННЯ РОБОЧОГО МІСЦЯ:
Нафталін;
концентрована сульфатна кислота;
концентрована нітратна кислота, лакмус.
Cклянка (250 мл); скляна хімічна воронка; колба Бунзена; воронка Бюхнера, водяна баня, термометр.
ПРАВИЛА ОХОРОНИ ПРАЦІ:
Дотримуватися обережності при поводженні з хімічними реактивами, скляним посудом, електричним нагрівальним приладом. Синтез проводити у витяжній шафі.
Реакція нітрування - це процес введення в молекулу органічної сполуки функціональної групи –нітро (NO2.) При цьому відбувається заміщення рухомого атомугідрогенуабо деяких функціональних груп на нітрогрупу.
Речовини, що містять у своєму складі нітрогрупу називаються нітруючими агентами (нітратна кислота, нітруючасуміш НNO3(к) + Н2SO4(к), оксиди нітрогену, нітрати металів, етери нітратної кислоти). Речовини, до складу молекул яких вводиться нітрогрупа,- нітруються. Продукти реакції нітрування, нітросполуки, застосовуються в синтезі лікарських препаратів, фарбників, вибухових речовин, лаків, емалі та як розчинники.
Основна реакція:



 NO2
NO2



 t
t
+ HNO3 + H2SO4 -----► + H2O
ЗМІСТ І ПОСЛІДОВНІСТЬ ВИКОНАННЯ ЗАВДАНЬ:
1 В стакан вливається 5,9мл нітратної кислоти і при охолодженні та перемішуванні обережно додається 4,8мл сульфатної кислоти.
2 До суміші кислот невеликими порціями при перемішуванні вноситься 5,5г тонкорозтертого нафталіну. Додавання його ведуть з такою швидкістю, щоб температура реакційної маси не перевищувала 500С. В разі необхідності склянку охолоджують проточною водою.
3 Після додавання всієї кількості нафталіну реакційну масу витримують протягом 1 години при 600С, постійно перемішуючи вміст склянки.
4 Потім реакційну масу виливають у склянку, в якій міститься 100мл холодної води, при цьому
α – нітронафталін застигає у вигляді коржа, що плаває на поверхні розчину.
5 Водно – кислотний шар зливається, а сирий α – нітронафталін кип’ятиться кілька разів по
15 хвилин у склянці з 100мл води. Після кожного кип’ятіння вода зливається.
6 Продукт кип’ятять, поки рідина не перестане показувати кислу реакцію.
7 Розплавлений продукт виливається тонким струменем у склянку зі 100мл холодної води, де застигає у вигляді червоно – жовтих кульок.
8 осад відфільтровують на воронці Бюхнера та висушують на повітрі.
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ЩОДО ВИКОНАННЯ Й ОФОРМЛЕННЯ:
При виконанні дослідів строго дотримуватися кількості реагентів та методики виконання роботи, які вказані в інструкції, а також заходів техніки безпеки.
Розрахувати практичний вихід (%)α – нітронафталіну.
По закінченню роботи зробити загальний висновок.
ПІСЛЯ ВИКОНАННЯ ЛАБОРАТОРНОЇ РОБОТИ СТУДЕНТ ПОВИНЕН:
ЗНАТИ:
1 Рівняння хімічних реакцій, що відбуваються при синтезі
2 Умови проведення процесу
3 Обладнання, що використовується для синтезу
4 Фізико – хімічні властивості та використання речовин
УМІТИ:
1 Провести необхідні синтези
2 Зібрати установку для синтезу
3 Працювати самостійно згідно інструкції
4 Невідступно дотримуватись заходів техніки безпеки
5 Провести розрахунок практичного та теоретичного виходів продукту
6 Знайти необхідні довідникові дані у довіднику
ЗАХИСТ РОБОТИ:
Дати визначення реакції нітрування.
Пояснити склад нітруючої суміші та призначення її компонентів.
Навести рівняння основних і побічних реакцій, які відбуваються при одержанні α – нітронафталіну Пояснити схеми приладів для синтезуα – нітронафталіну
Пояснити розрахунок виходу α – нітронафталіну
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ:
Пояснити фізико-хімічні властивості α – нітронафталіну
Пояснити області використання α – нітронафталіну
Яких заходів техніки безпеки необхідно додержуватись при синтезі α – нітронафталіну?
Які нітруючі агенти використовуються для проведення реакції нітрування?
ЛІТЕРАТУРА
1. Храмкина М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. С 187 – 190, 197 - 199.
2. Храмкина М.Н. Практикум по органическому синтезу.- М.: Химия, 1974.
3. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
4. Потапов В.М., Татаринчик С.Н. Органическая химия. М.: Химия,1980.
5. Аверина А.В. Лабораторный практикум по органической химии.- М.: Высш.шк., 1980.
6. Березан О.М.Органічна хімія.- К.: Абрис, 2000.
ІНСТРУКЦІЙНА КАРТКА ДЛЯ ПРОВЕДЕННЯ ЛАБОРАТОРНОГО ЗАНЯТТЯ
З НАВЧАЛЬНОЇ ПРАКТИКИ «ОРГАНІЧНИЙ СИНТЕЗ»
ТЕМА:Одержання натрієвої солі п - толуолсульфокислоти п - CH3С6Н4SO3Na
РОБОЧЕ МІСЦЕ: ХІМІЧНІ ЛАБОРАТОРІЇ ХТК ТРИВАЛІСТЬ ЗАНЯТТЯ: 4 ГОДИНИ
МЕТА ПРОВЕДЕННЯ ЗАНЯТТЯ:
ЗАКРІПЛЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ З ТЕМИ,
ПІДТВЕРДЖЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ ПРИ ВИКОНАННІ ЛАБОРАТОРНИХ ДОСЛІДІВ;
ОВОЛОДІННЯ МЕТОДОМ СИНТЕЗУ.
МАТЕРІАЛЬНО-ТЕХНІЧНЕ ОСНАЩЕННЯ РОБОЧОГО МІСЦЯ:
Толуол,
концентрована сульфатна кислота, натрій
карбонат, натрій хлорид.
Стакан, холодильник оборотний, колба круглодонна, воронка Бюхнера, водяний насос, кипілки, водяна баня, промивалка.
ПРАВИЛА ОХОРОНИ ПРАЦІ:
Дотримуватися обережності при поводженні з хімічними реактивами, скляним посудом, електричним нагрівальним приладом. Синтез проводити у витяжній шафі.
Реакція сульфування - це процес введення в молекулу органічної речовини сульфогрупи -SO3H.
Речовини, до складу яких входить сульфогрупа називають сульфуючими агентами (сульфатна кислота, її оксиди, естеритощо). Речовини, до молекул яких вводиться сульфогрупа - сульфуються. Продукти реакцій сульфування - це сульфокислоти, які застосовуються при виробництві фенолів, нафтолів, лікарських препаратів, фарбників, миючих та дезінфікуючих засобів.
t
Наприклад: R ─ H + HOSO3H ---→ R ─ SO3 H + H2O
Основна реакція:



C H3
+ HOSO3H
------►
H3C
SO3H
H3
+ HOSO3H
------►
H3C
SO3H
n-CH3C6H4 SO3H + NaCl ------► n -CH3C6H4SO3Na + HCl
Побічні реакції;




CH3 + HOSO3H -----► SO3H
CH3




CH3 + HOSO3H----► SO3H
CH3



 CH3
+ HOSO3H
----►CH3
SO3H
CH3
+ HOSO3H
----►CH3
SO3H
SO3H
ЗМІСТ І ПОСЛІДОВНІСТЬ ВИКОНАННЯ ЗАВДАНЬ:
1 В круглодонну колбу приладу 1 поміщають 16 мл толуолу і обережно вносять 9,5 мл концентрованої сульфатної кислоти. Реакційну рідину протягом 1 години слабо кип"ятять, час від часу струшуючи колбу (для перемішування шарів).
2 Реакція вважається закінченою, коли шар толуолумайжезникає та з холодильника зрідка стікають краплі конденсату.
3 Потім теплу реакційну суміш виливають в склянку з 18 мл води (якщо суміш почне кристалізуватись, її необхідно підігріти) та колбу ополіскивають із промивалки.
4 Кислий розчин обережно нейтралізують 2 г карбоната натрія, додаючи його невеликими порціями, додають у розчин 5 г хлорида натрія і нагрівають суміш до кипіння (якщо хлорид натрію не розчиняється додають ще трохи води).
5 Розчин охолоджують водою з льодом.
6 Кристали натрієвої солі n-толуолсульфокислоти, які випали в осад, відсмоктують на воронці Бюхнера і віджимають між листами фільтровального паперу.

– воронка Бюхнера;
– колба з тубусом (колба Бунзена);
– запобіжна склянка (склянка Вульфа).
Рисунок 4 – Прилад для відсмоктування (для фільтрування у вакуумі)

Рисунок 5 – Водоструйний скляний вакуум – насос
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ЩОДО ВИКОНАННЯ Й ОФОРМЛЕННЯ:
При виконанні дослідів строго дотримуватися кількості реагентів та методики виконання роботи, які вказані в інструкції, а також заходів техніки безпеки.
Розрахувати практичний вихід (%)п - толуолсульфокислоти.
По закінченню роботи зробити загальний висновок.
ПІСЛЯ ВИКОНАННЯ ЛАБОРАТОРНОЇ РОБОТИ СТУДЕНТ ПОВИНЕН:
ЗНАТИ:
1 Рівняння хімічних реакцій, що відбуваються при синтезі
2 Умови проведення процесу
3 Обладнання, що використовується для синтезу
4 Фізико – хімічні властивості та використання речовин
УМІТИ:
1 Провести необхідні синтези
2 Зібрати установку для синтезу
3 Працювати самостійно згідно інструкції
4 Невідступно дотримуватись заходів техніки безпеки
5 Провести розрахунок практичного та теоретичного виходів продукту
6 Знайти необхідні довідникові дані у довіднику
ЗАХИСТ РОБОТИ:
Дати визначення реакції сульфування.
Навести рівняння основних і побічних реакцій, які відбуваються при одержанні
п-толуолсульфокислоти.
Пояснити схеми приладів для синтезуп-толуолсульфокислоти.
Пояснити розрахунок виходу п-толуолсульфокислоти.
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ:
Які сульфуючі агенти використовуються для проведення реакції сульфування.
Чому при сульфуванні використовуються великий надлишок сульфатної кислоти.
Чому температура є важливим чинником, який впливає на хід реакції сульфування.
Пояснити фізико-хімічні властивості п-толуолсульфокислоти.
Пояснити області використання п-толуолсульфокислоти.
Яких заходів техніки безпеки необхідно додержуватись при синтезах п-толуолсульфокислоти?
ЛІТЕРАТУРА
1. Храмкина М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. С 216-218, 222 – 224.
2. Храмкина М.Н. Практикум по органическому синтезу.- М.: Химия, 1974.
3. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
4. Потапов В.М., Татаринчик С.Н. Органическая химия. М.: Химия,1980.
5. Аверина А.В. Лабораторный практикум по органической химии.- М.: Высш.шк., 1980.
6. Березан О.М.Органічна хімія.- К.: Абрис, 2000.
7. Липатников В.Е. Лабораторные работы по неорганической и органической химии.- М.: Высш.шк., 1981.
ІНСТРУКЦІЙНА КАРТКА ДЛЯ ПРОВЕДЕННЯ ЛАБОРАТОРНОГО ЗАНЯТТЯ
З НАВЧАЛЬНОЇ ПРАКТИКИ «ОРГАНІЧНИЙ СИНТЕЗ»
ТЕМА:Одержання сульфанілової кислоти п-NH2С6Н4SO3Na
РОБОЧЕ МІСЦЕ: ХІМІЧНІ ЛАБОРАТОРІЇ ХТК ТРИВАЛІСТЬ ЗАНЯТТЯ: 4 ГОДИНИ
МЕТА ПРОВЕДЕННЯ ЗАНЯТТЯ:
ЗАКРІПЛЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ З ТЕМИ,
ПІДТВЕРДЖЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ ПРИ ВИКОНАННІ ЛАБОРАТОРНИХ ДОСЛІДІВ;
ОВОЛОДІННЯ МЕТОДОМ СИНТЕЗУ.
МАТЕРІАЛЬНО-ТЕХНІЧНЕ ОСНАЩЕННЯ РОБОЧОГО МІСЦЯ:
Концентрована
сульфатна кислота, анілін, натрій
гідроксид, хлоридна кислота, активоване
вугілля. Стакан фарфоровий, пробірка,
паличка, колба, термометр, воронка
Бюхнера, водяний насос, промивалка.
ПРАВИЛА ОХОРОНИ ПРАЦІ:
Дотримуватися обережності при поводженні з хімічними реактивами, скляним посудом, електричним нагрівальним приладом. Синтез проводити у витяжній шафі.
Реакція сульфування - це процес введення в молекулу органічної речовини сульфогрупи -SO3H.
Речовини, до складу яких входить сульфогрупа називають сульфуючими агентами (сульфатна кислота, її оксиди, естеритощо). Речовини, до молекул яких вводиться сульфогрупа - сульфуються. Продукти реакцій сульфування - це сульфокислоти, які застосовуються при виробництві фенолів, нафтолів, лікарських препаратів, фарбників, миючих та дезінфікуючих засобів.
t
Наприклад: R ─ H + HOSO3H ---→ R ─ SO3 H + H2O
Основна реакція:


N
 H2
+ HOSO3H
------►
NH2
.
SO3H
H2
+ HOSO3H
------►
NH2
.
SO3H


 180
– 1900С
180
– 1900С

 NH2
.
SO3H
---------------► NH2
SO3H
NH2
.
SO3H
---------------► NH2
SO3H
Побічні реакції: NH2



 NH2
+ HOSO3H
-----► SO3H
NH2
+ HOSO3H
-----► SO3H
ЗМІСТ І ПОСЛІДОВНІСТЬ ВИКОНАННЯ ЗАВДАНЬ:
1 В короткій пробірці змішують 0,8мл аніліну з 2,6мл сульфатної кислоти.
2 Суміш нагрівають 45хвилиннапісчаній бані при температурі 180-1900С
3 Після нагрівання, трохи охолоджену масу виливають уфарфорову склянку з 10 мл холодної води (ополіснуту) , при цьому сульфанілова кислота викристалізовується.
Для прискорення кристалізації необхідно скляною паличкою перемішувати по стінці склянки.
4 Викристалізовану кислоту відсмоктують мікровідсосом, промивають холодною водою і перекристалізовують із гарячої води.
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ЩОДО ВИКОНАННЯ Й ОФОРМЛЕННЯ:
При виконанні дослідів строго дотримуватися кількості реагентів та методики виконання роботи, які вказані в інструкції, а також заходів техніки безпеки.
Розрахувати практичний вихід (%) сульфанілової кислоти.
По закінченню роботи зробити загальний висновок.
ПІСЛЯ ВИКОНАННЯ ЛАБОРАТОРНОЇ РОБОТИ СТУДЕНТ ПОВИНЕН:
ЗНАТИ:
1 Рівняння хімічних реакцій, що відбуваються при синтезі
2 Умови проведення процесу
3 Обладнання, що використовується для синтезу
4 Фізико – хімічні властивості та використання речовин
УМІТИ:
1 Провести необхідні синтези
2 Зібрати установку для синтезу
3 Працювати самостійно згідно інструкції
4 Невідступно дотримуватись заходів техніки безпеки
5 Провести розрахунок практичного та теоретичного виходів продукту
6 Знайти необхідні довідникові дані у довіднику
ЗАХИСТ РОБОТИ:
Дати визначення реакції сульфування.
Навести рівняння основних і побічних реакцій, які відбуваються при одержанні кислоти.
Пояснити схеми приладів для синтезу сульфанілової кислоти.
Пояснити розрахунок виходу сульфанілової кислоти.
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ:
Які сульфуючі агенти використовуються для проведення реакції сульфування.
Чому при сульфуванні використовуються великий надлишок сульфатної кислоти.
Чому температура є важливим чинником, який впливає на хід реакції сульфування.
Пояснити фізико-хімічні властивості сульфанілової кислоти.
Пояснити області використання сульфанілової кислоти.
Яких заходів техніки безпеки необхідно додержуватись при синтезі сульфанілової кислоти.
ЛІТЕРАТУРА
1. Храмкина М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. С 216-218, 224 – 226.
2. Храмкина М.Н. Практикум по органическому синтезу.- М.: Химия, 1974.
3. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
4. Потапов В.М., Татаринчик С.Н. Органическая химия. М.: Химия,1980.
5. Аверина А.В. Лабораторный практикум по органической химии.- М.: Высш.шк., 1980.
6. Березан О.М.Органічна хімія.- К.: Абрис, 2000.
ІНСТРУКЦІЙНА КАРТКА ДЛЯ ПРОВЕДЕННЯ ЛАБОРАТОРНОГО ЗАНЯТТЯ
З НАВЧАЛЬНОЇ ПРАКТИКИ «ОРГАНІЧНИЙ СИНТЕЗ»
ТЕМА:Одержання діазоамінобензолу
РОБОЧЕ МІСЦЕ: ХІМІЧНІ ЛАБОРАТОРІЇ ХТК ТРИВАЛІСТЬ ЗАНЯТТЯ: 2 ГОДИНИ
МЕТА ПРОВЕДЕННЯ ЗАНЯТТЯ:
ЗАКРІПЛЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ З ТЕМИ,
ПІДТВЕРДЖЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ ПРИ ВИКОНАННІ ЛАБОРАТОРНИХ ДОСЛІДІВ;
ОВОЛОДІННЯ МЕТОДОМ СИНТЕЗУ.
МАТЕРІАЛЬНО-ТЕХНІЧНЕ ОСНАЩЕННЯ РОБОЧОГО МІСЦЯ:
Анілін,
концентрована сульфатна кислота, натрій
ацетат, натрій нітрит.
Стакан, колба круглодонна, воронка Бюхнера, водяний насос, фільтрувальний папір.
ПРАВИЛА ОХОРОНИ ПРАЦІ:
Дотримуватися обережності при поводженні з хімічними реактивами, скляним посудом, електричним нагрівальним приладом. Синтез проводити у витяжній шафі.
Реакція діазотування - це процес взаємодії первинних, ароматичних амінів з нітритною кислотою НNO2 в кислому середовищі, але нітритна кислота не стійка, тому використовуються її солі NaNO2, КNO2, при цьому одержують солі діазонію.
Такі реакції проходять як з виділенням вільного азоту, так і без виділення.
Солі діазонію - це проміжні продукти, які використовують для одержання азотосполук:
H-X, t=5°С
Аr-NH2 + HO─ NO2 -------------> [Аr-N=N]Х + 2Н2О
сіль діазонію
де – Х – кислотний залишок
N= N - діазогрупа
Реакція азосполучення - процес взаємодії солей діазонію з ароматичними амінами або фенолами, при цьому одержуються стійкі азотосполуки, які використовуються як фарбники, індикатори, лікарські засоби. t
[ Аr - N = N ] X + НАrУ > [ Аr- N = N- Аr ]У + НХ
де У – аміносполука
N = N – азосполука




N = N─NH
діазоамінобензол
Основна реакція:





 NaNO2
NaNO2
NH2 + H2SO4 ---► [ NH3]+ HSO4 - --------------------►




NH2

 [ N≡N]+
HSO4-
-------------------------------------►
[ N≡N]+
HSO4-
-------------------------------------►




N ═ N – NH
------------------►
ЗМІСТ І ПОСЛІДОВНІСТЬ ВИКОНАННЯ ЗАВДАНЬ:
1 В склянку на 100 мл поміщують 16 мл води, при перемішуванні додають 1,7мл концентрованоїсульфатної кислоти.
2 До ще гарячої рідини при перемішуванні додають 3,1мл аніліну.
3 Розчин охолоджують до кімнатної температури, потім додають 35г льоду.
4 До охолодженого розчину додають при перемішуванні розчин 1,3г натрій нітритуу 10 мл води.
5 До отриманої суміші при перемішуванні додають розчин, що вміщує 8гацетатунатрію у30мл води.
6 Випавший діазоамінобензол відсмоктують, промивають водою і сушать на повітрі.
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ЩОДО ВИКОНАННЯ Й ОФОРМЛЕННЯ:
При виконанні дослідів строго дотримуватися кількості реагентів та методики виконання роботи, які вказані в інструкції, а також заходів техніки безпеки.
Розрахувати практичний вихід (%)діазоамінобензолу.
По закінченню роботи зробити загальний висновок.
ПІСЛЯ ВИКОНАННЯ ЛАБОРАТОРНОЇ РОБОТИ СТУДЕНТ ПОВИНЕН:
ЗНАТИ:
1 Рівняння хімічних реакцій, що відбуваються при синтезі
2 Умови проведення процесу
3 Обладнання, що використовується для синтезу
4 Фізико – хімічні властивості та використання речовин
УМІТИ:
1 Провести необхідні синтези
2 Зібрати установку для синтезу
3 Працювати самостійно згідно інструкції
4 Невідступно дотримуватись заходів техніки безпеки
5 Провести розрахунок практичного та теоретичного виходів продукту
6 Знайти необхідні довідникові дані у довіднику
ЗАХИСТ РОБОТИ:
Дати визначення реакції діазотування.
Чому не використовується вільна нітратна кислота для проведення діазотування.
Пояснити необхідність використання надлишку мінеральної кислоти для проведення діазотування.
Пояснити необхідність проведення реакції діазотування у товстостінному стакані при перемішуванні.
Пояснити необхідність для проведення діазотування додержання температури 0-5°С.
Навести рівняння основних і побічних реакцій синтезудіазоамінобензолу.
Пояснити схеми приладів для синтезудіазоамінобензолу
Пояснити розрахунок виходу діазоамінобензолу
Пояснити властивості діазоамінобензолу.
Яких заходів техніки безпеки необхідно додержуватись при проведенні синтезу.
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ:
Як при проведенні діазотування попереджується накопичення нітратної кислоти.
Як проводиться контроль ходу реакції діазотування.
Чому не зберігаються розчини солей діазонія на світлі.
Чому використовуються розчини солей діазонія, а не сухі солі.
Дати визначення реакції азосполучення.
Чим обумовлене забарвлення азосполук.
В чому відмінність забарвлених речовин від барвників.
Які оптимальні умови проведення реакції азосполучення.
Які речовини називаються діазокомпонентами і азокомпонентами.
ЛІТЕРАТУРА
1. Храмкина М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. С 226 – 231.
2. Храмкина М.Н. Практикум по органическому синтезу.- М.: Химия, 1974.
3. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
4. Потапов В.М., Татаринчик С.Н. Органическая химия. М.: Химия,1980.
5. Аверина А.В. Лабораторный практикум по органической химии.- М.: Высш.шк., 1980.
6. Березан О.М.Органічна хімія.- К.: Абрис, 2000.
7. Липатников В.Е. Лабораторные работы по неорганической и органической химии.- М.: Высш.шк., 1981.
ІНСТРУКЦІЙНА КАРТКА ДЛЯ ПРОВЕДЕННЯ ЛАБОРАТОРНОГО ЗАНЯТТЯ
З НАВЧАЛЬНОЇ ПРАКТИКИ «ОРГАНІЧНИЙ СИНТЕЗ»
ТЕМА:Одержання п - аміноазобензолу
РОБОЧЕ МІСЦЕ: ХІМІЧНІ ЛАБОРАТОРІЇ ХТК ТРИВАЛІСТЬ ЗАНЯТТЯ: 4 ГОДИНИ
МЕТА ПРОВЕДЕННЯ ЗАНЯТТЯ:
ЗАКРІПЛЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ З ТЕМИ,
ПІДТВЕРДЖЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ ПРИ ВИКОНАННІ ЛАБОРАТОРНИХ ДОСЛІДІВ;
ОВОЛОДІННЯ МЕТОДОМ СИНТЕЗУ.
МАТЕРІАЛЬНО-ТЕХНІЧНЕ ОСНАЩЕННЯ РОБОЧОГО МІСЦЯ:
Діазоамінобензол,
анілін, анілін гідрохлорид (солянокислий),
сульфатна кислота концентрована. Стакан,
колба круглодонна, воронка Бюхнера,
водяний насос, палочка, промивалка.
ПРАВИЛА ОХОРОНИ ПРАЦІ:
Дотримуватися обережності при поводженні з хімічними реактивами, скляним посудом, електричним нагрівальним приладом. Синтез проводити у витяжній шафі.
Реакція діазотування - це процес взаємодії первинних, ароматичних амінів з нітритною кислотою НNO2 в кислому середовищі, але нітритна кислота не стійка, тому використовуються її солі NaNO2, КNO2, при цьому одержують солі діазонію.
Такі реакції проходять як з виділенням вільного азоту, так і без виділення.
Солі діазонію - це проміжні продукти, які використовують для одержання азотосполук:
H-X, t=5°С
Аr-NH2 + HO─ NO2 -------------> [Аr-N=N]Х + 2Н2О
сіль діазонію
де – Х – кислотний залишок
N= N - діазогрупа
Реакція азосполучення - процес взаємодії солей діазонію з ароматичними амінами або фенолами, при цьому одержуються стійкі азотосполуки, які використовуються як фарбники, індикатори, лікарські засоби. t
[ Аr - N = N ] X + НАrУ > [ Аr- N = N- Аr ]У + НХ
де У – аміносполука
N = N – азосполука




- N = N - - NH2
п – аміноазобензол
Основна реакція:




N═N ─NH --------------------►




------------------► N═N NH2
ЗМІСТ І ПОСЛІДОВНІСТЬ ВИКОНАННЯ ЗАВДАНЬ:
1 2 г діазоамінобензолу нагрівають у круглодонній колбі з 4,9 мл аніліна, до якого попереднє прибавляють 1 г солянокислого аніліну.
2 Нагрівання проводять на водяній бані30хв.при30 0С, а потім ще30хв. при 450С.
3 Після закінчення реакції анілінвидаляють 24 мл 10% соляної кислоти .
4 Залишившийся солянокислий п-аміноазобензол перекристалізовують з 100 кратної кількості горячої води, яка має 10 мл концентрованої сульфатної кислоти.
5 Темно-фіолетові криштали солянокислого п-аміноазобензолу відсмоктують.
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ЩОДО ВИКОНАННЯ Й ОФОРМЛЕННЯ:
При виконанні дослідів строго дотримуватися кількості реагентів та методики виконання роботи, які вказані в інструкції, а також заходів техніки безпеки.
Розрахувати практичний вихід (%) п - аміноазобензолу
По закінченню роботи зробити загальний висновок.
ПІСЛЯ ВИКОНАННЯ ЛАБОРАТОРНОЇ РОБОТИ СТУДЕНТ ПОВИНЕН:
ЗНАТИ:
1 Рівняння хімічних реакцій, що відбуваються при синтезі
2 Умови проведення процесу
3 Обладнання, що використовується для синтезу
4 Фізико – хімічні властивості та використання речовин
УМІТИ:
1 Провести необхідні синтези
2 Зібрати установку для синтезу
3 Працювати самостійно згідно інструкції
4 Невідступно дотримуватись заходів техніки безпеки
5 Провести розрахунок практичного та теоретичного виходів продукту
6 Знайти необхідні довідникові дані у довіднику
ЗАХИСТ РОБОТИ:
Дати визначення реакції діазотування.
Чому не використовується вільна нітратна кислота для проведення діазотування.
Пояснити необхідність використання надлишку мінеральної кислоти для проведення діазотування.
Пояснити необхідність проведення реакції діазотування у товстостінному стакані при перемішуванні.
Пояснити необхідність для проведення діазотування додержання температури 0 -5°С.
Навести рівняння основних і побічних реакцій синтезуп-амінобензолу.
Пояснити схеми приладів для синтезу п-амінобензолу.
Пояснити розрахунок виходу п-амінобензолу.
Пояснити властивості п-амінобензолу.
Яких заходів техніки безпеки необхідно додержуватись при проведенні синтезу.
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ:
Як при проведенні діазотування попереджується накопичення нітратної кислоти.
Як проводиться контроль ходу реакції діазотування.
Чому не зберігаються розчини солей діазонія на світлі.
Чому використовуються розчини солей діазонія, а не сухі солі.
Дати визначення реакції азосполучення.
Чим обумовлене забарвлення азосполук.
В чому відмінність забарвлених речовин від барвників.
Які оптимальні умови проведення реакції азосполучення.
Які речовини називаються діазокомпонентами і азокомпонентами.
ЛІТЕРАТУРА
1. Храмкина М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. С 226 – 231.
2. Храмкина М.Н. Практикум по органическому синтезу.- М.: Химия, 1974.
3. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
4. Потапов В.М., Татаринчик С.Н. Органическая химия. М.: Химия,1980.
5. Аверина А.В. Лабораторный практикум по органической химии.- М.: Высш.шк., 1980.
6. Березан О.М.Органічна хімія.- К.: Абрис, 2000.
7. Липатников В.Е. Лабораторные работы по неорганической и органической химии.- М.: Высш.шк., 1981.
ІНСТРУКЦІЙНА КАРТКА ДЛЯ ПРОВЕДЕННЯ ЛАБОРАТОРНОГО ЗАНЯТТЯ
З НАВЧАЛЬНОЇ ПРАКТИКИ «ОРГАНІЧНИЙ СИНТЕЗ»
ТЕМА: Одержання фенолфталеїну і флуоресцеїну
РОБОЧЕ МІСЦЕ: ХІМІЧНІ ЛАБОРАТОРІЇ ХТК ТРИВАЛІСТЬ ЗАНЯТТЯ: 2 ГОДИНИ
МЕТА ПРОВЕДЕННЯ ЗАНЯТТЯ:
ЗАКРІПЛЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ З ТЕМИ,
ПІДТВЕРДЖЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ ПРИ ВИКОНАННІ ЛАБОРАТОРНИХ ДОСЛІДІВ;
ОВОЛОДІННЯ МЕТОДОМ СИНТЕЗУ.
МАТЕРІАЛЬНО-ТЕХНІЧНЕ ОСНАЩЕННЯ РОБОЧОГО МІСЦЯ:
Фталевий
ангідрид, фенол, їдкий натр, хлоридна
кислота, концентрована сульфатна
кислота. Стакан, колба круглодонна,
пробірка, мірний циліндр, промивалка.
ПРАВИЛА ОХОРОНИ ПРАЦІ:
Дотримуватися обережності при поводженні з хімічними реактивами, скляним посудом, електричним нагрівальним приладом. Синтез проводити у витяжній шафі.
Реакція діазотування - це процес взаємодії первинних, ароматичних амінів з нітритною кислотою НNO2 в кислому середовищі, але нітритна кислота не стійка, тому використовуються її солі NaNO2, КNO2, при цьому одержують солі діазонію.
Такі реакції проходять як з виділенням вільного азоту, так і без виділення.
Солі діазонію - це проміжні продукти, які використовують для одержання азотосполук:
H-X, t=5°С
Аr-NH2 + HO─ NO2 -------------> [Аr-N=N]Х + 2Н2О
сіль діазонію
де – Х – кислотний залишок, N= N - діазогрупа
Реакція азосполучення - процес взаємодії солей діазонію з ароматичними амінами або фенолами, при цьому одержуються стійкі азотосполуки, які використовуються як фарбники, індикатори, лікарські засоби. t
[ Аr - N = N ] X + НАrУ > [ Аr- N = N- Аr ]У + НХ
де У – аміносполука, N = N – азосполука
Основна реакція одержання фенолфталеїну


H
 O
OH
O
OH
H O H
║ H2SO4

 --- C
------O
-----------------------------►
--- C
------O
-----------------------------►
 -H2O
-H2O
---- C
||
O


H

 O
OH
O
OH


 C ------ O
C ------ O


-- C
||
O
ЗМІСТ І ПОСЛІДОВНІСТЬ ВИКОНАННЯ ЗАВДАНЬ:
1 В суху колбу розміщується 0,5 г фталевого ангідрида і 1г фенолу.
Додається 0,2 мл концентрованої сульфатноїкислоти.
2Вміст колби
нагрівається обережно до сплавлення
суміші.
З’являється темно-червоне забарвлення.
3 Дати суміші охолонути і додати 0,5 мл води.
4 Частину одержаного розчину відлити у другу колбу і додати по краплям їдкий натр.
У першу частину розчину додати розведену сульфатну кислоту. Відмітити зміну забарвлення.
Основна реакція одержання флуоресцеїну






 HO
OH HO
OH
HO
OH HO
OH


H O H
 ||
H2SO4
||
H2SO4

 C
------ O
----------------------------------►
C
------ O
----------------------------------►
 -H2O
-H2O
-- C
||
O




 HO -
-- O ---
OH
HO -
-- O ---
OH




 -- С
-- С
О
 -- C
-- C
||
O
ЗМІСТ І ПОСЛІДОВНІСТЬ ВИКОНАННЯ ЗАВДАНЬ:
Виконання синтезу флуоресцеїну проводиться аналогічно синтезу фенолфталеїну, але замість фенолу необхідно взяти резорцин.
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ЩОДО ВИКОНАННЯ Й ОФОРМЛЕННЯ:
При виконанні дослідів строго дотримуватися кількості реагентів та методики виконання роботи, які вказані в інструкції, а також заходів техніки безпеки.
По закінченню роботи зробити загальний висновок.
ПІСЛЯ ВИКОНАННЯ ЛАБОРАТОРНОЇ РОБОТИ СТУДЕНТ ПОВИНЕН:
ЗНАТИ:
1 Рівняння хімічних реакцій, що відбуваються при синтезі
2 Умови проведення процесу
3 Обладнання, що використовується для синтезу
4 Фізико – хімічні властивості та використання речовин
УМІТИ:
1 Провести необхідні синтези
2 Зібрати установку для синтезу
3 Працювати самостійно згідно інструкції
4 Невідступно дотримуватись заходів техніки безпеки
5 Провести розрахунок практичного та теоретичного виходів продукту
6 Знайти необхідні довідникові дані у довіднику
ЗАХИСТ РОБОТИ:
Дати визначення реакції діазотування.
Пояснити необхідність проведення реакції діазотування у товстостінному стакані при перемішуванні.
Пояснити необхідність для проведення діазотування додержання температури 0-5°С.
Навести рівняння основних і побічних реакцій синтезів фенолфталеїну, флуоресцеїну.
Пояснити схеми приладів для синтезів фенолфталеїну, флуоресцеїну.
Пояснити властивості фенолфталеїну, флуоресцеїну.
Яких заходів техніки безпеки необхідно додержуватись при проведенні синтезів.
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ:
Чому не зберігаються розчини солей діазонія на світлі.
Дати визначення реакції азосполучення.
Чим обумовлене забарвлення азосполук.
В чому відмінність забарвлених речовин від барвників.
Які оптимальні умови проведення реакції азосполучення.
Які речовини називаються діазокомпонентами і азокомпонентами.
ЛІТЕРАТУРА
1. Храмкина М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. С 226 – 231.
2. Храмкина М.Н. Практикум по органическому синтезу.- М.: Химия, 1974.
3. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
4. Потапов В.М., Татаринчик С.Н. Органическая химия. М.: Химия,1980.
5. Аверина А.В. Лабораторный практикум по органической химии.- М.: Высш.шк., 1980.
6. Березан О.М.Органічна хімія.- К.: Абрис, 2000.
ІНСТРУКЦІЙНА КАРТКА ДЛЯ ПРОВЕДЕННЯ ЛАБОРАТОРНОГО ЗАНЯТТЯ
З НАВЧАЛЬНОЇ ПРАКТИКИ «ОРГАНІЧНИЙ СИНТЕЗ»
ТЕМА: Одержання етилового етеру 2 – нафтолу (нероліну) С10Н7ОС2Н5
РОБОЧЕ МІСЦЕ: ХІМІЧНІ ЛАБОРАТОРІЇ ХТК ТРИВАЛІСТЬ ЗАНЯТТЯ: 4 ГОДИНИ
МЕТА ПРОВЕДЕННЯ ЗАНЯТТЯ:
ЗАКРІПЛЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ З ТЕМИ,
ПІДТВЕРДЖЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ ПРИ ВИКОНАННІ ЛАБОРАТОРНИХ ДОСЛІДІВ;
ОВОЛОДІННЯ МЕТОДОМ СИНТЕЗУ.
МАТЕРІАЛЬНО-ТЕХНІЧНЕ ОСНАЩЕННЯ РОБОЧОГО МІСЦЯ:
2
– нафтол, етанол, сульфатна кислота
концентрована, 5% натрій гідроксид.
Стакан, колба круглодонна, мішалка,
холодильник зворотний Лібіха, воронка
скляна, воронка ділильна, воронка
краплинна, трубка хлоркальцієва, колба
Вюрца, термометр, алонж, холодильник
повітряний, пробірка, мірний циліндр,
мішалка, водяна баня.
ПРАВИЛА ОХОРОНИ ПРАЦІ:
Дотримуватися обережності при поводженні з хімічними реактивами, скляним посудом, електричним нагрівальним приладом. Синтез проводити у витяжній шафі.
Реакція алкілування- реакція заміщення атому гідрогену ароматичного ядра на відповідну алкільну групу.
Ароматичні вуглеводні можна алкілувати спиртами в присутності сульфатної кислоти, а також АlCl3, HF, P2O5, Н3PO4.
Протон сульфатної кислоти (Н+) з молекулою спирту дає карбкатіон, що є алкілюючим агентом.
Основна реакція



 H2SO4
H2SO4
C


 H3CH2OH
+ OH
----------► - OCH2CH3
+ Н2О
H3CH2OH
+ OH
----------► - OCH2CH3
+ Н2О
+
ЗМІСТ І ПОСЛІДОВНІСТЬ ВИКОНАННЯ ЗАВДАНЬ:
ЗБІР ПРИЛАДІВ
1 Круглодонну колбу місткістю 100 мл з'єднують із зворотнім холодильником та встановлюють її на гліцеринову чи повітряну баню.
2 Прилад для відсмоктування.
ВИКОНАННЯ СИНТЕЗУ
1 В круглодонну колбу місткістю 50 мл вносять 3 г 2-нафтола, вливають 7,5 мл абсолютного етанолу та обережно трясуть колбу до розчинення більшої частини 2-нафтола, потім додають
1,1 мл концентрованої сульфатної кислоти (спостерігається сильне розігрівання суміші).
2 Колбу поміщають на водяну баню та нагрівають при кипінні протягом 3-4 годин.
3 Після закінчення нагрівання теплий розчин виливають в конічну колбу місткістю 100 мл, де міститься 18 мл 5%-го розчину гідроксиду натрію, нагрітого до 50 °С ; при цьому неролін осідає у вигляді темного масла , котре мішалкою перемішують з розчином лугу до тих пір, доки неролін повністю не затвердіє.
Щоб запобігти миттєвому затвердінню сирого нероліну в момент вливання реакційної суміші в розчин лугу, потрібно останній добре нагріти, причому нагрівання конічної колби слід вести обережно на водяній бані.
4 Осад брудно -пісочного кольору відфільтровують на воронці Бюхнера та знову обробляють, як і в перший раз, такою ж кількістю розчину гідроксиду натрію.
5 Неролін відстоюють, промивають водою до зникнення лужної реакції на лакмус та вимішують при температурі не більш 50 °С.
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ЩОДО ВИКОНАННЯ Й ОФОРМЛЕННЯ:
При виконанні дослідів строго дотримуватися кількості реагентів та методики виконання роботи, які вказані в інструкції, а також заходів техніки безпеки.
По закінченню роботи зробити загальний висновок.
Розрахувати практичний вихід (%)нероліну.
ПІСЛЯ ВИКОНАННЯ ЛАБОРАТОРНОЇ РОБОТИ СТУДЕНТ ПОВИНЕН:
ЗНАТИ:
1 Рівняння хімічних реакцій, що відбуваються при синтезі
2 Умови проведення процесу
3 Обладнання, що використовується для синтезу
4 Фізико – хімічні властивості та використання речовин
УМІТИ:
1 Провести необхідні синтези
2 Зібрати установку для синтезу
3 Працювати самостійно згідно інструкції
4 Невідступно дотримуватись заходів техніки безпеки
5 Провести розрахунок практичного та теоретичного виходів продукту
6 Знайти необхідні довідникові дані у довіднику
ЗАХИСТ РОБОТИ:
Дати визначення реакції алкілування
Які алкілюючі агенти використовуються для проведення реакції?
Навести приклади основних та побічних реакцій, які відбуваються при одержаннінероліну
Пояснити схеми установок для синтезів нероліну
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ:
Пояснити області використання нероліну
Яких заходів техніки безпеки необхідно дотримуватись при синтезах нероліну
Чому перед синтезом всі реагенти необхідно висушити?
Пояснити фізико-хімічні властивості нероліну
ЛІТЕРАТУРА
1. Храмкина М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. С 128 - 132, 138 – 139.
2. Храмкина М.Н. Практикум по органическому синтезу.- М.: Химия, 1974.
3. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
4. Потапов В.М., Татаринчик С.Н. Органическая химия. М.: Химия,1980.
5. Аверина А.В. Лабораторный практикум по органической химии.- М.: Высш.шк., 1980.
6. Березан О.М.Органічна хімія.- К.: Абрис, 2000.
7. Липатников В.Е. Лабораторные работы по неорганической и органической химии.- М.: Высш.шк., 1981.
ІНСТРУКЦІЙНА КАРТКА ДЛЯ ПРОВЕДЕННЯ ЛАБОРАТОРНОГО ЗАНЯТТЯ
З НАВЧАЛЬНОЇ ПРАКТИКИ «ОРГАНІЧНИЙ СИНТЕЗ»
ТЕМА: Одержання діізоамілового етеру (С5Н10 )2О
РОБОЧЕ МІСЦЕ: ХІМІЧНІ ЛАБОРАТОРІЇ ХТК ТРИВАЛІСТЬ ЗАНЯТТЯ: 4 ГОДИНИ
МЕТА ПРОВЕДЕННЯ ЗАНЯТТЯ:
ЗАКРІПЛЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ З ТЕМИ,
ПІДТВЕРДЖЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ ПРИ ВИКОНАННІ ЛАБОРАТОРНИХ ДОСЛІДІВ;
ОВОЛОДІННЯ МЕТОДОМ СИНТЕЗУ.
МАТЕРІАЛЬНО-ТЕХНІЧНЕ ОСНАЩЕННЯ РОБОЧОГО МІСЦЯ:
Ізоаміловий
спирт, сульфатна кислота концентрована,
калій карбонат. Колба плоскодонна
конічна, колба круглодонна, мішалка,
холодильник зворотний Лібіха, воронка
скляна, насадка для відокремлення води,
воронка ділильна, колба Вюрца, термометр,
алонж, холодильник повітряний, мірний
циліндр, мішалка, водяна баня.
ПРАВИЛА ОХОРОНИ ПРАЦІ:
Дотримуватися обережності при поводженні з хімічними реактивами, скляним посудом, електричним нагрівальним приладом. Синтез проводити у витяжній шафі, дотримуючись великої обережності, так як етери сульфатної кислоти дуже отруйні.
Ароматичні вуглеводні можна алкілувати
спиртами в присутності сульфатної
кислоти, а також АlCl3,HF,P2O5,
Н3PO4. Утворення
етерів дегідратацією спиртів відбувається
тільки у присутності протонів, що
виконують роль каталізаторів. В
залежності від властивостей спирту та
етеру, що утворюється, використовується
той чи інший кислий реагент.
Основна реакція
H2SO4
2(CH3 )2СНCH2CH2OH
----------► (CH3 )2СНCH2CH2OCH2CH2СН(CH3)2+ Н2О
Реакція алкілування– процес введення алкільних радикалів у органічні сполуки.
Побічна реакція
H2SO4
(CH3 )2СНCH2CH2OH ----------► (CH3 )2СНCH=CH2 + Н2О

1 – колба круглодонна
2 – насадка для відокремлення
води
3 – зворотний холодильник
Рисунок 6 – Прилад з насадкою для
відокремлнння води
ВИКОНАННЯ СИНТЕЗУ
1 В круглодонну колбу місткістю 100 мл вносять 12мл ізоамілового спирту, вливають 0,4 мл концентрованої сульфатної кислоти.
2 Колбу поміщують на водяну баню та повільно кіп'ятятьпротягом 2 годин до тих пір, поки у водовідокремлювачі не збереться 1мл води.
3 Вміст колби охолоджують до 1000С та перегоняють з водяною парою. Перегонку ведуть до тих пір, поки у дистилят не перестануть переходити оліїсті краплі.
4 Дистилят переносять у ділильну воронку, відокремлюють етер від водяного шару у суху колбу та сушать його невеликою кількістю прокаленого карбонату калію.
5 Висушений етер поміщується у колбу Вюрца на 100мл, яка поєднана з повітряним холодильником. Починають повільно нагрівати колбу. В межах 165 – 1720С відгоняється діізоаміловий етер.
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ЩОДО ВИКОНАННЯ Й ОФОРМЛЕННЯ:
1 При виконанні дослідів строго дотримуватися кількості реагентів та методики виконання роботи, які вказані в інструкції, а також заходів техніки безпеки.
2 По закінченню роботи зробити загальний висновок.
3 Розрахувати практичний вихід (%) діізоаміловогоетеру.
ПІСЛЯ ВИКОНАННЯ ЛАБОРАТОРНОЇ РОБОТИ СТУДЕНТ ПОВИНЕН:
ЗНАТИ:
1 Рівняння хімічних реакцій, що відбуваються при синтезі
2 Умови проведення процесу
3 Обладнання, що використовується для синтезу
4 Фізико – хімічні властивості та використання речовин
УМІТИ:
1 Провести необхідні синтези
2 Зібрати установку для синтезу
3 Працювати самостійно згідно інструкції
4 Невідступно дотримуватись заходів техніки безпеки
5 Провести розрахунок практичного та теоретичного виходів продукту
6 Знайти необхідні довідникові дані у довіднику
ЗАХИСТ РОБОТИ:
Дати визначення реакції алкілування.
Які алкілюючі агенти використовуються для проведення реакції?
Навести приклади основних та побічних реакцій, які відбуваються при одержанні діізоамілового етеру.
Пояснити схеми установок для синтезудіізоаміловогоетеру.
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ:
Пояснити області використання діізоаміловогоетеру.
Яких заходів техніки безпеки необхідно дотримуватись при синтезідіізоаміловогоетеру.
Пояснити фізико-хімічні властивості діізоаміловогоетеру.
ЛІТЕРАТУРА
1. Храмкина М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988.
С 128 - 132, 134 – 136.
2. Храмкина М.Н. Практикум по органическому синтезу.- М.: Химия, 1974.
3. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
4. Потапов В.М., Татаринчик С.Н. Органическая химия. М.: Химия,1980.
5. Аверина А.В. Лабораторный практикум по органической химии.- М.: Высш.шк., 1980.
6. Березан О.М. Органічна хімія.- К.: Абрис, 2000.
ІНСТРУКЦІЙНА КАРТКА ДЛЯ ПРОВЕДЕННЯ ЛАБОРАТОРНОГО ЗАНЯТТЯ
З НАВЧАЛЬНОЇ ПРАКТИКИ «ОРГАНІЧНИЙ СИНТЕЗ»
ТЕМА: Одержання ацетооцтового естеру СН3СОСН2СООС2Н5
РОБОЧЕ МІСЦЕ: ХІМІЧНІ ЛАБОРАТОРІЇ ХТК ТРИВАЛІСТЬ ЗАНЯТТЯ: 4 ГОДИНИ
МЕТА ПРОВЕДЕННЯ ЗАНЯТТЯ:
ЗАКРІПЛЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ З ТЕМИ,
ПІДТВЕРДЖЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ ПРИ ВИКОНАННІ ЛАБОРАТОРНИХ ДОСЛІДІВ;
ОВОЛОДІННЯ МЕТОДОМ СИНТЕЗУ.
МАТЕРІАЛЬНО-ТЕХНІЧНЕ ОСНАЩЕННЯ РОБОЧОГО МІСЦЯ:
Етилацетат,
оцтова кислота, натрій, натрій хлорид,
натрій гідрокарбонат, кальцій хлорид,
лакмус.
Стакан, колба круглодонна, мішалка, холодильник зворотний Лібіха, воронка ділильна, трубка хлоркальцієва, колба Вюрца, термометр, алонж, пробірка, мірний циліндр, мішалка, водяна баня.
ПРАВИЛА ОХОРОНИ ПРАЦІ:
Дотримуватися обережності при поводженні з хімічними реактивами, скляним посудом, електричним нагрівальним приладом. Синтез проводити у витяжній шафі. Етилацетат вогненебезпечний та утворює з повітрям вибухонебезпечні суміші.
Реакція Клайзенавідноситься до типу альдольних реакцій і заключається в конденсації естерів зі сполуками, які містять активну метиленову групу (естери, кетони, нітриди) в присутності основних каталізаторів (металевий натрій, його амід, магній органічні сполуки).

-------► СН3─ С ─ СН2─ С ─ О ─ С2Н5
║ ║
О О
Основна реакція
O O O O
║ ║ NaOC2H5 ║ ║
CH3—C—O—C2H5 + CH3 –C—O—C2H5 ---------------► CH3—C— CH2—C—O—C2H5
C2H5OH
ЗМІСТ І ПОСЛІДОВНІСТЬ ВИКОНАННЯ ЗАВДАНЬ:
1. В круглодонну колбу з зворотним холодильником поміщують 11,2 мл оцтовоетилового естеру і додають невеликими кількостями 1 г дрібно нарізаного металічного натрію. Поступово починається слабке виділення водню і рідина закіпає.
2. Колбу із сумішшю нагрівають на піщаній бані впродовж 2-3 годин, підтримуючи слабке кипіння, потім додають 2-3 мл етилового спирту, щоб перевести не вступивший у реакцію натрій металічний у етилат натрію.
3. Утворившийся прозорий розчин при перемішуванні підкислюють 6 мл 50% оцтової кислоти до кислої реакції на лакмус.
4. Після цього для розшаровування суміші додають насичений розчин хлориду натрію, у об'ємі, що дорівнює об'єму суміші. Якщо при цьому випадає осадок, його розчиняють невеликим об'ємом води.
5. Суміш переносять в розподільну воронку, відокремлюють верхній шар та вструшують його, додають до нього 8 мл насиченого розчину гідрокарбонату натрію.
6. Відокремлюють верхній шар розчину та сушать його 2 г хлоридакальцію
7 Висушений розчин переносять в колбу Вюрца та перегоняють на приладі, збираючи фракцію при t кип.= 86-90°С
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ЩОДО ВИКОНАННЯ Й ОФОРМЛЕННЯ:
При виконанні дослідів строго дотримуватися кількості реагентів та методики виконання роботи, які вказані в інструкції, а також заходів техніки безпеки.
По закінченню роботи зробити загальний висновок.
Розрахувати практичний вихід (%)ацетооцтового естеру.
ПІСЛЯ ВИКОНАННЯ ЛАБОРАТОРНОЇ РОБОТИ СТУДЕНТ ПОВИНЕН:
ЗНАТИ:
1 Рівняння хімічних реакцій, що відбуваються при синтезі
2 Умови проведення процесу
3 Обладнання, що використовується для синтезу
4 Фізико – хімічні властивості та використання речовин
УМІТИ:
1 Провести необхідні синтези
2 Зібрати установку для синтезу
3 Працювати самостійно згідно інструкції
4 Невідступно дотримуватись заходів техніки безпеки
5 Провести розрахунок практичного та теоретичного виходів продукту
6 Знайти необхідні довідникові дані у довіднику
ЗАХИСТ РОБОТИ:
Дати визначення реакції Клайзена.
Пояснити умови реакції Клайзена.
Навести рівняння основних і побічних реакцій, які відбуваються при одержанні ацетооцтового ефіру Пояснити схеми приладів для синтезів ацетооцтового естеру
Пояснити розрахунок виходу ацетооцтового естеру
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ:
Пояснити фізико-хімічні властивості ацетооцтового естеру
Пояснити області використання ацетооцтового естеру
Яких заходів техніки безпеки необхідно дотримуватись при синтезах ацетооцтового естеру
ЛІТЕРАТУРА
1. Храмкина М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. С 258 - 260, 263 - 265.
2. Храмкина М.Н. Практикум по органическому синтезу.- М.: Химия, 1974.
3. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
4. Потапов В.М., Татаринчик С.Н. Органическая химия. М.: Химия,1980.
5. Аверина А.В. Лабораторный практикум по органической химии.- М.: Высш.шк., 1980.
6. Березан О.М.Органічна хімія.- К.: Абрис, 2000.
7. Липатников В.Е. Лабораторные работы по неорганической и органической химии.- М.: Высш.шк., 1981.
ІНСТРУКЦІЙНА КАРТКА ДЛЯ ПРОВЕДЕННЯ ЛАБОРАТОРНОГО ЗАНЯТТЯ
З НАВЧАЛЬНОЇ ПРАКТИКИ «ОРГАНІЧНИЙ СИНТЕЗ»
ТЕМА: Одержання бензойної кислоти C6H5CОOH та бензилового спирту C6H5CH2OH
РОБОЧЕ МІСЦЕ: ХІМІЧНІ ЛАБОРАТОРІЇ ХТК ТРИВАЛІСТЬ ЗАНЯТТЯ: 6 ГОДИН
МЕТА ПРОВЕДЕННЯ ЗАНЯТТЯ:
ЗАКРІПЛЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ З ТЕМИ,
ПІДТВЕРДЖЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ ПРИ ВИКОНАННІ ЛАБОРАТОРНИХ ДОСЛІДІВ;
ОВОЛОДІННЯ МЕТОДОМ СИНТЕЗУ.
МАТЕРІАЛЬНО-ТЕХНІЧНЕ ОСНАЩЕННЯ РОБОЧОГО МІСЦЯ:
Бензальдегід,
калій гідроксид, натрій гідросульфіт,
натрій карбонат, хлоридна кислота 1:1,
діетиловий етер. Стакан, колба круглодонна,
мішалка, холодильник зворотний Лібіха,
воронка ділильна, трубка хлоркальцієва,
колба Вюрца, колба Бензена, воронка
Бюхнера, термометр, алонж, пробірка,
мірний циліндр, мішалка, водяна баня.
ПРАВИЛА ОХОРОНИ ПРАЦІ:
Дотримуватися обережності при поводженні з хімічними реактивами, скляним посудом, електричним нагрівальним приладом. Синтез проводити у витяжній шафі.
В 1953 році італійський вчений Канніццаро встановив, що ароматичні альдегіди під дією концентрованого розчину лугу здатні окиснюватися і відновлюватися, тобто підлягають диспропорціонуванню.
Такі реакції протікають по хресту і продукти їх стають кислоти і спирти.
Основна реакція:


ЗМІСТ І ПОСЛІДОВНІСТЬ ВИКОНАННЯ ЗАВДАНЬ:
ЗБІР ПРИЛАДІВ
1 Колбу Вюрца об‛ємом 50 мл,яка розташована на водяній бані, з‛єднують з термометром та водяним холодильником з алонжем, який занурюють у приймач.
2 Прилад для відсмоктування.
ВИКОНАННЯ СИНТЕЗУ
1 В плоскодонну колбу об‛ємом 100 мл поміщують3,8мл(4г)бензальдегіду і при охолодженні вносять холодний розчин 3,6 г гідроксида калію в 2,4 мл води.
2 Закривають пробою колбу і енергійно струшують до тихпір, поки не утвориться стійка емульсія.
3 Після цього суміш залишають на 10 - 12 годин.
4 Потім до суміші бензилового спирту і кристалічної маси бензоатукаліюдобавляють невелику кількість води, яка необхідна для розчинення кристалів, і переміщують розчин у ділильну воронку.5 Із цього розчину добувають бензиловий спирт діетиловим етером, роблячі 2-3 етерні витяжки,по 3 мл кожна. Етерні витяжки з"єднують та струшують, добавляючи двічі по 1 мл 40% розчину гідросульфіту натрію.
6 Потім промивають етерний шар розчином карбонатунатріюдля визволення від сульфітної кислоти, яка може бути в NaНSO3.
7 Перелившиорганічний шар із ділильної воронки в колбу, сушать його безводним сульфатом натрію, або карбонатом калію.
8 Висушений етерний розчин переливають в колбу Вюрцата відгоняють етер, а потім бензиловий спирт, збираючи фракцію, яка кипить при 204 - 206°С.
9 Воднолужний розчин із ділильної воронки після екстрагування етером, підкислюють хлоридноюкислотою (1:1) (по Конго червоному), випавшу бензойну кислоту відсмоктуютьна воронці Бюхнера і сушать.
10 Для одержання більш чистої бензойної кислоти необхідно перекристалізувати її із киплячої води.
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ЩОДО ВИКОНАННЯ Й ОФОРМЛЕННЯ:
При виконанні дослідів строго дотримуватися кількості реагентів та методики виконання роботи, які вказані в інструкції, а також заходів техніки безпеки.
По закінченню роботи зробити загальний висновок.
Розрахувати практичний вихід (%) кислоти та спирту.
ПІСЛЯ ВИКОНАННЯ ЛАБОРАТОРНОЇ РОБОТИ СТУДЕНТ ПОВИНЕН:
ЗНАТИ:
1 Рівняння хімічних реакцій, що відбуваються при синтезі
2 Умови проведення процесу
3 Обладнання, що використовується для синтезу
4 Фізико – хімічні властивості та використання речовин
УМІТИ:
1 Провести необхідні синтези
2 Зібрати установку для синтезу
3 Працювати самостійно згідно інструкції
4 Невідступно дотримуватись заходів техніки безпеки
5 Провести розрахунок практичного та теоретичного виходів продукту
6 Знайти необхідні довідникові дані у довіднику
ЗАХИСТ РОБОТИ:
Дати визначення реакціїКанниццаро
Пояснити умови реакціїКанниццаро.
Навести рівняння основних і побічних реакцій, які відбуваються при одержанні бензойної кислоти і бензилового спирту.
Пояснити схеми приладів для синтезів бензойної кислоти та бензилового спирту.
Пояснити розрахунок виходу бензойної кислоти і бензилового спирту.
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ:
Пояснити фізико-хімічні властивості бензойної кислоти і бензилового спирту.
Пояснити області використання бензойної кислоти і бензилового спирту.
Яких заходів техніки безпеки необхідно дотримуватись при синтезах бензойної кислоти і бензилового спирту.
ЛІТЕРАТУРА
1. Храмкина М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. С 257 - 258, 260 – 262.
2. Храмкина М.Н. Практикум по органическому синтезу.- М.: Химия, 1974.
3. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
4. Потапов В.М., Татаринчик С.Н. Органическая химия. М.: Химия,1980.
5. Аверина А.В. Лабораторный практикум по органической химии.- М.: Высш.шк., 1980.
6. Березан О.М.Органічна хімія.- К.: Абрис, 2000.
7. Липатников В.Е. Лабораторные работы по неорганической и органической химии.- М.: Высш.шк., 1981.
ІНСТРУКЦІЙНА КАРТКА ДЛЯ ПРОВЕДЕННЯ ЛАБОРАТОРНОГО ЗАНЯТТЯ
З НАВЧАЛЬНОЇ ПРАКТИКИ «ОРГАНІЧНИЙ СИНТЕЗ»
ТЕМА: Одержання фенолоформальдегідної смоли
РОБОЧЕ МІСЦЕ: ХІМІЧНІ ЛАБОРАТОРІЇ ХТК ТРИВАЛІСТЬ ЗАНЯТТЯ: 1 ГОДИНА
МЕТА ПРОВЕДЕННЯ ЗАНЯТТЯ:
ЗАКРІПЛЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ З ТЕМИ,
ПІДТВЕРДЖЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ ПРИ ВИКОНАННІ ЛАБОРАТОРНИХ ДОСЛІДІВ;
ОВОЛОДІННЯ МЕТОДОМ СИНТЕЗУ.
МАТЕРІАЛЬНО-ТЕХНІЧНЕ ОСНАЩЕННЯ РОБОЧОГО МІСЦЯ:
Фенол,
40% формалін, концентрована хлоридна
кислота.
Стакан, термометр, пробірка, мірний циліндр, мішалка, водяна баня, технічні ваги.
ПРАВИЛА ОХОРОНИ ПРАЦІ:
Дотримуватися обережності при поводженні з хімічними реактивами, скляним посудом, електричним нагрівальним приладом. Синтез проводити у витяжній шафі. Фенол викликає опіки шкіри.
Реакцією полімеризації називають процес утворення високомолекулярних сполук (полімерів) в процесі з‘єднання низькомолекулярних мономерів.
t, P, K
nM ----------------►M n
де: n- число низькомолекулярних сполук (мономерів);
М - низькомолекулярна сполука (мономер);
Мп - високомолекулярна сполука (полімер).
Реакцією поліконденсації називається процес утворення високомолекулярних сполук - полімерів в процесі з'єднання низькомолекулярних сполук (мономерів) з одночасним виділенням низькомолекулярного продукту.
t, P, K
nM ----------------►M n + X
де: n- число мономерів;
М - низькомолекулярна сполука (мономер);
Мп - високомолекулярна сполука (полімер);
X - низькомолекулярний продукт.
В наслідок цих реакцій в промисловості одержують смоли, волокна, каучуки тощо.
Основна реакція:
 OH
OH
OH
OH
OH
OH





 –
CH2
–
–
–
CH2
–
–
2n + nCH2O ------► + n H2O
n
ЗМІСТ І ПОСЛІДОВНІСТЬ ВИКОНАННЯ ЗАВДАНЬ:
1. В пробірку поміщають 2 г кристалічного фенолу, додають 3мл формаліну і 3 краплі концентрованої соляної кислоти.
2. Суміш злегка охолоджують, а потім нагрівають в склянці киплячої води 20-40 хвилин (обережно, йде вспучування).
3. Смолу охолоджують, виймають та зважують.
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ЩОДО ВИКОНАННЯ Й ОФОРМЛЕННЯ:
При виконанні дослідів строго дотримуватися кількості реагентів та методики виконання роботи, які вказані в інструкції, а також заходів техніки безпеки.
По закінченню роботи зробити загальний висновок.
ПІСЛЯ ВИКОНАННЯ ЛАБОРАТОРНОЇ РОБОТИ СТУДЕНТ ПОВИНЕН:
ЗНАТИ:
1 Рівняння хімічних реакцій, що відбуваються при синтезі
2 Умови проведення процесу
3 Обладнання, що використовується для синтезу
4 Фізико – хімічні властивості та використання речовин
УМІТИ:
1 Провести необхідні синтези
2 Зібрати установку для синтезу
3 Працювати самостійно згідно інструкції
4 Невідступно дотримуватись заходів техніки безпеки
5 Знайти необхідні довідникові дані у довіднику
ЗАХИСТ РОБОТИ:
Дати визначення реакціям полімеризації та поліконденсації.
Пояснити на прикладі фенолоформальдегідної смоли залежність властивостей смоли від умов синтезу.
Навести приклади основних реакцій, які відбуваються при одержанні фенолоформальдегідної смоли.
Пояснити області використання смол.
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ:
Пояснити суть різних видів полімеризації – ланцюгової та ступінчастої.
Пояснити суть різних видів полімеризації в залежності від її механізму – радикальної та іонної.
Пояснити суть різних методів проведення полімеризації – в блоці, в розчині, в емульсії.
Пояснити залежність властивостей полімеру від кількості функціональних груп в вихідному мономері при проведенні поліконденсації.
Яких заходів техніки безпеки необхідно дотримуватись при синтезі фенолоформальдегідної смоли.
ЛІТЕРАТУРА
1. Храмкина М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. С 267 – 273, 281 – 284.
2. Храмкина М.Н. Практикум по органическому синтезу.- М.: Химия, 1974.
3. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
4. Потапов В.М., Татаринчик С.Н. Органическая химия. М.: Химия,1980.
5. Аверина А.В. Лабораторный практикум по органической химии.- М.: Высш.шк., 1980.
6. Березан О.М.Органічна хімія.- К.: Абрис, 2000.
7. Липатников В.Е. Лабораторные работы по неорганической и органической химии.-М.:В.шк.,1981.
ІНСТРУКЦІЙНА КАРТКА ДЛЯ ПРОВЕДЕННЯ ЛАБОРАТОРНОГО ЗАНЯТТЯ
З НАВЧАЛЬНОЇ ПРАКТИКИ «ОРГАНІЧНИЙ СИНТЕЗ»
ТЕМА: Одержання гліфталевої смоли
РОБОЧЕ МІСЦЕ: ХІМІЧНІ ЛАБОРАТОРІЇ ХТК ТРИВАЛІСТЬ ЗАНЯТТЯ: 1 ГОДИНА
МЕТА ПРОВЕДЕННЯ ЗАНЯТТЯ:
ЗАКРІПЛЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ З ТЕМИ,
ПІДТВЕРДЖЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ ПРИ ВИКОНАННІ ЛАБОРАТОРНИХ ДОСЛІДІВ;
ОВОЛОДІННЯ МЕТОДОМ СИНТЕЗУ.
МАТЕРІАЛЬНО-ТЕХНІЧНЕ ОСНАЩЕННЯ РОБОЧОГО МІСЦЯ:
Гліцерин,
фталевий ангідрид. Стакан, піщана баня,
термометр, пробірка, мірний циліндр,
мішалка.
ПРАВИЛА ОХОРОНИ ПРАЦІ:
Дотримуватися обережності при поводженні з хімічними реактивами, скляним посудом, електричним нагрівальним приладом. Синтез проводити у витяжній шафі.
Реакцією полімеризаціїназивають процес утворення високомолекулярних сполук (полімерів) в процесі з‘єднання низькомолекулярних мономерів.
t, P, K
nM ----------------►M n
де: n- число низькомолекулярних сполук (мономерів);
М - низькомолекулярна сполука (мономер);
Мп - високомолекулярна сполука (полімер).
Реакцією поліконденсації називається процес утворення високомолекулярних сполук - полімерів в процесі з'єднання низькомолекулярних сполук (мономерів) з одночасним виділенням низькомолекулярного продукту.
t, P, K
nM ----------------►M n +X
де: n- число мономерів;
М - низькомолекулярна сполука (мономер);
Мп - високомолекулярна сполука (полімер);
X - високомолекулярний продукт.
В наслідок цих реакцій в промисловості одержують смоли, волокна, каучуки тощо.
Основна реакція:
O
║
 -C
— O
-C
— O
 t
t
n + n HO—CH2—CH(OH) —CH2—OH ----------►
-C ==O

O O
 ||
||
||
||
 … – O – C
- C – CH2
– CH
–CH2
–
… + n H2O
… – O – C
- C – CH2
– CH
–CH2
–
… + n H2O
 │
│
O
 |
|
C== O n

C==O
│
ЗМІСТ І ПОСЛІДОВНІСТЬ ВИКОНАННЯ ЗАВДАНЬ:
1 В пробірку поміщають 3,7 г тонкорозтертого фталевого ангідриду, додають 1,55 г гліцерину
2 Ретельно перемішують і обережно нагрівають до 150-180 °С, а потім підвищують до 230 °С і нагрівають при цій температурі 40 хвилин.
3 Смолу охолоджують, виймають та зважують.
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ЩОДО ВИКОНАННЯ Й ОФОРМЛЕННЯ:
При виконанні дослідів строго дотримуватися кількості реагентів та методики виконання роботи, які вказані в інструкції, а також заходів техніки безпеки.
По закінченню роботи зробити загальний висновок.
ПІСЛЯ ВИКОНАННЯ ЛАБОРАТОРНОЇ РОБОТИ СТУДЕНТ ПОВИНЕН:
ЗНАТИ:
1 Рівняння хімічних реакцій, що відбуваються при синтезі
2 Умови проведення процесу
3 Обладнання, що використовується для синтезу
4 Фізико – хімічні властивості та використання речовин
УМІТИ:
1 Провести необхідні синтези
2 Зібрати установку для синтезу
3 Працювати самостійно згідно інструкції
4 Невідступно дотримуватись заходів техніки безпеки
5 Знайти необхідні довідникові дані у довіднику
ЗАХИСТ РОБОТИ:
Дати визначення реакціям полімеризації та поліконденсації.
Навести приклади основних реакцій, які відбуваються при одержанні глифталевої смоли.
Пояснити області використання смол.
Яких заходів техніки безпеки необхідно дотримуватись при синтезах глифталевої смоли.
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ:
Пояснити суть різних видів полімеризації – ланцюгової та ступінчастої.
Пояснити суть різних видів полімеризації в залежності від її механізму – радикальної та іонної.
Пояснити суть різних методів проведення полімеризації – в блоці, в розчині, в емульсії.
Пояснити залежність властивостей полімеру від кількості функціональних груп в вихідному мономері при проведенні поліконденсації.
ЛІТЕРАТУРА
1. Храмкина М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. С 267 – 273, 280 – 281.
2. Храмкина М.Н. Практикум по органическому синтезу.- М.: Химия, 1974.
3. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
4. Потапов В.М., Татаринчик С.Н. Органическая химия. М.: Химия,1980.
5. Аверина А.В. Лабораторный практикум по органической химии.- М.: Высш.шк., 1980.
6. Березан О.М.Органічна хімія.- К.: Абрис, 2000.
7. Липатников В.Е. Лабораторные работы по неорганической и органической химии.- М.: Высш.шк., 1981.
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ХІМІКО-ТЕХНОЛОГІЧНИЙ КОЛЕДЖ ІМЕНІ ІВАНА КОЖЕДУБА
ШОСТКИНСЬКОГО ІНСТИТУТУ
СУМСЬКОГО ДЕРЖАВНОГО УНІВЕРСИТЕТУ
ЗАТВЕРДЖУЮ
Заступник директора
з навчальної роботи
_______О.О.Лапінська
«___»_______ 200 р.
ПРОГРАМА САМОСТІЙНОЇ РОБОТИ
ОРГАНІЧНИЙ СИНТЕЗ
СПЕЦІАЛЬНОСТІ: 5.091617, 5.091618
Розглянуто і схвалено на засіданні Складено викладачами
Циклової комісії загально-хімічних дисциплін ____ А.В.Вареник
Протокол №____від_______________200 р. ____ Г.І.Кокшайкиною
Голова циклової комісії
_____________ М.Д.Мозолевська
|
Тема, яка виноситься на самостійну роботу |
Кількість годин |
Опорні знання |
Знання і навички, якими неохідно оволодіти |
Вид навчального завдання до самостійної роботи |
Форми контролю |
Література |
|
Тема 1.2 Перегонка. Звичайна перегонка під атмосферним тиском. |
2 |
Методи очищення органічних речовин. Знати: види перегонки, застосування приладів, методи розділення суміши. |
Вміти: збитати прилади, проводити перегонку. |
Робота з відповідною літературою та особистим конспектом. |
Складання конспекта, усне повідомлення.
|
1. Храмкииа М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. 2. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
|
|
Тема 2.1 Хімізм добування бромметану. Фізичні і хімічні властивості, основні та побічні реакції. Визначення теоретичного і практичного виходу. Застосування. |
2 |
Реакції галогенування. Знати: хімізм галогенування, фізичні і хімічні властивості речовин, застосування. |
Вміти: проводити реакцію галогенування, розраховувати виход брометану, застосувати метод очищення.
|
Робота з відповідною літературою та особистим конспектом. |
Перевірка домашнього завдання |
1. Храмкииа М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. 2. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
|
|
Тема 2.2 Хімізм одержання етилацетату. Фізичні і хімічні властивості, основні та побічні реакції. Визначення теоретичного і практичного виходу. Застосування. |
2 |
Реакції ацілювання. Знати: хімізм галогенування, фізичні і хімічні властивості речовин, застосування. |
Вміти: проводити реакцію ацілювання, розраховувати виход етилацетату, застосувати метод очищення.
|
Робота з відповідною літературою та особистим конспектом. |
Перевірка домашнього завдання |
1. Храмкииа М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. 2. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
|
|
Тема 2.2 Хімізм одержання аспіріну і ацетаніліду. Фізичні і хімічні властивості, основні та побічні реакції. Визначення теоретичного і практичного виходу. Застосування. |
2 |
Реакції ацілювання. Знати: хімізм ацілювання, фізичні і хімічні властивості речовин, застосування аспіріну, ацетаніліду.
|
Вміти: проводити реакцію ацілювання, розраховувати виход аспіріну, ацетаніліду, застосувати метод очищення.
|
Робота з відповідною літературою та особистим конспектом. |
Перевірка домашнього завдання |
Храмкииа М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
|
|
Тема 2.3 Хімізм одержання бензойної кислоти. Фізичні і хімічні властивості, основні та побічні реакції. Визначення теоретичного і практичного виходу. Застосування. |
2 |
Реакції окиснення. Знати: хімізм окиснення, фізичні і хімічні властивості речовин, застосування бензойної кислоти.
|
Вміти: проводити реакцію окислення, розраховувати виход бензойної кислоти, застосувати метод очищення. |
Робота з відповідною літературою та особистим конспектом. |
Перевірка домашнього завдання |
Храмкииа М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
|
|
Тема 2.3 Хімізм одержання ацетальдегіду. Фізичні і хімічні властивості, основні та побічні реакції. Визначення теоретичного і практичного виходу. Застосування. |
2 |
Реакції окиснення. Знати: хімізм окиснення, фізичні і хімічні властивості речовин, застосування ацетальдегиду.
|
Вміти: проводити реакцію окислення, розраховувати виход ацетальдегиду, застосувати метод очищення. |
Робота з відповідною літературою та особистим конспектом. |
Перевірка домашнього завдання |
Храмкииа М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
|
|
Тема 2.4 Хімізм одержання нітробензолу. Фізичні і хімічні властивості, основні та побічні реакції. Визначення теоретичного і практичного виходу. Застосування. |
2 |
Реакції нітрування. Знати: хімізм нітрування, фізичні і хімічні властивості речовин, застосування нітробензолу.
|
Вміти: проводити реакцію нітрування, розраховувати виход нітробензолу, застосувати метод очищення. |
Робота з відповідною літературою та особистим конспектом. |
Перевірка домашнього завдання |
Храмкииа М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
|
|
Тема 2.4 Хімізм одержання п-нітроацетаніліду Фізичні і хімічні властивості, основні та побічні реакції. Визначення теоретичного і практичного виходу. Застосування. |
2 |
Реакції нітрування. Знати: хімізм нітрування, фізичні і хімічні властивості речовин, застосування п-нітроацетаніліду.
|
Вміти: проводити реакцію нітрування, розраховувати виход нітробензолу, застосувати метод очищення. |
Робота з відповідною літературою та особистим конспектом. |
Перевірка домашнього завдання |
Храмкииа М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
|
|
Тема 2.5 Хімізм одержання п-толулосульфокислоти. Фізичні і хімічні властивості, основні та побічні реакції. Визначення теоретичного і практичного виходу. Застосування.
|
2 |
Реакції сульфування. Знати: хімізм нітрування, фізичні і хімічні властивості речовин, застосування п-толулосульфокислоти
|
Вміти: проводити реакцію нітрування, розраховувати виход п-толуолсульфокислоти, застосувати метод очищення. |
Робота з відповідною літературою та особистим конспектом. |
Перевірка домашнього завдання |
Храмкииа М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
|
|
Тема 2.5 Хімізм одержання сульфанілової кислоти. Фізичні і хімічні властивості, основні та побічні реакції. Визначення теоретичного і практичного виходу. Застосування.
|
2 |
Реакції сульфування. Знати: хімізм сульфування, фізичні і хімічні властивості речовин, застосування сульфанілової кислоти.
|
Вміти: проводити реакцію нітрування, розраховувати виход сульфонілової кислоти, застосувати метод очищення. |
Робота з відповідною літературою та особистим конспектом. |
Перевірка домашнього завдання |
Храмкииа М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
|
|
Тема 2.6 Хімізм одержання діазоамінобензо-лу. Фізичні і хімічні властивості, основні та побічні реакції. Визначення теоретичного і практичного виходу. Застосування.
|
2 |
Реакції азосполучення. Знати: хімізм азосполучення, фізичні і хімічні властивості речовин, застосування діазоамінобензолу.
|
Вміти: проводити реакцію азосполучення, розраховувати виход діазоамінобензолу, застосувати метод очищення. |
Робота з відповідною літературою та особистим конспектом. |
Перевірка домашнього завдання |
Аверина А.В. Лабораторный практикум по органической химии.- М.: Высш. шк., 1980. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974. |
|
Тема 2.6 Хімізм одержання п-амінобензолу і фенолфталеїну. Фізичні і хімічні властивості, основні та побічні реакції. Визначення теоретичного і практичного виходу. Застосування.
|
2 |
Реакції диазотування і азосполучення. Знати: хімізм азосполучення, фізичні і хімічні властивості речовин, застосування п-амінобензолу і фенолфталеїну.
|
Вміти: проводити реакцію діазотування і азосполучення, розраховувати виход п-амінобензолу і фенолфталеїну, застосувати метод очищення. |
Робота з відповідною літературою та особистим конспектом. |
Перевірка домашнього завдання |
Аверина А.В. Лабораторный практикум по органической химии.- М.: Высш. шк., 1980. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974. |
|
Тема 2.7 Хімізм одержання ацетофенону за реакцією Фріделя-Крафтса. Фізичні і хімічні властивості, основні та побічні реакції. Визначення теоретичного і практичного виходу. Застосування. |
2 |
Реакції ацілювання. Знати: хімізм ацілювання, фізичні і хімічні властивості речовин, застосування ацетофенону.
|
Вміти: проводити реакцію ацілювання, розраховувати виход ацетофенону, застосувати метод очищення. |
Робота з відповідною літературою та особистим конспектом. |
Перевірка домашнього завдання |
Храмкииа М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974. |
|
Тема 2.7 Хімізм одержання нероліну. Фізичні і хімічні властивості, основні та побічні реакції. Визначення теоретичного і практичного виходу. Застосування.
|
2 |
Реакції алкілювання. Знати: хімізм алкілювавання, фізичні і хімічні властивості речовин, застосування нероліну.
|
Вміти: проводити реакцію алкілювання, розраховувати виход нероліну, застосувати метод очищення. |
Робота з відповідною літературою та особистим конспектом. |
Перевірка домашнього завдання |
Храмкииа М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974. |
|
Тема 2.8 Хімізм одержання ацетового ефіру за реакцією Клайзена. Фізичні і хімічні властивості, основні та побічні реакції. Визначення теоретичного і практичного виходу. Застосування.
|
2 |
Реакції конденсації карбонільних сполук в присутності основи. Знати: хімізм алкілювавання, фізичні і хімічні властивості речовин, застосування ацетового ефіру.
|
Вміти: проводити реакцію поліконденсації, розраховувати виход ацетовогоефіру, застосувати метод очищення. |
Робота з відповідною літературою та особистим конспектом. |
Перевірка домашнього завдання |
Храмкииа М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974. |
|
Тема 2.8 Хімізм одержання бензойної кислоти і бензилового спирту за реакцією Каніццаро. Фізичні і хімічні властивості, основні та побічні реакції. Визначення теоретичного і практичного виходу. Застосування. |
2 |
Реакції конденсації карбонільних сполук в присутності основи. Знати: хімізм алкілювавання, фізичні і хімічні властивості речовин, застосування бензойної кислоти і бензилового спирту.
|
Вміти: проводити реакцію поліконденсації, розраховувати виход бензойної кислоти і бензилового спирту, застосувати метод очищення. |
Робота з відповідною літературою та особистим конспектом. |
Перевірка домашнього завдання |
Храмкииа М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
|
|
Тема 2.9 Хімізм одержання гліфталевої смоли. Фізичні і хімічні властивості, основні та побічні реакції. Визначення теоретичного і практичного виходу. Застосування.
|
2 |
Реакції поліконденсації і полімерізації. Знати: хімізм алкілювавання, фізичні і хімічні властивості речовин, застосування гліфталевой смоли.
|
Вміти: проводити реакцію поліконденсації і полімерізаціїРозраховувати виход гліфталевой смоли, застосувати метод очищення. |
Робота з відповідною літературою та особистим конспектом. |
Перевірка домашнього завдання |
Храмкииа М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974. |
|
Тема 2.9 Хімізм одержання фенолформальдегідної смоли. Фізичні і хімічні властивості, основні та побічні реакції. Визначення теоретичного і практичного виходу. Застосування.
|
2 |
Реакції поліконденсації і полімерізації. Знати: хімізм алкілювавання, фізичні і хімічні властивості речовин, застосування фенолформальдегідної смоли.
|
Вміти: проводити реакцію поліконденсації і полімерізаціїРозраховувати виход фенолформальдегідної смоли, застосувати метод очищення. |
Робота з відповідною літературою та особистим конспектом. |
Перевірка домашнього завдання |
Храмкииа М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974. |
ЗРАЗОК
оформлення до лабораторної роботи таблиці властивостей вихідних речовин тапродуктів реакцій
та розрахункутеоретичного і практичного виходу продукту
Таблиця - Властивості вихідних речовин і продуктів реакцій
|
Речовина |
Молярнамаса |
Температура плавлення t,°С |
Температура кипіння t,°С |
Густина ρ, кг/м3 |
Показник заломлення n 20D |
Розчинність, s |
Примітка |
|
етанол 95%-й |
46,07 |
- 114,5 |
78,4 |
804,2 |
1,3614 |
Змішується з водою, діетиловим етером та іншими органічними розчинниками |
Пари утворюють з повітрям вибухонебезпечні суміші
|
РОЗРАХУНОК ВИХОДУ ГОЛОВНОЇ РЕЧОВИНИ
1. Приклад розрахунку по рівнянню реакції:
H2SO4
12,8 г HNO3 х
C10 H8 -----------►C10 H7 NO2
128 г H2O 173 г
1.1 .Розраховується теоретичний вихід нітронафтaліну, г.
Вихідна кількість нафталіну 12,8 г
12,8 х 12,8 . 173
—— = — х = -------------- = 17,3 г,
128 173 128
де 12,8 г - маса речовини за умовою синтезу, г.
128 і 173 - молекулярні маси речовин відповідно формулам, г.
1.2. Розраховується практичний вихід нітронафтaліну, %, якщо одержано 10,2 г нітронафталіну.
17,3 г - 100%
10,2 - х10,2 .100
х = -------------- = 57%
17,3
Теоретичний вихід приймається за 100%.
2. Приклад розрахунку по рівнянню реакції:
8г х
С2Н5ОН + НВr ----> С2Н5 Вr + Н2О
46 109
2.1. Розраховується маса етанолу m, г, за формулою: m = V . ρ,
де V - об'єм рідини, см3;
ρ - густина рідини, г/см3.
Вихідний об'єм етанолу 10 мл. m = 10 . 0,804 = 8г
2.2. Розраховується теоретичний вихід брометану, г:
8 х 8 . 109
— = ------ х=------------ = 19 г,
46 109 46
де 8 - маса речовини за умовою синтезу, г;
46 і 109 - молекулярні маси відповідно формулам, г.
2.3. Розраховується теоретичний вихід брометану, мл; за формулою:
m 19
V= ----;V(C2H5 Br) = --------- = 13мл
ρ 1,458
2.4. Розраховується практичний вихід брометану, % , якщо його одержано 8,3 мл.
13 мл – 100 % 8,3 . 100
8,3 мл -- х х = --------------- = 63,85 %
13
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: 1.1 «Організація роботи і техніка безпеки»; 2.1 «Реакції галогенування»;
2.2 «Реакції ацілювання»; «Реакції окиснення» (різнорівнева письмова робота)
ВАРІАНТ І
І рівень (оцінка 3)
1 Пояснити чому необхідно знати властивості речовин, які необхідно синтезувати.
2 Пояснити в якому посуді зберігаються летючі, вибухонебезпечні речовини.
3 Назвати методи очищення органічних речовин.
4 Привести приклади використання галогенпохідних вуглеводнів.
5 Яких заходів техніки безпеки необхідно додержуватись при синтезі брометану.
6 Пояснити які ацілюючі агенти використовуються.
7 Пояснити чому саме сульфатна кислота використовуються при синтезі етилацетату.
8 Дати визначення реакції окиснення.
9 Пояснити фізико-хімічні властивості бензойної кислоти.
ІІ рівень (оцінка 4)
10 Для чого приймач поміщують у посудіз охолоджуючою сумішшю?
11 Навести схему приладу для отримання брометану.
12 Пояснити фізико-хімічні властивості бромистого етилу.
13 Навести основні і побічні реакції синтезу етилхлорацетату
14 Від чого залежить дія окисника на органічну речовину.
15 Вибрати умови для окиснення первинних спиртів до альдегідів.
ІІІ рівень (оцінка 5)
16 Пояснити основні етапи синтезу брометану.
17 Пояснити схемуприладудля синтезуетилацетату
18 Пояснити схемуприладудля синтезубензойної кислоти.
19 Визначити практичний вихід (%) бензойної кислоти при реакції окиснення 20мл толуолу, якщо утворилося 1,5г кислоти.
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: 1.1 «Організація роботи і техніка безпеки»; 2.1 «Реакції галогенування»;
2.2 «Реакції ацілювання»; «Реакції окиснення» (різнорівнева письмова робота)
ВАРІАНТ ІI
І рівень (оцінка 3)
1Чому необхідно проводити синтез у чистому посуді?
2Пояснити як необхідно вставити скляну трубку в гумову пробку та холодильник.
3Пояснити призначення процесів кристалізації і перекристалізації
4Яких заходів техніки безпеки необхідно додержуватись при синтезі брометану.
5Дати визначення реакції ацілювання.
6Пояснити які ацілюючі агенти використовуються.
7Пояснити області застосування етилацетату
8Які окисники використовуються для проведення окиснення?
9 Пояснити фізико-хімічні властивості ацетальдегіду.
ІІ рівень (оцінка 4)
10 Яку частину об'єму колби повинна займати рідина?
11 Навести основні і побічні реакції, які відбуваються при бромуванні етанолу.
12Навести схему приладу для отриманняетилацетату.
13 Пояснити фізико-хімічні властивості етилбензоату.
14 Навести рівняння основних і побічних реакцій, які відбуваються при одержанні ацетальдегіду.
15Пояснити розрахунок виходу продуктів окиснення.
ІІІ рівень (оцінка 5)
16 Пояснити розрахунок виходу продуктів етилацетату.
17 Яких заходів техніки безпеки необхідно додержуватись при синтезуетилацетату?
18 Пояснити схемуприладудля синтезубромистого етилу.
19 Визначити практичний вихід (%) бензойної кислоти при реакції окиснення 15мл толуолу, якщо утворилося 0,5г кислоти.
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: 1.1 «Організація роботи і техніка безпеки»; 2.1 «Реакції галогенування»;
2.2 «Реакції ацілювання»; «Реакції окиснення» (різнорівнева письмова робота)
ВАРІАНТ ІII
І рівень (оцінка 3)
1Чому роботу токсичними, легкозаймистими речовинами необхідно проводити у витяжній шафі?
2Пояснити чи можна нагрівати товстостінний посуд.
3Пояснити вимоги до розчинників.
4 Дати визначення реакції ацілювання.
5 Пояснити області застосування етилацетату, етилхлорацетату
6Визначити реакції галогенування.
7Яких заходів техніки безпеки необхідно додержуватись при синтезі брометану.
8Які окисники використовуються для проведення окиснення?
9 Пояснити фізико-хімічні властивості бензойної кислоти.
ІІ рівень (оцінка 4)
10 Який посуд використовується при перегонці?
11 Навести схему приладу для отриманняетилбензоату.
12Пояснити фізико-хімічні властивості бромистого етилу.
13Пояснити вибір умов для проведення окиснення альдегідів до кислот.
14 Навести рівняння основних і побічних реакцій, які відбуваються при одержанні бензойної кислоти.
15Пояснити розрахунок виходу продуктів окиснення.
ІІІ рівень (оцінка 5)
16Яких заходів техніки безпеки необхідно додержуватись при синтезах бензойної кислоти та ацетальдегіду?
17 Пояснити схемуприладудля синтезуетилбензоату.
18 Пояснити схемуприладудля синтезу ацетальдегіду.
19 Визначити практичний вихід (%) бензойної кислоти при реакції окиснення 10мл толуолу, якщо утворилося 0,5г кислоти.
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: 1.1 «Організація роботи і техніка безпеки»; 2.1 «Реакції галогенування»;
2.2 «Реакції ацілювання»; «Реакції окиснення» (різнорівнева письмова робота)
ВАРІАНТ ІV
І рівень (оцінка 3)
1 Чому неможна плутати пробки від склянок, які вміщують різні речовини?
2 Пояснити правила допомоги при термічному опіку (незначному).
3 Назвати основні етапи проведення процесу перекристалізації.
4 Визначити реакції галогенування.
5 Яких заходів техніки безпеки необхідно додержуватись при синтезі брометану.
6 Пояснити які ацілюючі агенти використовуються.
7 Пояснити чому саме сульфатна кислота використовуються при синтезі етилацетату.
8 Дати визначення реакції окиснення.
9 Пояснити області застосування ацетальдегіду.
ІІ рівень (оцінка 4)
10 Якими засобами запобігають або послаблюють поштовхи при кипінні?
11 Навести основні і побічні реакції, які відбуваються при бромуванні етанолу.
12 Навести схему приладу для отриманняетилхлорацетату.
13 Пояснити фізико-хімічні властивості етилацетату.
14 Від чого залежить дія окисника на органічну речовину.
15 Пояснити розрахунок виходу продуктів окиснення.
ІІІ рівень (оцінка 5)
16 Пояснити основні етапи синтезу брометану.
17 Пояснити розрахунок виходу етилацетату.
18 Пояснити схемуприладудля синтезу ацетальдегіду.
19 Визначити практичний вихід (%) бензойної кислоти при реакції окиснення 30мл толуолу, якщо утворилося 1,5г кислоти.
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: 1.1 «Організація роботи і техніка безпеки»; 2.1 «Реакції галогенування»;
2.2 «Реакції ацілювання»; «Реакції окиснення» (різнорівнева письмова робота)
ВАРІАНТ V
І рівень (оцінка 3)
1Як необхідно нюхати речовини?
2Пояснити що необхідно робити при опіках фенолом.
3Назвати види перегонки.
4Визначити реакції галогенування.
5 Яких заходів техніки безпеки необхідно додержуватись при синтезі брометану.
6Пояснити які ацілюючі агенти використовуються.
7Пояснити області застосуванняетилбензоату.
8Які окисники використовуються для проведення окиснення?
9 Пояснити фізико-хімічні властивості бензойної кислоти.
ІІ рівень (оцінка 4)
10 Представити хімізм процесу перекристалізації фталевої кислоти.
11 Навести схему приладу для отриманняетилбензоату.
12 Пояснити фізико-хімічні властивості бромистого етилу.
13 Навести основні і побічні реакції синтезів етилацетату.
14Пояснити вибір умов для проведення окиснення альдегідів до кислот.
15Пояснити розрахунок виходу продуктів окиснення.
ІІІ рівень (оцінка 5)
16 Пояснити розрахунок виходу етилацетату.
17 Пояснити схемуприладудля синтезуброметану.
18 Яких заходів техніки безпеки необхідно додержуватись при синтезах бензойної кислоти та ацетальдегіду?
19 Визначити практичний вихід (%) бензойної кислоти при реакції окиснення 20мл толуолу, якщо утворилося 1,5г кислоти.
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: 1.1 «Організація роботи і техніка безпеки»; 2.1 «Реакції галогенування»;
2.2 «Реакції ацілювання»; «Реакції окиснення» (різнорівнева письмова робота)
ВАРІАНТ VІ
І рівень (оцінка 3)
1Які в лабораторії знаходяться засоби захисту?
2Пояснити першу допомогу при опіках кислотою або лугом.
3Визначити метод возгонки (сублімації).
4Привести приклади використання галогенпохідних вуглеводнів.
5Яких заходів техніки безпеки необхідно додержуватись при синтезі брометану.
6Пояснити які ацілюючі агенти використовуються.
7Пояснити області застосуванняетилхлорацетату.
8 Дати визначення реакції окиснення.
9 Пояснити фізико-хімічні властивості ацетальдегіду.
ІІ рівень (оцінка 4)
10 Пояснити вибір умов охолодження гарячого розчину.
11 Навести основні і побічні реакції, які відбуваються при бромуванні етанолу.
12Пояснити фізико-хімічні властивості бромистого етилу.
13 Навести основні і побічні реакції синтезу етилбензоату.
14Вибрати умови для окиснення первинних спиртів до альдегідів.
15Пояснити розрахунок виходу продуктів окиснення.
ІІІ рівень (оцінка 5)
16 Пояснити основні етапи синтезу етилбензоату.
17Пояснити основні етапи синтезу брометану.
18Пояснити схемуприладудля синтезу ацетальдегіду.
19 Визначити практичний вихід (%) бензойної кислоти при реакції окиснення 10мл толуолу, якщо утворилося 1г кислоти.
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: 1.1 «Організація роботи і техніка безпеки»; 2.1 «Реакції галогенування»;
2.2 «Реакції ацілювання»; «Реакції окиснення» (різнорівнева письмова робота)
ВАРІАНТ VIІ
І рівень (оцінка 3)
1 Як проводиться розбавлення концентрованої сульфатної кислоти, який при цьому використовується хімічний посуд?
2 Пояснити першу допомогу при попаданні кислоти в очі.
3Визначити умови проведення сублімації.
4 Визначити реакції галогенування.
5 Яких заходів техніки безпеки необхідно додержуватись при синтезі етилацетату?
6Пояснити які ацілюючі агенти використовуються.
7 Пояснити області застосуванняетилхлорацетату.
8 Дати визначення реакції окиснення.
9 Пояснити фізико-хімічні властивості бензойної кислоти.
ІІ рівень (оцінка 4)
10 Як визначається чистота одержаної при перекристалізації речовини?
11 Навести основні і побічні реакції, які відбуваються при синтезі етилбензоату.
12 Навести схему приладу для отримання брометану.
13 Пояснити фізико-хімічні властивостіетилацетату.
14 Пояснити вибір умов для проведення окиснення альдегідів до кислот.
15 Навести рівняння основних і побічних реакцій, які відбуваються при одержанні бензойної кислоти.
ІІІ рівень (оцінка 5)
16Яких заходів техніки безпеки необхідно додержуватись при синтезі етилбензоату?
17Пояснити основні етапи синтезу етилацетату.
18Пояснити схемуприладудля синтезу брометану.
19 Визначити практичний вихід (%) бензойної кислоти при реакції окиснення 20мл толуолу, якщо утворилося 1,5г кислоти.
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: 1.1 «Організація роботи і техніка безпеки»; 2.1 «Реакції галогенування»;
2.2 «Реакції ацілювання»; «Реакції окиснення» (різнорівнева письмова робота)
ВАРІАНТ VІII
І рівень (оцінка 3)
1 Чи можна виливати гарячу рідину у товстостінний посуд?
2 Що робити при ураженні електричним струмом?
3 Дати визначення процесу перегонки.
4 Визначити реакції галогенування.
5 Яких заходів техніки безпеки необхідно додержуватись при синтезі брометану.
6 Пояснити які ацілюючі агенти використовуються.
7 Пояснити області застосування етилацетату.
8 Дати визначення реакції окиснення.
9 Пояснити фізико-хімічні властивості бензойної кислоти.
ІІ рівень (оцінка 4)
10 Пояснити коли проводиться возгонка при атмосферному тиску, а коли у вакуумі.
11 Навести основні і побічні реакції, які відбуваються при бромуванні етанолу.
12 Як залежить швидкість етерифікації від властивостей карбонової кислоти та спирту?
13 Пояснити фізико-хімічні властивості етилбензоату.
14 Навести рівняння основних і побічних реакцій, які відбуваються при одержанні бензойної кислоти
15 Пояснити розрахунок виходу продуктів окиснення.
ІІІ рівень (оцінка 5)
16Пояснити розрахунок виходуетилхлорацетату.
17Навести схему приладу для отримання брометану.
18Пояснити схему приладу для синтезу бензойної кислоти.
19Яких заходів техніки безпеки необхідно додержуватись при синтезах бензойної кислоти та ацетальдегіду?
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: 1.1 «Організація роботи і техніка безпеки»; 2.1 «Реакції галогенування»;
2.2 «Реакції ацілювання»; «Реакції окиснення» (різнорівнева письмова робота)
ВАРІАНТ ІX
І рівень (оцінка 3)
1 Пояснити правила роботи з металічним натрієм.
2 Пояснити першу допомогу при отруєнні отруйними речовинами.
3 Назвати види перегонки.
4Визначити реакції галогенування.
5Яких заходів техніки безпеки необхідно додержуватись при синтезі брометану?
6Пояснити які ацілюючі агенти використовуються.
7Пояснити області застосування етилацетату.
8Які окисники використовуються для проведення окиснення?
9 Пояснити фізико-хімічні властивості ацетальдегіду.
ІІ рівень (оцінка 4)
10 Пояснити використання процесу перегонки.
11 Навести схему приладу для отримання брометану.
12Пояснити фізико-хімічні властивості бромистого етилу.
13 Навести основні і побічні реакції синтезу етилацетату.
14 Від чого залежить дія окисника на органічну речовину.
15 Вибрати умови для окиснення первинних спиртів до альдегідів.
ІІІ рівень (оцінка 5)
16Пояснитиосновні етаписинтезуетилбензоату.
17Пояснити схему приладу для синтезу бензойної кислоти.
18Яких заходів техніки безпеки необхідно додержуватись при синтезах бензойної кислоти та ацетальдегіду?
19 Визначити практичний вихід (%) бензойної кислоти при реакції окиснення 15мл толуолу, якщо утворилося 1г кислоти.
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: 1.1 «Організація роботи і техніка безпеки»; 2.1 «Реакції галогенування»;
2.2 «Реакції ацілювання»; «Реакції окиснення» (різнорівнева письмова робота)
ВАРІАНТ X
І рівень (оцінка 3)
1Пояснити чому неможна проводити перегонку "досуха", тобто до повного використання вихідних речовин.
2Пояснити як можна загасити місцеве загоряння розчинних та нерозчинних у воді речовин.
3Дати визначення процесу перегонки.
4Привести приклади використання галогенпохідних вуглеводнів.
5Яких заходів техніки безпеки необхідно додержуватись при синтезіетилбензоату?
6Пояснити які ацілюючі агенти використовуються.
7 Пояснити області застосування етилацетату.
8 Дати визначення реакції окиснення.
9 Пояснити фізико-хімічні властивості бензойної кислоти.
ІІ рівень (оцінка 4)
10 Коли використовується проста перегонка при атмосферному тиску?
11 Навести основні і побічні реакції, які відбуваються при бромуванні етанолу.
12 Навести схему приладу для отримання брометану.
13 Навести основні і побічні реакції синтезу етилацетату.
14 Пояснити вибір умов для проведення окиснення альдегідів до кислот.
15 Навести рівняння основних і побічних реакцій, які відбуваються при одержанні ацетальдегіду.
ІІІ рівень (оцінка 5)
16Пояснити основні етапи синтезу брометану.
17Пояснити схемуприладудля синтезу етилхлорацетату.
18Яких заходів техніки безпеки необхідно додержуватись при синтезы бензойної кислоти?
19 Визначити практичний вихід (%) бензойної кислоти при реакції окиснення 20мл толуолу, якщо утворилося 1,5г кислоти.
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: «Реакції нітрування»; «Реакції сульфурування»; «Реакції діазотування та азосполучення» (різнорівнева письмова робота)
ВАРІАНТ І
І рівень (оцінка 3)
1 Які нітруючі агенти використовуються для проведення реакції нітрування.
2 Пояснити фізико-хімічні властивості та використання нітробензолу.
3 Навести рівняння основних і побічних реакцій, які відбуваються при одержанні нітробензолу.
4 Дати визначення реакції сульфурування.
5 Пояснити області використання сульфанілової кислоти.
6 Яких заходів техніки безпеки необхідно додержуватись при синтезіп-толуолсульфокислоти.
7 Чому не використовується вільна нітратна кислота для проведення діазотування.
8 Дати визначення реакції азосполучення.
9 Чим обумовлене забарвлення азосполук.
10 Які речовини називаються діазокомпонентами і азокомпонентами.
ІІ рівень (оцінка 4)
11 Пояснити склад нітруючої суміші та призначення її компонентів.
12 Навести рівняння основних і побічних реакцій, які відбуваються при одержанні α – нітронафталіну.
13 Пояснити розрахунок виходу сульфанілової кислоти.
14 Чому використовуються розчини солей діазонія, а не сухі солі.
15 Навести рівняння основних і побічних реакцій синтезу діазоамінобензолу.
ІІІ рівень (оцінка 5)
16 Пояснити схему приладу для синтезу нітробензолу.
17 Яких заходів техніки безпеки необхідно додержуватись при синтезі α – нітронафталіну.
18 Визначити практичний вихід (%) нітробензену при реакції нітрування 20мл бензену, якщо утворилося 8мл нітробензену.
19 Пояснити фізико-хімічні властивості та використання п-толуолсульфокислоти.
20 Пояснити схему приладу для синтезу діазоамінобензолу.
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: «Реакції нітрування»; «Реакції сульфурування»; «Реакції діазотування та азосполучення» (різнорівнева письмова робота)
ВАРІАНТ ІI
І рівень (оцінка 3)
1 Які нітруючі агенти використовуються для проведення реакції нітрування.
2 Пояснити фізико-хімічні властивості та використання α – нітронафталіну.
3 Дати визначення реакції сульфурування.
4 Пояснити області використання п-толуолсульфокислоти.
5 Яких заходів техніки безпеки необхідно додержуватись при синтезах п-толуолсульфокислоти.
6 Чому не використовується вільна нітратна кислота для проведення діазотування.
7 Дати визначення реакції азосполучення.
9 Які оптимальні умови проведення реакції азосполучення.
10 Навести рівняння основних і побічних реакцій синтезу п-амінобензолу.
ІІ рівень (оцінка 4)
11 Чому при сульфуруванні використовуються великий надлишок сульфатної кислоти.
12 Навести рівняння основних і побічних реакцій, які відбуваються при одержанні
п-толуолсульфокислоти.
13 Пояснити розрахунок виходу сульфанілової кислоти.
14 Як проводиться контроль ходу реакції діазотування.
15 Навести рівняння основних і побічних реакцій синтезу нітробензолу.
ІІІ рівень (оцінка 5)
16 Яких заходів техніки безпеки необхідно додержуватись при синтезінітробензолу.
17 Пояснити схемуприладудля синтезусульфанілової кислоти.
18 Визначити практичний вихід (%) п-толуолсульфокислоти при реакції сульфурування 20мл толуолу, якщо утворилося 8г п-толуолсульфокислоти.
19 Яких заходів техніки безпеки необхідно додержуватись при проведенні синтезу діазоамінобензолу.
20 Пояснити властивості та використання фенолфталеїну та флуоресцеїну.
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: «Реакції нітрування»; «Реакції сульфурування»; «Реакції діазотування та азосполучення» (різнорівнева письмова робота)
ВАРІАНТ ІII
І рівень (оцінка 3)
1 Пояснити фізико-хімічні властивості та використання α – нітронафталіну.
2 Дати визначення реакції сульфурування.
3 Пояснити області використання п-толуолсульфокислоти та сульфанілової кислоти.
4 Яких заходів техніки безпеки необхідно додержуватись при синтезісульфанілової кислоти.
5 Дати визначення реакції діазотування.
6 Чому не використовується вільна нітратна кислота для проведення діазотування.
7 Пояснити необхідність використання надлишку мінеральної кислоти для проведення діазотування.
8 Пояснити необхідність проведення реакції діазотування у товстостінному стакані при перемішуванні.
9 Які оптимальні умови проведення реакції азосполучення.
10 Навести рівняння основних і побічних реакцій синтезу діазоамінобензолу.
ІІ рівень (оцінка 4)
11 Навести рівняння основних і побічних реакцій, які відбуваються при одержанні α – нітронафталіну
12 Чому температура є важливим чинником, який впливає на хід реакції сульфурування.
13 Пояснити розрахунок виходу сульфанілової кислоти.
14 Як при проведенні діазотування попереджується накопичення нітратної кислоти.
15 Навести рівняння основних і побічних реакцій синтезу фенолфталеїну.
ІІІ рівень (оцінка 5)
16 Яких заходів техніки безпеки необхідно додержуватись при синтезі фенолфталеїну, флуоресцеїну.
17 Визначити практичний вихід (%) нітробензену при реакції нітрування 20мл бензену, якщо утворилося 8мл нітробензену.
18 Пояснити схемуприладудля синтезуп-толуолсульфокислоти.
19 Пояснити фізико-хімічні властивості та використання сульфанілової кислоти.
20 Пояснити схему приладу для синтезу п-амінобензолу.
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: «Реакції нітрування»; «Реакції сульфурування»; «Реакції діазотування та азосполучення» (різнорівнева письмова робота)
ВАРІАНТ ІV
І рівень (оцінка 3)
1 Дати визначення реакції нітрування.
2 Пояснити фізико-хімічні властивості та використання α – нітронафталіну.
3 Які сульфуруючі агенти використовуються для проведення реакції сульфурування.
4 Пояснити області використання п-толуолсульфокислоти та сульфанілової кислоти.
5 Дати визначення реакції діазотування.
6 Чому не використовується вільна нітратна кислота для проведення діазотування.
7 В чому відмінність забарвлених речовин від барвників.
8 Пояснити необхідність проведення реакції діазотування у товстостінному стакані при перемішуванні.
9 Пояснити необхідність для проведення діазотування додержання температури 0-5°С.
10Навести рівняння основних і побічних реакцій, які відбуваються при одержанні сульфанілової кислоти.
ІІ рівень (оцінка 4)
11 Пояснити склад нітруючої суміші та призначення її компонентів.
12 Навести рівняння основних і побічних реакцій, які відбуваються при одержанні нітробензолу.
13 Чому при сульфуруванні використовуються великий надлишок сульфатної кислоти.
14 Пояснити розрахунок виходу п-толуолсульфокислоти.
15 Як проводиться контроль ходу реакції діазотування.
ІІІ рівень (оцінка 5)
16 Яких заходів техніки безпеки необхідно додержуватись при синтезах нітробензолу та
α – нітронафталіну.
17 Пояснити схемуприладудля синтезусульфанілової кислоти.
18 Пояснити фізико-хімічні властивості та використання сульфанілової кислоти.
19 Визначити практичний вихід (%) п-толуолсульфокислоти при реакції сульфурування 20мл толуолу, якщо утворилося 8г п-толуолсульфокислоти.
20 Пояснити властивості та використання п-амінобензолу.
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: «Реакції нітрування»; «Реакції сульфурування»; «Реакції діазотування та азосполучення» (різнорівнева письмова робота)
ВАРІАНТ V
І рівень (оцінка 3)
1 Пояснити фізико-хімічні властивості та використання нітробензолу.
2 Пояснити області використання α – нітронафталіну.
3 Дати визначення реакції сульфурування.
4 Які сульфуруючі агенти використовуються для проведення реакції сульфурування.
5 Дати визначення реакції діазотування.
6 Чому не використовується вільна нітратна кислота для проведення діазотування.
7 Дати визначення реакції азосполучення.
8 В чому відмінність забарвлених речовин від барвників.
9 Навести рівняння основних і побічних реакцій, які відбуваються при одержанні сульфанілової кислоти.
10 Які речовини називаються діазокомпонентами і азокомпонентами.
ІІ рівень (оцінка 4)
11 Навести рівняння основних і побічних реакцій, які відбуваються при одержанні нітробензолу.
12 Чому при сульфуруванні використовуються великий надлишок сульфатної кислоти.
13 Як при проведенні діазотування попереджується накопичення нітратної кислоти.
14 Чому використовуються розчини солей діазонія, а не сухі солі.
15 Навести рівняння основних і побічних реакцій синтезу діазоамінобензолу.
ІІІ рівень (оцінка 5)
16 Пояснити розрахунок виходу α – нітронафталіну.
17 Визначити практичний вихід (%) нітробензену при реакції нітрування 20мл бензену, якщо утворилося 8мл нітробензену.
18 Пояснити фізико-хімічні властивості та використання п-толуолсульфокислоти.
19 Пояснити схему приладу для синтезу діазоамінобензолу.
20 Яких заходів техніки безпеки необхідно додержуватись при проведенні синтезу сульфанілової кислоти.
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: «Реакції нітрування»; «Реакції сульфурування»; «Реакції діазотування та азосполучення» (різнорівнева письмова робота)
ВАРІАНТ VІ
І рівень (оцінка 3)
1 Дати визначення реакції нітрування.
2 Пояснити області використання нітробензолу та α – нітронафталіну.
3 Які сульфуруючі агенти використовуються для проведення реакції сульфурування.
4 Яких заходів техніки безпеки необхідно додержуватись при синтезах п-толуолсульфокислоти та сульфанілової кислоти.
5 Чому не використовується вільна нітратна кислота для проведення діазотування.
6 Дати визначення реакції азосполучення.
7 Пояснити необхідність проведення реакції діазотування у товстостінному стакані при перемішуванні.
9 Які оптимальні умови проведення реакції азосполучення.
10Навести рівняння основних і побічних реакцій, які відбуваються при одержанні нітробензолу.
ІІ рівень (оцінка 4)
11 Пояснити склад нітруючої суміші та призначення її компонентів.
12 Навести рівняння основних і побічних реакцій, які відбуваються при одержанні сульфанілової кислоти.
13 Пояснити розрахунок виходу та сульфанілової кислоти.
14 Чому не зберігаються розчини солей діазонія на світлі.
15 Чому використовуються розчини солей діазонія, а не сухі солі.
ІІІ рівень (оцінка 5)
16 Яких заходів техніки безпеки необхідно додержуватись при синтезах нітробензолу та
α – нітронафталіну.
17 Визначити практичний вихід (%) нітробензену при реакції нітрування 20мл бензену, якщо утворилося 8мл нітробензену.
18 Пояснити схемуприладудля синтезу сульфанілової кислоти.
19 Пояснити фізико-хімічні властивості та використання п-толуолсульфокислоти.
20 Пояснити схему приладу для синтезу фенолфталеїну та флуоресцеїну.
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: «Реакції нітрування»; «Реакції сульфурування»; «Реакції діазотування та азосполучення» (різнорівнева письмова робота)
ВАРІАНТ VIІ
І рівень (оцінка 3)
1 Дати визначення реакції нітрування.
2 Пояснити фізико-хімічні властивості та використання нітробензолу.
3 Які сульфуруючі агенти використовуються для проведення реакції сульфурування.
4 Пояснити області використання п-толуолсульфокислоти та сульфанілової кислоти.
5 Дати визначення реакції діазотування.
6 Чому не використовується вільна нітратна кислота для проведення діазотування.
7 В чому відмінність забарвлених речовин від барвників.
8 Пояснити необхідність проведення реакції діазотування у товстостінному стакані при перемішуванні.
9 Які оптимальні умови проведення реакції азосполучення.
10 Навести рівняння основних і побічних реакцій синтезу діазоамінобензолу.
ІІ рівень (оцінка 4)
11 Пояснити склад нітруючої суміші та призначення її компонентів.
12 Чому при сульфуруванні використовуються великий надлишок сульфатної кислоти.
13 Навести рівняння основних і побічних реакцій, які відбуваються при одержанні сульфанілової кислоти.
14 Пояснити розрахунок виходу п-толуолсульфокислоти.
15Чому не зберігаються розчини солей діазонія на світлі.
ІІІ рівень (оцінка 5)
16 Пояснити схему приладу для синтезу α – нітронафталіну.
17 Яких заходів техніки безпеки необхідно додержуватись при синтезінітробензолу.
18 Визначити практичний вихід (%) нітробензену при реакції нітрування 20мл бензену, якщо утворилося 8мл нітробензену.
19 Пояснити властивості та використання фенолфталеїну та флуоресцеїну.
20 Яких заходів техніки безпеки необхідно додержуватись при проведенні синтезу нітробензену.
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: «Реакції нітрування»; «Реакції сульфурування»; «Реакції діазотування та азосполучення» (різнорівнева письмова робота)
ВАРІАНТ VІII
І рівень (оцінка 3)
1 Пояснити фізико-хімічні властивості та використання α – нітронафталіну.
2 Дати визначення реакції сульфурування.
3 Пояснити області використання п-толуолсульфокислоти та сульфанілової кислоти.
4 Яких заходів техніки безпеки необхідно додержуватись при синтезах п-толуолсульфокислоти та сульфанілової кислоти.
5 Дати визначення реакції азосполучення.
6 Чим обумовлене забарвлення азосполук.
7 В чому відмінність забарвлених речовин від барвників.
8 Пояснити необхідність для проведення діазотування додержання температури 0-5°С.
9 Навести рівняння основних і побічних реакцій, які відбуваються при одержанні сульфанілової кислоти.
10 Які речовини називаються діазокомпонентами і азокомпонентами.
ІІ рівень (оцінка 4)
11 Пояснити склад нітруючої суміші та призначення її компонентів.
12 Чому температура є важливим чинником, який впливає на хід реакції сульфурування.
13 Навести рівняння основних і побічних реакцій, які відбуваються при одержаннідіазоамінобензолу.
14 Пояснити розрахунок виходу п-толуолсульфокислоти.
15Чому не зберігаються розчини солей діазонія на світлі.
ІІІ рівень (оцінка 5)
16 Яких заходів техніки безпеки необхідно додержуватись при синтезах нітробензолу та
α – нітронафталіну.
17 Визначити практичний вихід (%) нітробензену при реакції нітрування 20мл бензену, якщо утворилося 8мл нітробензену.
18 Пояснити схему приладу для синтезу фенолфталеїну та флуоресцеїну.
19 Пояснити розрахунок виходу діазоамінобензолу.
20 Пояснити властивості та використання діазоамінобензолу.
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: «Реакції нітрування»; «Реакції сульфурування»; «Реакції діазотування та азосполучення» (різнорівнева письмова робота)
ВАРІАНТ ІX
І рівень (оцінка 3)
1 Дати визначення реакції нітрування.
2 Які нітруючі агенти використовуються для проведення реакції нітрування.
3 Дати визначення реакції сульфурування.
4 Пояснити області використання п-толуолсульфокислоти та сульфанілової кислоти.
5 Яких заходів техніки безпеки необхідно додержуватись при синтезах п-толуолсульфокислоти та сульфанілової кислоти.
6 Пояснити необхідність використання надлишку мінеральної кислоти для проведення діазотування.
7 Пояснити необхідність проведення реакції діазотування у товстостінному стакані при перемішуванні.
8 Пояснити необхідність для проведення діазотування додержання температури 0-5°С.
9 Навести рівняння основних і побічних реакцій, які відбуваються при одержанні нітробензолу.
10 Які речовини називаються діазокомпонентами і азокомпонентами.
ІІ рівень (оцінка 4)
11 Пояснити склад нітруючої суміші та призначення її компонентів.
12 Чому при сульфуруванні використовуються великий надлишок сульфатної кислоти.
13 Чому температура є важливим чинником, який впливає на хід реакції сульфурування.
14 Чому використовуються розчини солей діазонія, а не сухі солі.
15 Навести рівняння основних і побічних реакцій синтезу фенолфталеїну, флуоресцеїну.
ІІІ рівень (оцінка 5)
16 Пояснити схему приладу для синтезу нітробензолу.
17 Яких заходів техніки безпеки необхідно додержуватись при синтезах нітробензолу та
α – нітронафталіну.
18 Визначити практичний вихід (%) нітробензену при реакції нітрування 20мл бензену, якщо утворилося 8мл нітробензену.
19 Пояснити фізико-хімічні властивості та використання діазоамінобензолу.
20 Пояснити схему приладу для синтезу п-амінобензолу.
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: «Реакції нітрування»; «Реакції сульфурування»; «Реакції діазотування та азосполучення» (різнорівнева письмова робота)
ВАРІАНТ X
І рівень (оцінка 3)
1 Дати визначення реакції нітрування.
2 Пояснити області використання нітробензолу та α – нітронафталіну.
3 Які сульфуруючі агенти використовуються для проведення реакції сульфурування.
4 Яких заходів техніки безпеки необхідно додержуватись при синтезах п-толуолсульфокислоти та сульфанілової кислоти.
5 Дати визначення реакції азосполучення.
6 В чому відмінність забарвлених речовин від барвників.
7 Пояснити необхідність для проведення діазотування додержання температури 0-5°С.
8 Які оптимальні умови проведення реакції азосполучення.
9 Які речовини називаються діазокомпонентами і азокомпонентами.
10 Навести рівняння основних і побічних реакцій синтезу фенолфталеїну.
ІІ рівень (оцінка 4)
11 Пояснити склад нітруючої суміші та призначення її компонентів.
12 Навести рівняння основних і побічних реакцій, які відбуваються при одержанні
α – нітронафталіну
13 Чому температура є важливим чинником, який впливає на хід реакції сульфурування.
14 Пояснити розрахунок виходу продукту: п-толуолсульфокислоти та сульфанілової кислоти.
15 Чому використовуються розчини солей діазонія, а не сухі солі.
ІІІ рівень (оцінка 5)
16 Пояснити розрахунок виходу α – нітронафталіну.
17 Яких заходів техніки безпеки необхідно додержуватись при синтезах нітробензолу та
α – нітронафталіну.
18 Пояснити схемуприладудля синтезу сульфанілової кислоти.
19 Пояснити фізико-хімічні властивості та використання п-толуолсульфокислоти.
20 Пояснити схему приладу для синтезу фенолфталеїну та флуоресцеїну.
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: «Реакції алкілування» , «Реакції Канниццаро та Клайзена»,
«Реакції полімеризації та поліконденсації» (різнорівнева письмова робота)
ВАРІАНТ І
І рівень (оцінка 3)
1 Дати визначення реакції алкілування
2 Пояснити області використаннядіізоамілового етеру та нероліну.
3 Дати визначення реакціямФриделя – Крафтса, Канниццаро та Клайзена.
4 Яких заходів техніки безпеки необхідно дотримуватись при синтезах діізоамілового етеру та нероліну?
5 Які алкілюючі агенти використовуються для проведення реакції?
6 Дати визначення реакціям полімеризації та поліконденсації.
7 Пояснити на прикладі фенолоформальдегідної смоли залежність властивостей смоли від умов синтезу.
8 Пояснити області використання глифталевої і фенолоформальдегідної смол.
9 Навести рівняння основних і побічних реакцій, які відбуваються при одержанні діізоамілового етеру.
ІІ рівень (оцінка 4)
10 Яких заходів техніки безпеки необхідно дотримуватись при синтезі бензойної кислоти і бензилового спирту.
11 Пояснити суть різних видів полімеризації в залежності від її механізму – радикального та йонного.
12 Пояснити суть різних методів проведення полімеризації – в блоці, в розчині, в емульсії.
13 Пояснити фізико-хімічні властивості та використання нероліну.
14 Пояснити умови проведення реакції Фриделя - Крафтса
15 Навестирівнянняосновних реакцій, які відбуваються при одержанні
фенолоформальдегідної смоли.
ІІІ рівень (оцінка 5)
16 Пояснити розрахунок виходу діізоамілового етеру.
17 Пояснити схему установки для синтезу ацетооцтового естеру.
18 Пояснити фізико-хімічні властивості та використання діізоамілового етеру та нероліну
19 Яких заходів техніки безпеки необхідно дотримуватись при синтезах глифталевої і
фенолоформальдегідної смоли.
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: «Реакції алкілування» , «Реакції Канниццаро та Клайзена»,
«Реакції полімеризації та поліконденсації» (різнорівнева письмова робота)
ВАРІАНТ ІI
І рівень (оцінка 3)
1 Які алкілюючі агенти використовуються для проведення реакції?
2 Пояснити області використання ацетооцтового естеру.
3 Дати визначення реакціямФриделя – Крафтса, Канниццаро та Клайзена.
4 Пояснити умови проведення реакції Фриделя - Крафтса
5 Які алкілюючі агенти використовуються для проведення реакції?
6 Дати визначення реакціям полімеризації та поліконденсації.
7 Пояснити на прикладі фенолоформальдегідної смоли залежність властивостей смоли від умов синтезу.
8 Пояснити області використання глифталевої і фенолоформальдегідної смол.
9 Навести рівняння основних і побічних реакцій, які відбуваються при одержанні бензойної кислоти і бензилового спирту.
ІІ рівень (оцінка 4)
10 Чому перед синтезом діізоамілового етеру та нероліну всі реагенти необхідно висушити?
11 Яких заходів техніки безпеки необхідно дотримуватись при синтезахдіізоамілового етеру та нероліну
12 Навести приклади основнихта побічних реакцій, які відбуваються при одержаннінероліну.
13 Пояснити суть різних видів полімеризації – ланцюгової та ступінчастої.
14 Пояснити суть різних видів полімеризації в залежності від її механізму – радикального та йонного.
15 Пояснити суть різних методів проведення полімеризації – в блоці, в розчині, в емульсії.
ІІІ рівень (оцінка 5)
16 Пояснити розрахунок виходу бензойної кислоти і бензилового спирту.
17 Пояснити фізико-хімічні властивості та використання діізоамілового етеру.
18 Пояснити схему установки для синтезу нероліну.
19 Навестирівнянняосновних реакцій, які відбуваються при одержанні глифталевої смоли.
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: «Реакції алкілування» , «Реакції Канниццаро та Клайзена»,
«Реакції полімеризації та поліконденсації» (різнорівнева письмова робота)
ВАРІАНТ ІII
І рівень (оцінка 3)
1 Дати визначення реакції алкілування
2 Які алкілюючі агенти використовуються для проведення реакції?
3 Пояснити області використання бензойної кислоти і бензилового спирту.
4 Дати визначення реакціямФриделя – Крафтса, Канниццаро та Клайзена.
5 Дати визначення реакції алкілування
6 Пояснити області використаннядіізоамілового етеру та нероліну.
7 Дати визначення реакціям полімеризації та поліконденсації.
8 Пояснити області використання глифталевої і фенолоформальдегідної смол.
9 Навести рівняння основних і побічних реакцій, які відбуваються при одержанні бензойної кислоти і бензилового спирту.
ІІ рівень (оцінка 4)
10 Чому перед синтезом діізоамілового етеру всі реагенти необхідно висушити?
11 Яких заходів техніки безпеки необхідно дотримуватись при синтезінероліну?
12 Навести приклади основнихта побічних реакцій, які відбуваються при одержаннігліфталевої смоли.
13 Пояснити суть різних видів полімеризації – ланцюгової та ступінчастої.
14 Пояснити суть різних видів полімеризації в залежності від її механізму – радикального та йонного.
15 Пояснити суть різних методів проведення полімеризації – в блоці, в розчині, в емульсії.
ІІІ рівень (оцінка 5)
16 Пояснити розрахунок виходу бензойної кислоти і бензилового спирту.
17 Пояснити фізико-хімічні властивості та використання ацетооцтового естеру.
18 Пояснити схему установки для синтезу бензойної кислоти і бензилового спирту.
19 Яких заходів техніки безпеки необхідно дотримуватись при синтезах глифталевої і
фенолоформальдегідної смол.
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: «Реакції алкілування» , «Реакції Канниццаро та Клайзена»,
«Реакції полімеризації та поліконденсації» (різнорівнева письмова робота)
ВАРІАНТ ІV
І рівень (оцінка 3)
1 Дати визначення реакції алкілування
2 Пояснити області використаннядіізоамілового етеру.
3 Дати визначення реакціямФриделя – Крафтса, Канниццаро та Клайзена.
4 Дати визначення реакції алкілування
5 Які алкілюючі агенти використовуються для проведення реакції?
6 Пояснити області використаннянероліну.
7 Дати визначення реакціям полімеризації та поліконденсації.
8 Пояснити на прикладі фенолоформальдегідної смоли залежність властивостей смоли від умов синтезу.
9 Навести рівняння основних і побічних реакцій, які відбуваються при одержанні ацетооцтового естеру.
ІІ рівень (оцінка 4)
10 Чому перед синтезом діізоамілового етеру та нероліну всі реагенти необхідно висушити?
11 Яких заходів техніки безпеки необхідно дотримуватись при синтезахдіізоамілового етеру та нероліну.
12 Навести приклади основнихта побічних реакцій, які відбуваються при одержаннінероліну.
13 Пояснити суть різних видів полімеризації – ланцюгової та ступінчастої.
14 Пояснити суть різних видів полімеризації в залежності від її механізму – радикального та йонного.
15 Пояснити суть різних методів проведення полімеризації – в блоці, в розчині, в емульсії.
ІІІ рівень (оцінка 5)
16 Пояснити розрахунок виходу бензойної кислоти і бензилового спирту.
17 Пояснити фізико-хімічні властивості та використання нероліну.
18 Пояснити схему установки для синтезу бензойної кислоти і бензилового спирту.
19 Навести приклади основних реакцій, які відбуваються при одержанні глифталевої смоли.
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: «Реакції алкілування» , «Реакції Канниццаро та Клайзена»,
«Реакції полімеризації та поліконденсації» (різнорівнева письмова робота)
ВАРІАНТ V
І рівень (оцінка 3)
1 Дати визначення реакції алкілування
2 Дати визначення реакціямФриделя – Крафтса, Канниццаро та Клайзена.
3 Пояснити умови реакцій Канниццаро та Клайзена.
4 Яких заходів техніки безпеки необхідно дотримуватись при синтезі нероліну?
5 Дати визначення реакції алкілування.
6 Які алкілюючі агенти використовуються для проведення реакції?
7 Пояснити області використаннядіізоамілового етеру.
8 Пояснити на прикладі фенолоформальдегідної смоли залежність властивостей смоли від умов синтезу.
9 Навести рівняння основних і побічних реакцій, які відбуваються при одержанні діізоамілового етеру.
ІІ рівень (оцінка 4)
10 Яких заходів техніки безпеки необхідно дотримуватись при синтезі бензойної кислоти і бензилового спирту.
11 Чому перед синтезом діізоамілового етеру та нероліну всі реагенти необхідно висушити?
12 Навести приклади основнихта побічних реакцій, які відбуваються при одержаннідіізоамілового етеру.
13 Пояснити суть різних видів полімеризації – ланцюгової та ступінчастої.
14 Пояснити суть різних видів полімеризації в залежності від її механізму – радикального та йонного.
15 Пояснити суть різних методів проведення полімеризації – в блоці, в розчині, в емульсії.
ІІІ рівень (оцінка 5)
16 Пояснити розрахунок виходу ацетооцтового естеру.
17 Пояснити схему установки для синтезу діізоамілового етеру.
18 Навести приклади основних реакцій, які відбуваються при одержанні глифталевої смоли.
19 Яких заходів техніки безпеки необхідно дотримуватись при синтезах глифталевої і
фенолоформальдегідної смоли.
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: «Реакції алкілування» , «Реакції Канниццаро та Клайзена»,
«Реакції полімеризації та поліконденсації» (різнорівнева письмова робота)
ВАРІАНТ VІ
І рівень (оцінка 3)
1 Дати визначення реакції алкілування
2 Пояснити області використаннядіізоамілового етеру.
3 Дати визначення реакціямФриделя – Крафтса, Канниццаро та Клайзена.
4 Дати визначення реакції алкілування.
5 Які алкілюючі агенти використовуються для проведення реакції?
6 Пояснити області використаннята властивості ацетооцтового естеру.
7 Дати визначення реакціям полімеризації та поліконденсації.
8 Пояснити на прикладі фенолоформальдегідної смоли залежність властивостей смоли від умов синтезу.
9 Навести рівняння основних і побічних реакцій, які відбуваються при одержанні бензойної кислоти і бензилового спирту.
ІІ рівень (оцінка 4)
10 Яких заходів техніки безпеки необхідно дотримуватись при синтезі бензойної кислоти і бензилового спирту.
11 Чому перед синтезом діізоамілового етеру та нероліну всі реагенти необхідно висушити?
12 Навести приклади основнихта побічних реакцій, які відбуваються при одержаннідіізоамілового етеру.
13 Пояснити суть різних видів полімеризації – ланцюгової та ступінчастої.
14 Пояснити суть різних видів полімеризації в залежності від її механізму – радикального та йонного.
15 Пояснити суть різних методів проведення полімеризації – в блоці, в розчині, в емульсії.
ІІІ рівень (оцінка 5)
16 Пояснити розрахунок виходу ацетооцтового естеру.
17 Пояснити схему установки для синтезу нероліну.
18 Пояснити умови проведення реакції Фриделя - Крафтса
19 Навести приклади основних реакцій, які відбуваються при одержанні глифталевої і
фенолоформальдегідної смол.
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: «Реакції алкілування» , «Реакції Канниццаро та Клайзена»,
«Реакції полімеризації та поліконденсації» (різнорівнева письмова робота)
ВАРІАНТ VIІ
І рівень (оцінка 3)
1 Дати визначення реакції алкілування
2 Які алкілюючі агенти використовуються для проведення реакції?
3 Пояснити області використаннядіізоамілового етеру та нероліну.
4 Дати визначення реакціямФриделя – Крафтса, Канниццаро та Клайзена.
5 Дати визначення реакції алкілування
6 Які алкілюючі агенти використовуються для проведення реакції?
7 Дати визначення реакціям полімеризації та поліконденсації.
8 Пояснити на прикладі фенолоформальдегідної смоли залежність властивостей смоли від умов синтезу.
9 Навести рівняння основних і побічних реакцій, які відбуваються при одержанні ацетооцтового естеру.
ІІ рівень (оцінка 4)
10 Яких заходів техніки безпеки необхідно дотримуватись при синтезі бензойної кислоти і бензилового спирту.
11 Яких заходів техніки безпеки необхідно дотримуватись при синтезах діізоамілового етеру та нероліну.
12 Навести приклади основнихта побічних реакцій, які відбуваються при одержаннінероліну
13 Пояснити суть різних видів полімеризації – ланцюгової та ступінчастої.
14 Пояснити суть різних видів полімеризації в залежності від її механізму – радикального та йонного.
15 Пояснити суть різних методів проведення полімеризації – в блоці, в розчині, в емульсії.
ІІІ рівень (оцінка 5)
16 Пояснити розрахунок виходу бензойної кислоти і бензилового спирту.
17 Пояснити фізико-хімічні властивості та використання діізоамілового етеру.
18 Пояснити схему установки для синтезу ацетооцтового естеру.
19 Яких заходів техніки безпеки необхідно дотримуватись при синтезах глифталевої і
фенолоформальдегідної смоли.
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: «Реакції алкілування» , «Реакції Канниццаро та Клайзена»,
«Реакції полімеризації та поліконденсації» (різнорівнева письмова робота)
ВАРІАНТ VІII
І рівень (оцінка 3)
1 Які алкілюючі агенти використовуються для проведення реакції?
2 Пояснити умови реакцій Канниццаро та Клайзена.
3 Яких заходів техніки безпеки необхідно дотримуватись при синтезах?
4 Дати визначення реакції алкілування
5 Які алкілюючі агенти використовуються для проведення реакції?
6 Пояснити області використаннядіізоамілового етеру та нероліну.
7 Дати визначення реакціям полімеризації та поліконденсації.
8 Пояснити області використання глифталевої і фенолоформальдегідної смол.
9 Навести рівняння основних і побічних реакцій, які відбуваються при одержанні діізоамілового етеру.
ІІ рівень (оцінка 4)
10 Чому перед синтезом діізоамілового етеру та нероліну всі реагенти необхідно висушити?
11 Яких заходів техніки безпеки необхідно дотримуватись при синтезахдіізоамілового етеру та нероліну.
12 Навести приклади основнихта побічних реакцій, які відбуваються при одержанні бензойної кислоти і бензилового спирту.
13 Пояснити суть різних видів полімеризації – ланцюгової та ступінчастої.
14 Пояснити суть різних видів полімеризації в залежності від її механізму – радикального та йонного.
15 Пояснити суть різних методів проведення полімеризації – в блоці, в розчині, в емульсії.
ІІІ рівень (оцінка 5)
16 Пояснити розрахунок виходу нероліну.
17 Пояснити фізико-хімічні властивості та використання ацетооцтового естеру.
18 Пояснити схему установки для синтезу бензойної кислоти і бензилового спирту.
19 Яких заходів техніки безпеки необхідно дотримуватись при синтезіацетооцтового естеру?
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: «Реакції алкілування» , «Реакції Канниццаро та Клайзена»,
«Реакції полімеризації та поліконденсації» (різнорівнева письмова робота)
ВАРІАНТ ІX
І рівень (оцінка 3)
1 Пояснити області використання ацетооцтового естеру, бензойної кислоти і бензилового спирту.
2 Дати визначення реакціямФриделя – Крафтса, Канниццаро та Клайзена.
3 Яких заходів техніки безпеки необхідно дотримуватись при синтезах діізоамілового етеру та нероліну?
4 Дати визначення реакції алкілування
5 Пояснити області використаннядіізоамілового етеру та нероліну
6 Дати визначення реакціям полімеризації та поліконденсації.
7 Пояснити на прикладі фенолоформальдегідної смоли залежність властивостей смоли від умов синтезу.
8 Пояснити області використання глифталевої і фенолоформальдегідної смол.
9 Навести рівняння основних і побічних реакцій, які відбуваються при одержанні діізоамілового етеру.
ІІ рівень (оцінка 4)
10 Яких заходів техніки безпеки необхідно дотримуватись при синтезі бензойної кислоти і бензилового спирту.
11 Чому перед синтезом діізоамілового етеру та нероліну всі реагенти необхідно висушити?
12 Навести приклади основнихта побічних реакцій, які відбуваються при одержаннідіізоамілового етеру та нероліну.
13 Пояснити суть різних видів полімеризації – ланцюгової та ступінчастої.
14 Пояснити суть різних видів полімеризації в залежності від її механізму – радикального та йонного.
15 Пояснити суть різних методів проведення полімеризації – в блоці, в розчині, в емульсії.
ІІІ рівень (оцінка 5)
16 Пояснити розрахунок виходу діізоамілового етеру.
17 Пояснити фізико-хімічні властивості та використання ацетооцтового естеру.
18 Пояснити схеми установок для синтезів діізоамілового.
19 Пояснити залежність властивостей полімеру від кількості функціональних групувихідному мономері при проведенні поліконденсації.
ТЕМАТИЧНЕ ОЦІНЮВАННЯ
з тем: «Реакції алкілування» , «Реакції Канниццаро та Клайзена»,
«Реакції полімеризації та поліконденсації» (різнорівнева письмова робота)
ВАРІАНТ X
І рівень (оцінка 3)
1 Дати визначення реакції алкілування
2 Дати визначення реакціямФриделя – Крафтса, Канниццаро та Клайзена.
3 Пояснити умови проведення реакції Фриделя - Крафтса
4 Які алкілюючі агенти використовуються для проведення реакції?
5 Пояснити області використаннядіізоамілового етеру та нероліну
6 Дати визначення реакціям полімеризації та поліконденсації.
7 Пояснити на прикладі фенолоформальдегідної смоли залежність властивостей смоли від умов синтезу.
8 Пояснити області використання глифталевої і фенолоформальдегідної смол.
9 Навести рівняння основних і побічних реакцій, які відбуваються при одержанні ацетооцтового естеру.
ІІ рівень (оцінка 4)
10 Яких заходів техніки безпеки необхідно дотримуватись при синтезі бензойної кислоти і бензилового спирту.
11 Чому перед синтезом діізоамілового етеру та нероліну всі реагенти необхідно висушити?
12 Навести приклади основнихта побічних реакцій, які відбуваються при одержаннідіізоамілового етеру та нероліну.
13 Пояснити суть різних видів полімеризації – ланцюгової та ступінчастої.
14 Пояснити суть різних видів полімеризації в залежності від її механізму – радикального та йонного.
15 Пояснити суть різних методів проведення полімеризації – в блоці, в розчині, в емульсії.
ІІІ рівень (оцінка 5)
16 Пояснити розрахунок виходу ацетооцтового естеру.
17 Пояснити фізико-хімічні властивості та використання діізоамілового етеру та нероліну.
18 Пояснити схему установки для синтезу бензойної кислоти і бензилового спирту.
19 Яких заходів техніки безпеки необхідно дотримуватись при синтезіглифталевої і
фенолоформальдегідної смоли.
