
- •Зміст і послідовність виконання завдань:
- •З навчальної практики «органічний синтез»
- •Зміст і послідовність виконання завдань:
- •З навчальної практики «органічний синтез»
- •Зміст і послідовність виконання завдань:
- •З навчальної практики «органічний синтез»
- •Зміст і послідовність виконання завдань:
- •Зміст і послідовність виконання завдань:
- •Основна реакція:
- •Основна реакція:
- •Зміст і послідовність виконання завдань:
- •Основні реакції:
- •Зміст і послідовність виконання завдань:
- •Основна реакція:
- •Зміст і послідовність виконання завдань:
- •Основна реакція:
З навчальної практики «органічний синтез»
ТЕМА: Одержання етилового естеру хлороцтової кислоти (етилхлорацетату) СН2СlСОС2Н5
РОБОЧЕ МІСЦЕ: ХІМІЧНІ ЛАБОРАТОРІЇ ХТК ТРИВАЛІСТЬ ЗАНЯТТЯ: 4 ГОДИНИ
МЕТА ПРОВЕДЕННЯ ЗАНЯТТЯ:
ЗАКРІПЛЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ З ТЕМИ,
ПІДТВЕРДЖЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ ПРИ ВИКОНАННІ ЛАБОРАТОРНИХ ДОСЛІДІВ;
ОВОЛОДІННЯ МЕТОДОМ СИНТЕЗУ.
МАТЕРІАЛЬНО-ТЕХНІЧНЕ ОСНАЩЕННЯ РОБОЧОГО МІСЦЯ:
хлороцтова кислота, етанол, конц. сульфатна кислота, натрію гідрокарбонат натрію, насичений розчин; кальція хлорид. Колба круглодонна на 100мл, холодильник Лібіха, трубка хлоркальцієва, воронка дилільна, стакан, колба конічна плоскодонна.
ПРАВИЛА ОХОРОНИ ПРАЦІ:
Дотримуватися обережності при поводженні з хімічними реактивами, скляним посудом, електричним нагрівальним приладом. Дотримуватись обережності при роботі з хімічними реактивами, скляним посудом. Працювати з етиловим естером обережно, тому що він роздратовує слизові оболонки. Хлороцтова кислота викликає опіки шкіри.
Реакція
ацілювання
- процес заміщення атому гідрогену у
деяких функціональних групах (гідроксильна
ОН, аміногрупа NH2
) на залишок карбонових кислот (ацилгрупу)
R
─ СО ─
Речовини, що містять у своєму складі ацилгрупу – ацилюючі агенти.
Це карбонові кислоти, їх ангідриди, аміди.
Речовини, в склад яких вводиться ацилгрупа - ацилюються. Це спирти, аміни, феноли.
O O
║ t, H2 SO4 ║
R ─ C ─ C1 + HOR1 -----------→ R ─ C ─ O ─ R1 + H2O
Хлорангідрид карбонової Спирт
кислоти
В реакцію ацілювання спиртів хлорангідридами кислот з утворенням естерів легко вступають первинні і вторинні спирти. Якщо реакція відбувається бурхливо, необхідно охолоджувати суміш або використовувати розчинники. Залишок непрореагувавшого хлорангідриду видаляють, оброблюючи суміш розчином натрій карбонату. Отриманий естер очищують перегонкою або кристалізацією.
Основна реакція:
H2SO4
СН2СlСООН + С2Н5ОН <======> СН2СlСОС2Н5
ЗМІСТ І ПОСЛІДОВНІСТЬ ВИКОНАННЯ ЗАВДАНЬ:
1 Круглодонну колбу ємністю 100мл з’єднують з оборотним (шариковим) водяним холодильником, до якого приєднується хлоркальцієва трубка, необхідна для захисту реакційного середовища від доступу повітря.
2 В колбу поміщують 2г хлороцтової кислоти; 1,5мл етанолу; 0,1мл концентрованої сульфатної кислоти та нагрівають суміш на піщаній бані протягом 4 – 5 годин.
3 По закінченні реакції суміш охолоджують, а потім виливають у стакан з 10мл льодяної води.
4 Із стакану суміш переноситься у ділильну воронку, відокремлюють нищий водний шар, а естерний шар нейтралізують 1мл насиченого розчину Na2CO3 та промивають водою до нейтральної реакції.
5 Потім сирий естер сушиться протягом 10 – 12 годин безводним кальцій хлоридом.
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ЩОДО ВИКОНАННЯ Й ОФОРМЛЕННЯ:
При виконанні дослідів строго дотримуватися кількості реагентів та методики виконання роботи, які вказані в інструкції, а також заходів техніки безпеки.
Розрахувати практичний вихід (%)етилхлорацетату.
По закінченню роботи зробити загальний висновок.
ПІСЛЯ ВИКОНАННЯ ЛАБОРАТОРНОЇ РОБОТИ СТУДЕНТ ПОВИНЕН:
ЗНАТИ:
1 Рівняння хімічних реакцій, що відбуваються при синтезі
2 Умови проведення процесу
3 Обладнання, що використовується для синтезу
4 Фізико – хімічні властивості та використання речовин
УМІТИ:
1 Провести необхідні синтези
2 Зібрати установку для синтезу
3 Працювати самостійно згідно інструкції
4 Невідступно дотримуватись заходів техніки безпеки
5 Провести розрахунок практичного та теоретичного виходів продукту
6 Знайти необхідні довідникові дані у довіднику
ЗАХИСТ РОБОТИ:
Дати визначення реакції ацілювання.
Пояснити які ацілюючі агенти використовуються.
Навести основні і побічні реакції синтезу етилхлорацетату.
Пояснити схему приладу для синтезу етилхлорацетату.
Пояснити розрахунок виходу етилхлорацетату.
Яких заходів техніки безпеки необхідно додержуватись при синтезі етилхлорацетату.
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ:
Визначити масу практичного виходу продукту з 10г етанолу, якщо практичний вихід складає 80% (мас. часток).
Пояснити фізико-хімічні властивості етилхлорацетату.
Пояснити області застосування етилхлорацетату.
ЛІТЕРАТУРА
1. Храмкина М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. С 142 – 149, 153 - 154.
2. Храмкина М.Н. Практикум по органическому синтезу.- М.: Химия, 1974.
3. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
4. Потапов В.М., Татаринчик С.Н. Органическая химия. М.: Химия,1980.
5. Аверина А.В. Лабораторный практикум по органической химии.- М.: Высш.шк., 1980.
6. Березан О.М. Органічна хімія.- К.: Абрис, 2000.
ІНСТРУКЦІЙНА КАРТКА ДЛЯ ПРОВЕДЕННЯ ЛАБОРАТОРНОГО ЗАНЯТТЯ
З НАВЧАЛЬНОЇ ПРАКТИКИ «ОРГАНІЧНИЙ СИНТЕЗ»
ТЕМА: Одержання бензойної кислоти С6Н5ОН
РОБОЧЕ МІСЦЕ: ХІМІЧНІ ЛАБОРАТОРІЇ ХТК ТРИВАЛІСТЬ ЗАНЯТТЯ: 4 ГОДИНИ
МЕТА ПРОВЕДЕННЯ ЗАНЯТТЯ:
ЗАКРІПЛЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ З ТЕМИ,
ПІДТВЕРДЖЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ ПРИ ВИКОНАННІ ЛАБОРАТОРНИХ ДОСЛІДІВ;
ОВОЛОДІННЯ МЕТОДОМ СИНТЕЗУ.
МАТЕРІАЛЬНО-ТЕХНІЧНЕ ОСНАЩЕННЯ РОБОЧОГО МІСЦЯ:
перманганат калію, толуол, хлоридна кислота, воронки, колби з зворотним холодильником, фарфорові чашки, склянки, палички, чашки Петрі.
ПРАВИЛА ОХОРОНИ ПРАЦІ:
Дотримуватися обережності при поводженні з хімічними реактивами, скляним посудом, електричним нагрівальним приладом. Дихання парою толуолу діє на нервову систему.
Реакція окиснення - це процес віддачі атомів гідрогену або приєднання атому оксигену.
Окисненню підлягають більшість органічних сполук. Найважливіші окиснювачі: кисень повітря, перманганат калію, хромовий ангідрид, біхромат калію, хромова суміш. Реакція використовується для одержання оксигенвмісних сполук.
t, (О)
Наприклад: R --- OH --------→ R – COH + H2O
спирт альдегід
Одержання бензойної кислоти — це процес окиснення толуолу в присутності окиснювача перманганату калію.
Основна реакція:
СН3 COOH




+ 2KMnO4 ---► + KOH + H2 O + 2MnO2
ЗМІСТ І ПОСЛІДОВНІСТЬ ВИКОНАННЯ ЗАВДАНЬ:
1 У круглодонній колбі з зворотнім холодильником кип'ятять впродовж 3 годин на водяній бані
1,15 мл толуолу з 70 мл води і 3,4г дрібнорозтертого перманганату калію. Для рівномірного кипіння реакційної суміші до колби додають декілька шматочків фарфору.
2 Якщо не відбулось знезбарвлення до розчину додають 0,5 - 1 мл етилового спирту або 0,1 - 0,2 г щавелевой кислоти і нагрівають.
3 Після закінчення реакції знебарвлений розчин охолоджують, випавший діоксид мангану відфільтровують і двічи промивають теплою водою (по 2,5 мл)
4 Фільтрат упарюють до об'єму 12,5 - 20 мл і підкислюють концентрованою соляною кислотою до кислої реакції по Конго-індікатору. При цьому осаждується бензойна кислота у вигляді білих кришталів.
5 Її відфільтровують, промивають невеликою кількістю холодної води і сушать.
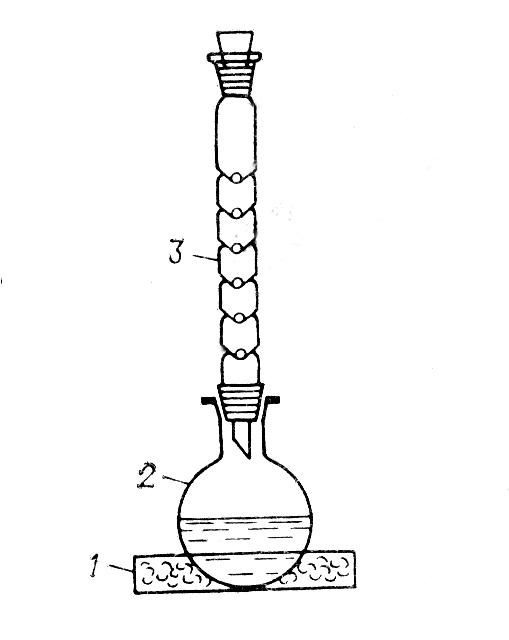
1 – водяна баня;
2 – круглодонна колба;
3 – дефлегматор.
Рисунок 5 – Прилад для одержання бензойної кислоти
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ЩОДО ВИКОНАННЯ Й ОФОРМЛЕННЯ:
При виконанні дослідів строго дотримуватися кількості реагентів та методики виконання роботи, які вказані в інструкції, а також заходів техніки безпеки.
Розрахувати практичний вихід (%) кислоти.
По закінченню роботи зробити загальний висновок.
ПІСЛЯ ВИКОНАННЯ ЛАБОРАТОРНОЇ РОБОТИ СТУДЕНТ ПОВИНЕН:
ЗНАТИ:
1 Рівняння хімічних реакцій, що відбуваються при синтезі
2 Умови проведення процесу
3 Обладнання, що використовується для синтезу
4 Фізико – хімічні властивості та використання речовин
УМІТИ:
1 Провести необхідні синтези
2 Зібрати установку для синтезу
3 Працювати самостійно згідно інструкції
4 Невідступно дотримуватись заходів техніки безпеки
5 Провести розрахунок практичного та теоретичного виходів продукту
6 Знайти необхідні довідникові дані у довіднику
ЗАХИСТ РОБОТИ:
Дати визначення реакції окиснення.
Від чого залежить дія окисника на органічну речовину.
Пояснити вибір умов для проведення окиснення.
Навести рівняння основних і побічних реакцій, які відбуваються при одержанні бензойної кислоти.
Пояснити схеми приладів для синтезу бензойної кислоти.
Пояснити розрахунок виходу продуктів окиснення.
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ:
Які окисники використовуються для проведення окиснення?
Пояснити фізико-хімічні властивості бензойної кислоти.
Пояснити області застосування бензойної кислоти.
Яких заходів техніки безпеки необхідно додержуватись при синтезі бензойної кислоти?
ЛІТЕРАТУРА
1. Храмкина М.Н. Практикум по органическому синтезу.- Л.: Химия, 1988. С 166 – 170, 183 - 184.
2. Храмкина М.Н. Практикум по органическому синтезу.- М.: Химия, 1974.
3. Гороновский И.Г. Краткий справочник по химии.- К.:Наукова думка, 1974.
4. Потапов В.М., Татаринчик С.Н. Органическая химия. М.: Химия,1980.
5. Аверина А.В. Лабораторный практикум по органической химии.- М.: Высш.шк., 1980.
6. Березан О.М. Органічна хімія.- К.: Абрис, 2000.
ІНСТРУКЦІЙНА КАРТКА ДЛЯ ПРОВЕДЕННЯ ЛАБОРАТОРНОГО ЗАНЯТТЯ
З НАВЧАЛЬНОЇ ПРАКТИКИ «ОРГАНІЧНИЙ СИНТЕЗ»
ТЕМА: Одержання ацетальдегіду СН3СНО
РОБОЧЕ МІСЦЕ: ХІМІЧНІ ЛАБОРАТОРІЇ ХТК ТРИВАЛІСТЬ ЗАНЯТТЯ: 4 ГОДИНИ
МЕТА ПРОВЕДЕННЯ ЗАНЯТТЯ:
ЗАКРІПЛЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ З ТЕМИ,
ПІДТВЕРДЖЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ ПРИ ВИКОНАННІ ЛАБОРАТОРНИХ ДОСЛІДІВ;
ОВОЛОДІННЯ МЕТОДОМ СИНТЕЗУ.
МАТЕРІАЛЬНО-ТЕХНІЧНЕ ОСНАЩЕННЯ РОБОЧОГО МІСЦЯ:
Етиловий спирт, концентрована H2SO4, біхромат калію. Скляні та фарфорові склянки, воронки, прилади для перегонки, палички, колби, мірні ціліндри.
ПРАВИЛА ОХОРОНИ ПРАЦІ:
Дотримуватися обережності при поводженні з хімічними реактивами, скляним посудом, електричним нагрівальним приладом. Ацетальдегід подразнює слизові оболонки. Утворює з повітрям вибухонебезпечні суміші.
Реакція окиснення - це процес віддачі атомів гідрогену або приєднання атому оксигену.
Окисненню підлягають більшість органічних сполук. Найважливіші окиснювачі: кисень повітря, перманганат калію, хромовий ангідрид, біхромат калію, хромова суміш. Реакція використовується для одержання оксигенвмісних сполук.
Одержання ацетальдегіду - це процес окиснення етилового спирту в присутності окиснювача - хромової суміші.
Основна реакція:
3СН3СН2ОН + K2Cr2О7 + 4H2SO4 --------► ЗСН3СНО + K2SO4 + Cr 2(SO4)3 + 7Н2О
